Witamina D powyżej 50 ng/mL teoretycznie mogłaby obniżyć wskaźnik śmiertelności na C-19 do zera – przegląd systematyczny i metaanaliza
Źródło: Nutrients. 2021 Oct; 13(10): 3596; COVID-19 Mortality Risk Correlates Inversely with Vitamin D3 Status, and a Mortality Rate Close to Zero Could Theoretically Be Achieved at 50 ng/mL 25(OH)D3: Results of a Systematic Review and Meta-Analysis

[Autorzy sugerują, że suplementacja witaminą D zwiększy skuteczność szczepień, szczepień które nie zapobiegają infekcji, a podobno mają łagodzić objawy. Od kilku miesięcy ta skuteczność jest wzmacniana metodami administracyjnymi poprzez wprowadzanie braku konieczności testowania osób zaszczepionych, testowanie zaszczepionych ale stosując niższą liczbę cykli odcięcia lub nie odnototowywanie w rejestrach faktu zaszczepienia wśród osób przyjmowanych do placówek medycznych. Jeśli więc jeśli odpowiednio wyższy poziom witaminy D sprawia, że przechodzimy infekcję dróg oddechowych bezobjawowo, to jedyne co takie połączenie sprawi, to tylko wzmocni umysłowy beton (post hoc, ergo propter hoc), który jest przekonany co do twierdzenia, że szczepionki łagodzą objawy.]
Streszczenie
Wprowadzenie: Wiele badań wskazuje, że stężenie kalcydiolu (25(OH)D3) we krwi silnie koreluje z ciężkością przebiegu zakażenia SARS-CoV-2. Trwa otwarta dyskusja, czy niski poziom witaminy D3 jest spowodowany infekcją, czy też jego niedobór negatywnie wpływa na odporność organizmu [ciężkość objawów choroby]. Celem niniejszej pracy było zebranie dodatkowych dowodów na ten temat.
Metody: Systematycznie przeszukiwano literaturę w celu zidentyfikowania retrospektywnych badań kohortowych oraz badań klinicznych dotyczących śmiertelności w grupie osób chorych na COVID-19 w zależności od stężenia witaminy D3 we krwi. Wskaźniki śmiertelności z badań klinicznych zostały skorygowane o wiek, płeć i cukrzycę. Dane analizowano za pomocą wskaźników korelacji i regresji liniowej.
Wyniki: Zidentyfikowano jedno badanie populacyjne i siedem badań klinicznych, w których odnotowano stężenie witaminy D3 we krwi przed zakażeniem lub w dniu przyjęcia do szpitala. Dwa niezależne zbiory danych wykazały ujemną korelację Pearsona pomiędzy poziomem witaminy D3 a ryzykiem śmiertelności (r(17) = -0,4154, p = 0,0770/r(13) = -0,4886, p = 0,0646). W przypadku połączonych danych, mediana (IQR) poziomu witaminy D3 wynosiła 23,2 ng/mL (17,4-26,8), i zaobserwowano istotną korelację Pearsona (r(32) = -0,3989, p = 0,0194). Regresja sugerowała teoretyczny punkt zerowej śmiertelności na poziomie około 50 ng/mL witaminy D3.
Wnioski: Przedstawione zestawy danych dostarczają mocnych dowodów na to, że niski poziom witaminy D3 w organizmie jest raczej zapowiedzią a nie tylko efektem ubocznym [ciężko objawowej] infekcji. Pomimo trwających szczepień, zalecamy podniesienie poziomu kalcydiolu w surowicy do wartości powyżej 50 ng/mL, aby zapobiec lub złagodzić nowe ogniska choroby z powodu mutacji ucieczkowych [escape mutations] lub zmniejszającej się aktywności przeciwciał.
Paracetamol i niedobór glutationu a objawy i zgony na COVID-19
1. Wstęp
Pandemia SARS-CoV-2 powodująca zespół ostrej niewydolności oddechowej (ARDS) trwa od ponad 18 miesięcy. Stworzyła ona poważny globalny kryzys zdrowotny ze względu na dużą liczbę pacjentów wymagających intensywnej terapii, a wysoka śmiertelność znacząco wpłynęła na życie codzienne poprzez ograniczenia w kontaktach i kwarantanny. Według wielu naukowców i pracowników służby zdrowia, jesteśmy jeszcze daleko od końca tej katastrofy i dlatego musimy nauczyć się koegzystować z wirusem jeszcze przez kilka lat, a może nawet dekad [1,2].
SARS-CoV-2 w kontekście patentów sprzed 20 lat – dr David Martin
Można realistycznie założyć, że pojawią się nowe mutacje, które mogą być bardziej zakaźne lub bardziej śmiercionośne. W znanej nam historii infekcji wirusowych nigdy nie mieliśmy do czynienia z podobnym globalnym rozprzestrzenianiem się wirusa. Ze względu na dużą liczbę replikacji genomu wirusowego, które zachodzą u zakażonych osób oraz podatną na błędy naturę polimerazy RNA zależnej od RNA, postępujące mutacje przyrostowe występują i będą występować [3,4,5]. Dlatego, podobnie jak w przypadku innych zakażeń wirusowych, takich jak grypa, musimy się spodziewać, że skuteczność szczepień jest ograniczona czasowo, zwłaszcza przy obecnych szczepionkach zaprojektowanych w celu wywołania odpowiedzi immunologicznej przeciwko pojedynczemu białku wirusowemu [6,7,8].

„nie ustalono jakie stężenie przeciwciał i których przeciwciał koreluje z ochroną przed zachorowaniem na COVID-19,” – Źródło: Szczepienia.info – PZH, Czy należy wykonywać test serologiczny oceny poziomu przeciwciał przed lub po szczepieniu przeciw COVID-19?
Dowiedzieliśmy się już, że nawet osoby w pełni zaszczepione mogą ulec zakażeniu [9]. Obecnie większość z tych zakażeń nie prowadzi do hospitalizacji, zwłaszcza u osób młodych bez chorób współistniejących. Zakażenia te są jednak podstawą do ciągłego rozprzestrzeniania się wirusa w sytuacji, w której ogólnoświatowa odporność stadna przeciwko SARS-CoV-2 jest raczej mało prawdopodobna. Zamiast tego ludzkość może znaleźć się w pułapce niemożliwego do pokonania wyścigu między nowymi mutacjami a nowymi szczepionkami, z rosnącym ryzykiem, że nowo powstające mutacje staną się oporne na obecnie stosowane szczepionki [3,10,11]. Tak oto powrót do normalnego życia w najbliższej przyszłości wydaje się mało prawdopodobny. Wymogi dotyczące noszenia maseczki i ograniczenia życia publicznego będą nam zapewne towarzyszyć przez długi czas, jeśli nie uda się nam wypracować dodatkowych metod ograniczających rozprzestrzenianie się wirusów.
Wydychany aerozol i maski na twarz
2 metry czy 20 metrów, dystans nie ma większego znaczenia dla Covid-19 – prof. Martin Bazant i prof. John Bush z MIT
Szczepienia są ważnym elementem w walce z SARS-CoV-2, ale w odniesieniu do opisanej powyżej sytuacji nie powinny być jedynym celem. Jednym z mocnych filarów w ochronie przed każdym rodzajem infekcji wirusowej jest siła naszego układu odpornościowego [12]. Niestety, jak dotąd ta niekwestionowana podstawowa zasada natury była w mniejszym lub większym stopniu lekceważona przez odpowiedzialne władze. Powszechnie wiadomo, że nasz współczesny styl życia jest daleki od optymalnego pod względem odżywiania, sprawności fizycznej i rekreacji. W szczególności wiele osób nie spędza wystarczająco dużo czasu na słońcu, nawet w lecie. Konsekwencją tego jest powszechny niedobór witaminy D, który ogranicza sprawność ich układów odpornościowych, co skutkuje zwiększonym rozprzestrzenianiem się niektórych chorób cywilizacyjnych, którym można zapobiegać, zmniejszeniem ochrony przed infekcjami oraz obniżeniem skuteczności szczepień [13].
Witamina D i epidemia grypy – John J Cannell
Niedobór witaminy D
Stosowanie witaminy D w praktyce klinicznej
W niniejszej publikacji wykażemy, że niedobór witaminy D3, który jest dobrze udokumentowanym problemem ogólnoświatowym [13,14,15,16,17,18,19,20], jest jedną z głównych przyczyn ciężkiego przebiegu zakażeń SARS-CoV-2. Wskaźniki śmiertelności dobrze korelują z ustaleniami, że osoby starsze, czarnoskóre oraz osoby z chorobami współistniejącymi wykazują bardzo niski poziom witaminy D3 w organizmie [16,21,22,23]. Co więcej, z nielicznymi wyjątkami, mamy do czynienia z najwyższymi wskaźnikami infekcji w miesiącach zimowych i w krajach północnych, których mieszkańcy jak wiadomo, cierpią na niski poziom witaminy D3 w organiźmie ze względu na niską endogenną syntezę witaminy D3 wyzwalaną przez słońce [24,25,26,27].
Witamina D3 została odkryta na początku XIX wieku jako niezbędny czynnik gwarantujący zdrowie układu kostnego. Odkrycie to nastąpiło po długim okresie zmagania się z potwornymi skutkami krzywicy, która powoduje osteomalację (rozmiękanie kości). Choroba ta dotykała szczególnie dzieci w krajach północnych, które w okresie rewolucji przemysłowej pozbawione były światła słonecznego i często pracowały w ciemnych halach produkcyjnych [28]. Na początku XX wieku stało się jasne, że światło słoneczne może leczyć krzywicę poprzez wyzwalanie syntezy witaminy D3 w skórze. Olej z wątroby dorsza uznawany jest za naturalne źródło witaminy D3 [29]. W tamtych czasach poziom 20 ng/mL witaminy D3 we krwi był wystarczający, aby powstrzymać rozwój osteomalacji. Cel ten jest do dziś zalecanym poziomem tej witaminy we krwi, co jest stwierdzane w wielu oficjalnych dokumentach [30]. Zgodnie z wieloma innymi publikacjami wykażemy, że poziom ten jest zdecydowanie za niski, aby zagwarantować optymalne funkcjonowanie organizmu ludzkiego.
Pod koniec lat 20. ubiegłego wieku Adolf Windaus naświetlił strukturę witaminy D3. Ścieżka metaboliczna witaminy D3 (nazwa biochemiczna to cholekalcyferol) została przedstawiona na Rycinie 1[31]. Prekursor, 7-dehydrocholesterol, przekształcany jest w cholekalcyferol w naszej skórze w wyniku fotoizomeryzacji spowodowanej ekspozycją na promieniowanie UV-B (długość fali 280-315 nm). Po przetransportowaniu do wątroby, cholekalcyferol jest hydroksylowany, w wyniku czego powstaje 25-hydroksycholekalcyferol (25(OH)D3, zwany również kalcydiolem), który może być przechowywany w tkance tłuszczowej przez kilka miesięcy i w razie potrzeby jest uwalniany z powrotem do krwiobiegu. Biologicznie aktywna forma jest wytwarzana w kolejnym etapie hydroksylacji, w wyniku którego powstaje 1,25-dihydroksycholekalcyferol (1,25(OH)2D3, zwany również kalcytriolem). Wczesne badania zakładały, że przemiana ta zachodzi głównie w nerkach.
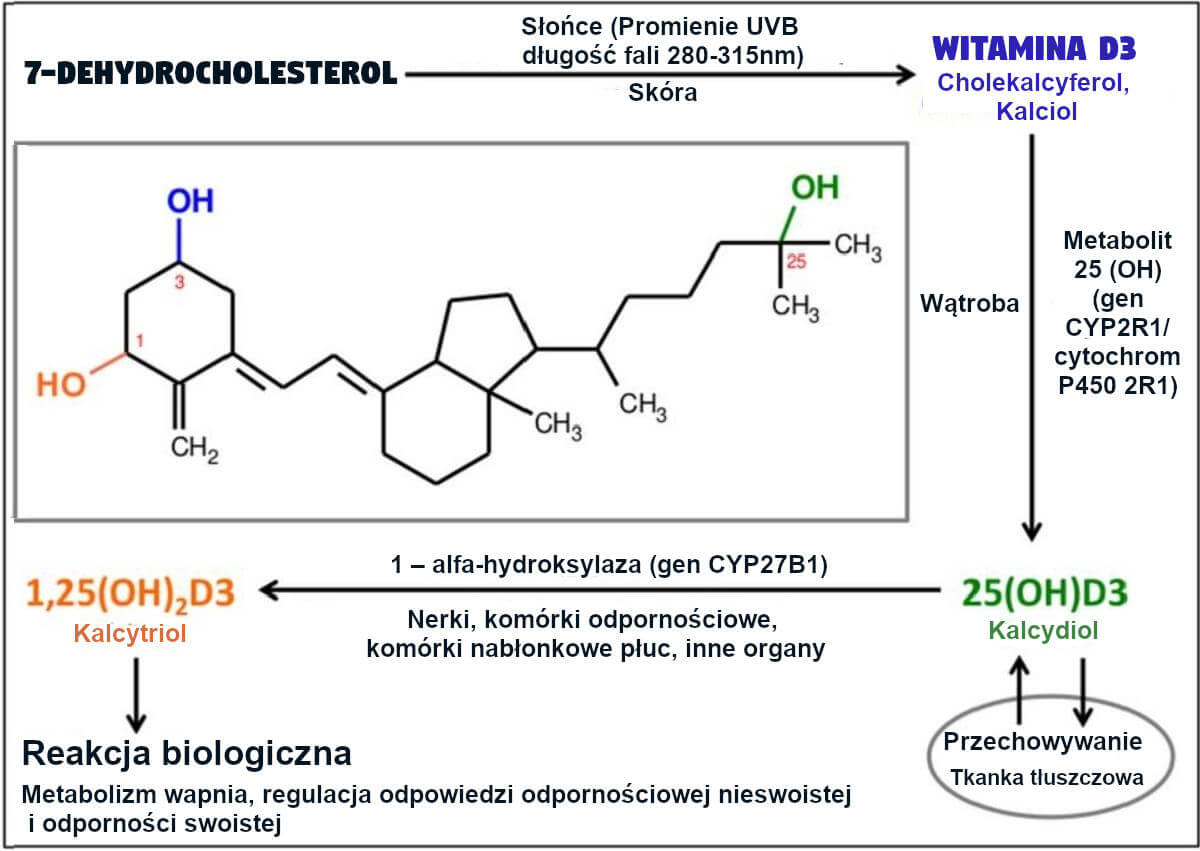
Rycina 1: Szlak metaboliczny witaminy D3: Wzór chemiczny kalcytriolu jest używany do zilustrowania biochemii witaminy D i jej metabolitów za pomocą różnych kolorów. Szlak witaminy D charakteryzuje się dwoma kolejnymi etapami hydroksylacji. W wątrobie, 25-hydroksylaza wytwarza 25(OH)D3 (kalcydiol), który może być magazynowany w tkance tłuszczowej. 1-alfa-hydroksylaza wytwarza aktywny hormon steroidowy 1,25(OH)2D3 (kalcytriol), który reguluje gospodarkę wapniową oraz odpowiedź immunologiczną nieswoistą i odporność swoistą.
W ciągu ostatnich dziesięcioleci wiedza na temat mechanizmów, poprzez które witamina D3 wpływa na zdrowie człowieka uległa znacznemu poszerzeniu. Odkryto, że receptor witaminy D3 (VDR) i enzym aktywujący witaminę D3 – 1-α-hydroksylaza (CYP27B1) ulegają ekspresji w wielu typach komórek, które nie są zaangażowane w metabolizm kostny i mineralny, takich jak jelito, trzustka i prostata oraz komórki układu odpornościowego [32,33,34,35,36]. Odkrycie to świadczy o ważnym, znacznie szerszym niż dotychczas rozumiano, wpływie witaminy D3 na zdrowie człowieka [37,38]. Witamina D okazała się być potężnym regulatorem epigenetycznym, wpływającym na ponad 2500 genów [39] i oddziałującym na dziesiątki najpoważniejszych problemów zdrowotnych [40], w tym nowotwory [41,42], cukrzycę [43], ostre infekcje dróg oddechowych [44] przewlekłe choroby zapalne [45] i choroby autoimmunologiczne, takie jak stwardnienie rozsiane [46].
Co to jest epigenetyka – dr Nessa Carey – Dlaczego Twoje DNA nie jest Twoim przeznaczeniem
Odporność niemowląt – część 1 – Ciąża [Epigenetyka i mikrobiom]
W dziedzinie immunologii człowieka wykazano, że pozanerkowa synteza aktywnego metabolitu kalcytriolu-1,25(OH)2D3 przez komórki odpornościowe i komórki nabłonka płuc ma właściwości immunomodulujące [47,48,49,50,51,52]. Obecnie liczne dowody eksperymentalne wskazują, że aktywowana witamina D3 odgrywa zasadniczą rolę w regulacji odpowiedzi odpornościowej nieswoistej i odporności swoistej [53,54,55,56]. Wewnątrzkomórkowe receptory witaminy D3 (VDR) są obecne w prawie wszystkich typach komórek biorących udział w odpowiedzi immunologicznej u człowieka, takich jak monocyty/makrofagi, limfocyty T, limfocyty B, komórki NK (natural killer) i komórki dendrytyczne (DCs). Wiązanie receptora prowadzi do powstania „elementu odpowiedzi na witaminę D3″ (VDRE), regulującego dużą liczbę genów docelowych zaangażowanych w odpowiedź immunologiczną [57]. W konsekwencji tej wiedzy środowisko naukowe zgadza się obecnie, że kalcytriol jest czymś więcej niż tylko witaminą, jest raczej wysoce skutecznym hormonem o takim samym znaczeniu dla metabolizmu człowieka jak inne hormony steroidowe.
Poziom we krwi zapewniający niezawodną skuteczność witaminy D3 w odniesieniu do wszystkich jej ważnych funkcji ponownie stał się przedmiotem dyskusji i okazało się, że preferowany jest poziom 40-60 ng/mL [38], który znacznie przekracza poziom wymagany do zapobiegania krzywicy.
Na długo przed pandemią SARS-CoV-2, coraz więcej publikacji naukowych wskazywało na skuteczność wystarczającego poziomu witaminy D3 we krwi w leczeniu wielu chorób człowieka spowodowanych słabym lub rozregulowanym układem odpornościowym [38,58,59,60]. Obejmuje to wszystkie rodzaje infekcji wirusowych [44,61,62,63,64,65,66,67,68,69,70], z głównym naciskiem na infekcje płuc, które powodują Zespół Ostrej Niewydolności Oddechowej [ARDS][71,72,73], jak również choroby autoimmunologiczne [46,63,74,75]. Jednak rutynowe oznaczanie stężenia witaminy D3 i jej suplementacja do dziś nie są wprowadzone w życie. Niestety, wydaje się, że nowe odkrycia dotyczące witaminy D3 nie zostały dobrze przyjęte w środowisku medycznym. Wiele oficjalnych zaleceń dotyczących definiowania niedoboru witaminy D3 nadal trzyma się wartości 20 ng/mL ustalonej 100 lat temu w celu leczenia krzywicy [76].
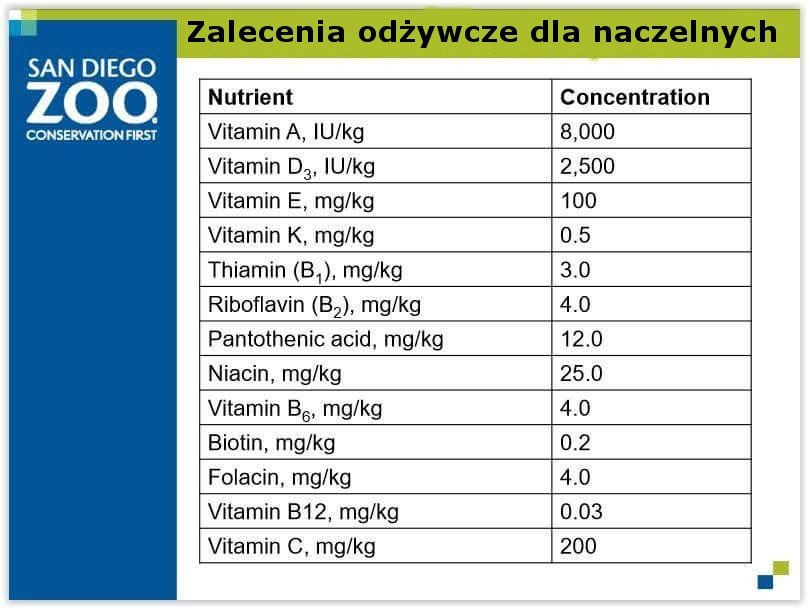
Niestety, ale nie znalazłem linka do źródła tego zrzutu który zrobiłem kilka lat temu. Podaje inny w którym są podobne wartości. https://orangutannutrition.weebly.com/nutritional-requirements.html oraz Nutrient Requirements of Nonhuman Primates: Second Revised Edition – strona 193, tabelka 11-2
Ponadto, wiele zaleceń dotyczących suplementacji witaminy D3 zawiera się w przedziale od 5 do 20 µg dziennie (200 do 800 jednostek międzynarodowych), co jest zdecydowanie zbyt niską wartością, aby zagwarantować optymalny poziom we krwi 40-60 ng/mL [38,77]. Jedną z przyczyn tych błędnych zaleceń okazał się błąd w obliczeniach [78,79]. Innym powodem błędu jest fakt, że terapia z wykorzystaniem witaminy D3 w celu leczenia osteomalacji była powszechnie łączona z dużymi dawkami wapnia w celu wspomagania uwapnienia kości. Kiedy badano skutki uboczne przedawkowania takich preparatów łączonych, okazało się, że istnieje duże ryzyko odkładania się wapnia w naczyniach krwionośnych, zwłaszcza w nerkach. Dziś wiadomo, że takie preparaty łączone są bezsensowne, ponieważ witamina D3 sama stymuluje wchłanianie wapnia w jelitach. Bez suplementacji wapnia, nawet bardzo wysoka suplementacja witaminą D3 nie powoduje zwapnienia naczyń krwionośnych, zwłaszcza jeśli uwzględni się jeszcze jeden ważny wniosek. Nawet gdy poziom wapnia we krwi jest wysoki, winowajcą niepożądanego zwapnienia naczyń krwionośnych nie jest witamina D, ale niewystarczający poziom witaminy K2 we krwi. Dlatego też wykazano, że codzienna suplementacja witaminy D3 w zakresie od 4000 do 10.000 jednostek (100 do 250 µg) potrzebnych do wytworzenia optymalnego stężenia witaminy D3 we krwi w zakresie 40-60 ng/mL jest całkowicie bezpieczna w połączeniu z około 200 µg/mL witaminy K2[80,81,82]. Jednakże wiedza ta nadal nie jest rozpowszechniona w środowisku medycznym, a przestarzałe ostrzeżenia o ryzyku przedawkowania witaminy D3 niestety nadal powszechnie krążą.
W oparciu o te okoliczności pandemia SARS-CoV-2 staje się drugim w historii przełomowym przypadkiem powiązania witaminy D3 z chorobą (po krzywicy), a my musimy zapewnić pełne wykorzystanie jej właściwości medycznych w celu utrzymania ludzi w dobrej kondycji zdrowotnej. Najbardziej zagrażającymi życiu zdarzeniami w przebiegu zakażenia SARS-CoV-2 są Zespół Ostrej Niewydolności Oddechowej [ARDS] i zespół wyrzutu cytokin (CRS). Powszechnie uznaje się, że witamina D3 jest w stanie hamować szlaki metaboliczne leżące u ich podłoża[83,84], ponieważ istnieje bardzo specyficzna interakcja pomiędzy mechanizmem zakażenia SARS-CoV-2 a witaminą D3.
Enzym konwertazy angiotensyny 2 (ACE2), część układu renina-angiotensyna (RAS), służy jako główny punkt wejścia dla SARS-CoV-2 do komórek (Rysunek 2). Kiedy SARS-CoV-2 zostaje przyłączony do ACE2, jego ekspresja jest zmniejszona, co powoduje uszkodzenie płuc i zapalenie płuc [85,86,87]. Witamina D3 jest negatywnym modulatorem RAS poprzez hamowanie ekspresji reniny i pobudzanie ekspresji ACE2. Pełni więc rolę ochronną przed Zespołem Ostrej Niewydolności Oddechowej ARDS wywołanym przez SARS-CoV-2. Wystarczające stężenie witaminy D3 zapobiega rozwojowi Zespołowi Ostrej Niewydolności Oddechowej [ARDS] poprzez zmniejszenie stężenia angiotensyny II i zwiększenie stężenia angiotensyny (1,7) [18,88,89,90,91,92].
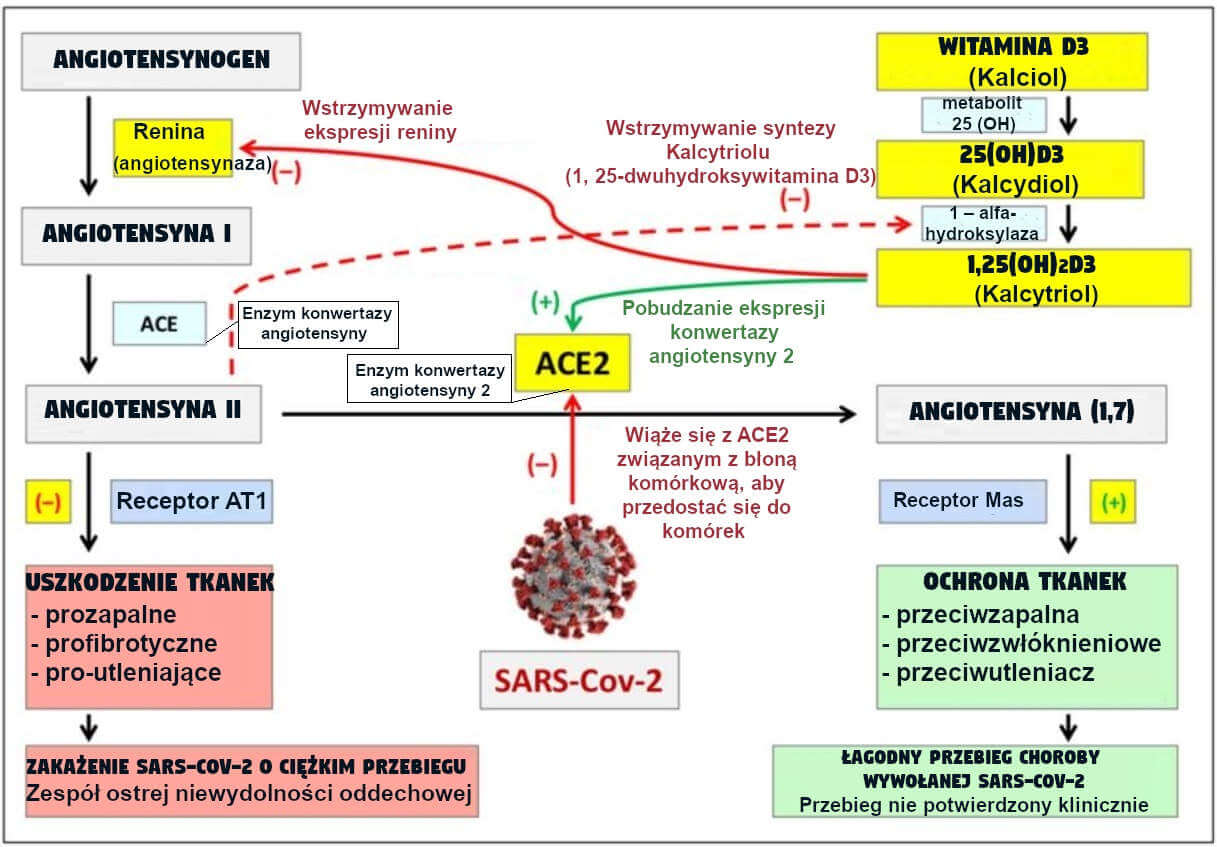
Rycina 2: Interakcja witaminy D3 z układem renina-angiotensyna (RAS): układ renina-angiotensyna (RAS) jest ważnym regulatorem objętości krwi i oporu systemowego naczyniowego w celu regulacji ciśnienia krwi. Równowaga pomiędzy angiotensyną II i angiotensyną (1-7) jest czynnikiem krytycznym dla prawidłowego funkcjonowania układu [87]. Enzym konwertazy angiotensyny 2 (ACE2) jest odpowiedzialny za przekształcenie angiotensyny II do angiotensyny (1-7). Angiotensyna II prowokuje przede wszystkim zwężenie naczyń, ale może również powodować zapalenie, zwłóknienie i stres oksydacyjny w przypadku braku jej odpowiednika, angiotensyny (1-7). ACE2 jest głównym receptorem dla SARS-CoV-2, który obniża jego aktywność, co prowadzi do wzrostu poziomu angiotensyny II i spadku poziomu angiotensyny (1-7). Efekt ten ostatecznie wyzwala wywołany przez SARS-CoV-2 „zespół ostrej niewydolności oddechowej” (ARDS) [85,86]. Kalcytriol, aktywny metabolit witaminy D3, minimalizuje ten efekt poprzez hamowanie ekspresji reniny i tym samym syntezy angiotensyny II oraz poprzez stymulację ekspresji ACE2 [88,89], zwiększając konwersję angiotensyny II do angiotensyny (1-7). Dlatego niewystarczające stężenie witaminy D we krwi prowadzi do rozwoju ciężkiego przebiegu choroby SARS-CoV-2. Ponadto wykazano, że wysoki poziom angiotensyny II prowadzi do regulacji ze sprzężeniem zwrotnym ujemnym enzymu 1-alfa-hydroksylazy [93], który jest niezbędny do tworzenia kalcytriolu, co nasila negatywne konsekwencje niedoboru witaminy D.
Istnieje kilka dodatkowych ważnych funkcji witaminy D3 wspomagających odporność organizmu [18,77,94,95]:
1. Witamina D zmniejsza produkcję limfocytów Th1. Dzięki temu może hamować rozwój stanu zapalnego poprzez zmniejszenie wytwarzania cytokin zapalnych [74,96,97].
2. Witamina D3 zmniejsza nasilenie zespołu wyrzutu cytokin (CRS). Ta „burza cytokinowa” powoduje uszkodzenia wielonarządowe i dlatego jest główną przyczyną zgonów w późnej fazie zakażenia SARS-CoV-2. Ogólnoustrojowa reakcja zapalna spowodowana infekcją wirusową jest łagodzona poprzez promowanie różnicowania limfocytów T [98,99,100,101].
3. Witamina D3 indukuje produkcję endogennego peptydu antydrobnoustrojowego katelicydyny (LL-37) w makrofagach i komórkach nabłonkowych płuc, który działa przeciwko inwazyjnym wirusom oddechowym poprzez rozbijanie otoczek wirusowych i zmianę żywotności komórek docelowych gospodarza [52,102,103,104,105,106,107].
4. Badania eksperymentalne wykazały, że witamina D i jej metabolity modulują funkcję śródbłonka i przepuszczalność naczyń poprzez wiele szlaków genomowych i pozagenomowych [108,109].
5. Witamina D zmniejsza zaburzenia krzepnięcia u pacjentów w stanie krytycznym chorych na COVID-19 [110,111,112].
Burza cytokin i koronawirus SARS-CoV-2 – Douglas Perry
Szybko rosnąca liczba publikacji badająca status witaminy D3 u pacjentów z SARS-CoV-2 i potwierdza zarówno niski poziom witaminy D w przypadkach ciężkiego przebiegu zakażenia [113,114,115,116,117,118,119,120,121,122,123,124,125,126,127] jak i pozytywne wyniki leczenia witaminą D3 [128,129,130,131,132,133,134]. Dlatego też wielu naukowców zaleca podawanie witaminy D3 jako niezbędnego elementu planu postępowania medycznego w celu uniknięcia ciężkiego przebiegu zakażenia SARS-CoV-2 [14,18,77,84,135,136], co dodatkowo zaowocowało propozycjami konsekwentnej suplementacji całej populacji [137]. Wyczerpujący przegląd i omówienie aktualnego piśmiennictwa zawiera recenzję autorstwa Lindy Benskin [138]. Niestety, wszystkie te badania opierają się na stosunkowo niewielkiej liczbie pacjentów. Nadal brakuje dobrze przyjętych, badań podwójnie zaślepionych z grupą kontrolną placebo.
Odkrycie, że większość pacjentów hospitalizowanych z powodu SARS-CoV-2 ma zbyt niskie stężenie witaminy D3 we krwi jest niekwestionowane nawet przez przeciwników suplementacji witaminy D. Trwa jednak dyskusja, czy mamy do czynienia ze związkiem przyczynowym, czy tylko ze spadkiem poziomu witaminy D spowodowanym samą infekcją[84,139,140,141].
Istnieją wiarygodne dane na temat średniego poziomu witaminy D3 w populacji [15,19,142] w kilku krajach, równolegle z danymi na temat śmiertelności spowodowanej SARS-CoV-2 w tych krajach [143,144]. Oczywiście, na te dane dotyczące poziomu witaminy D3 w organizmie nie mają wpływu zakażenia SARS-CoV-2. Chociaż dostępne są już metaanalizy wykorzystujące takie dane [26,136,140,145], naszym celem było przeanalizowanie tych danych w taki sam sposób, jak wybranych danych klinicznych. W tym artykule zidentyfikowaliśmy próg witaminy D, który praktycznie eliminuje nadmierną śmiertelność spowodowaną przez SARS-CoV-2. W przeciwieństwie do opublikowanych korelacji D3/SARS-CoV-2 [146,147,148,149,150,151,152], nasze dane obejmują badania oceniające wartości witaminy D przed zakażeniem, jak również badania z wartościami witaminy D mierzonymi po zakażeniu, najpóźniej dzień po hospitalizacji. Można więc oczekiwać, że mierzony status witaminy D jest nadal zbliżony do poziomu sprzed zakażenia. W przeciwieństwie do innych meta-badań, które obejmowały również duże retrospektywne badania kohortowe [151,152], naszym celem było przeprowadzenie regresji na połączonych danych po skorygowaniu o charakterystykę pacjentów.
Te wyniki z niezależnych zbiorów danych, które obejmują dane z okresu przed i po wystąpieniu choroby, również dodatkowo wzmacniają założenie o związku przyczynowym między poziomem witaminy D3 we krwi a wskaźnikami zgonów z powodu SARS-CoV-2. Nasze wyniki potwierdzają zatem również znaczenie ustanowienia suplementacji witaminy D3 jako ogólnej metody zapobiegania ciężkim przebiegom zakażeń SARS-CoV-2.
2. Metody
2.1. Strategia wyszukiwania i kryteria doboru
Początkowo dokonano systematycznego przeglądu literatury w celu zidentyfikowania odpowiednich badań nad COVID-19. Włączone badania były obserwacyjnymi badaniami kohortowymi, które grupowały dwie lub więcej kohort według wartości witaminy D3 i wymieniały wskaźniki śmiertelności dla odpowiednich kohort. PubMed i rejestr https://c19vitamind.com (dostęp 27 marca 2021 r.) przeszukano zgodnie z Tabelą 1. Następnie przeanalizowano tytuły i streszczenia, a pełne teksty artykułów poddano dalszej analizie pod kątem kwalifikowalności.
Tabela 1
Strategia wyszukiwania.
| Źródło | Strategia wyszukiwania | Ramy czasowe |
| PubMed | COVID-19 Fraza do wyszukania z [153] i („witamina d” lub „d3” lub „25(OH)D” lub „kalcyfediol” | 1 listopada 2019r. – 27 marca 2021r. |
| https://c19vitamind.com (dostęp 27 marca 2021 r.) | Ograniczenie do kategorii „Poziomy” | 1 listopada 2019 r. – 27 marca 2021r. |
2.2. Analiza danych
Zebrane badania zostały podzielone na badanie populacyjne [142] i siedem badań szpitalnych. Wyraźnie widać, że te źródła danych zasadniczo się różnią, ponieważ jedno z nich ocenia wartości witaminy D długoterminowo, podczas gdy drugie mierzy wartości witaminy D po infekcji, maskując w ten sposób możliwy związek przyczynowy między poziomem witaminy D przed infekcją a śmiertelnością.
Próbowano wprowadzić kilka poprawek dla surowych wskaźników śmiertelności (crude mortality rates – CMR) zarejestrowanych przez Ahmada, były próbą zrozumienia przyczyn leżących u podstaw danych z badań populacyjnych i wartości odstających. Koniec końców żadna z nich nie została zastosowana w ostatecznej ocenie danych, aby uniknąć ryzyka wprowadzenia ukrytych zmiennych, które również korelują z witaminą D3.
Wskaźniki śmiertelności i poziomy witaminy D3 we krwi z badań nad hospitalizowanymi pacjentami zakażonymi COVID-19 zostały zebrane w oddzielnym zbiorze danych. Jeśli nie podano mediany stężenia witaminy D3 we krwi dla poszczególnych kohort badawczych, zastosowano w tej kolejności IQR, średnią ± SD lub wartości szacunkowe w ramach kryteriów grupowania. Charakterystykę pacjentów, w tym IQR wieku, płeć i stan cukrzycy, wykorzystano do obliczenia oczekiwanych wskaźników śmiertelności za pomocą modelu uczenia maszynowego [154], który jest dostępny w Internecie (https://www.economist.com/graphic-detail/covid-pandemic-mortality-risk-estimator (dostęp 27 marca 2021r.)). Podczas gdy inne choroby współistniejące z badań źródłowych nie zostały uwzględnione w naszej analizie, mają one również mniejszy wpływ na wynik modelu, co można łatwo potwierdzić za pomocą narzędzia internetowego. W oparciu o oczekiwany wskaźnik śmiertelności z powodu choroby dla poszczególnych kohort pacjentów, skorygowano wskaźniki śmiertelności podane w badaniach źródłowych. W ten sposób związek pomiędzy początkowymi poziomami witaminy D i wynikającą z nich śmiertelnością stał się bardziej widoczny.
Oba zbiory danych zostały połączone, a wskaźniki śmiertelności z badań szpitalnych zostały przeskalowane zgodnie z zakresem śmiertelności z badań populacyjnych, w wyniku czego powstała jednolita lista kohort pacjentów, ich status witaminy D i bezwymiarowe współczynniki śmiertelności. Regresje liniowe (OLS), korelacje Pearsona i Spearmana dla witaminy D oraz wartości śmiertelności dla oddzielnych i połączonych zbiorów danych zostały wygenerowane za pomocą jądra Pythona 3.7 z wykorzystaniem bibliotek scipy.stats 1.7.0 i bibliotek służących do estymacji różnych modeli statystycznych 0.12.2 w notatniku Jupyter na https://deepnote.com (dostęp 30 lipca 2021).
3. Wyniki
Przeszukiwanie baz danych i rejestrów przyniosło odpowiednio 563 i 66 rekordów. W wyniku niesystematycznego przeszukiwania sieci uzyskano 13 badań, z których oceniono dodatkowo 31 pozycji. Po usunięciu 104 duplikatów i wstępnej selekcji, pozostały 44 badania. Wykluczono cztery metaanalizy, jeden komentarz, jedno wycofane badanie, jeden raport z niedostępnymi danymi, jeden raport dotyczący niewłaściwego tematu i jeden zapis w języku rosyjskim. Pozostałe 35 badań oceniono w pełnym tekście, z których 20 nie spełniało kryteriów kwalifikacji ze względu na projekt badania lub brak ilościowych danych dotyczących śmiertelności. Cztery kolejne badania zostały wykluczone z powodu braku danych dla poszczególnych kohort pacjentów. Wreszcie, trzy badania zostały wykluczone z powodu wypaczonej lub niereprezentatywnej charakterystyki pacjentów, co zostało zweryfikowane przez LB i JVM [114,155,156]. Pozostało osiem badań kwalifikujących się do analizy ilościowej, które wymieniono w Tabeli 2. Na Rycinie 3 przedstawiono schemat blokowy PRISMA [157].
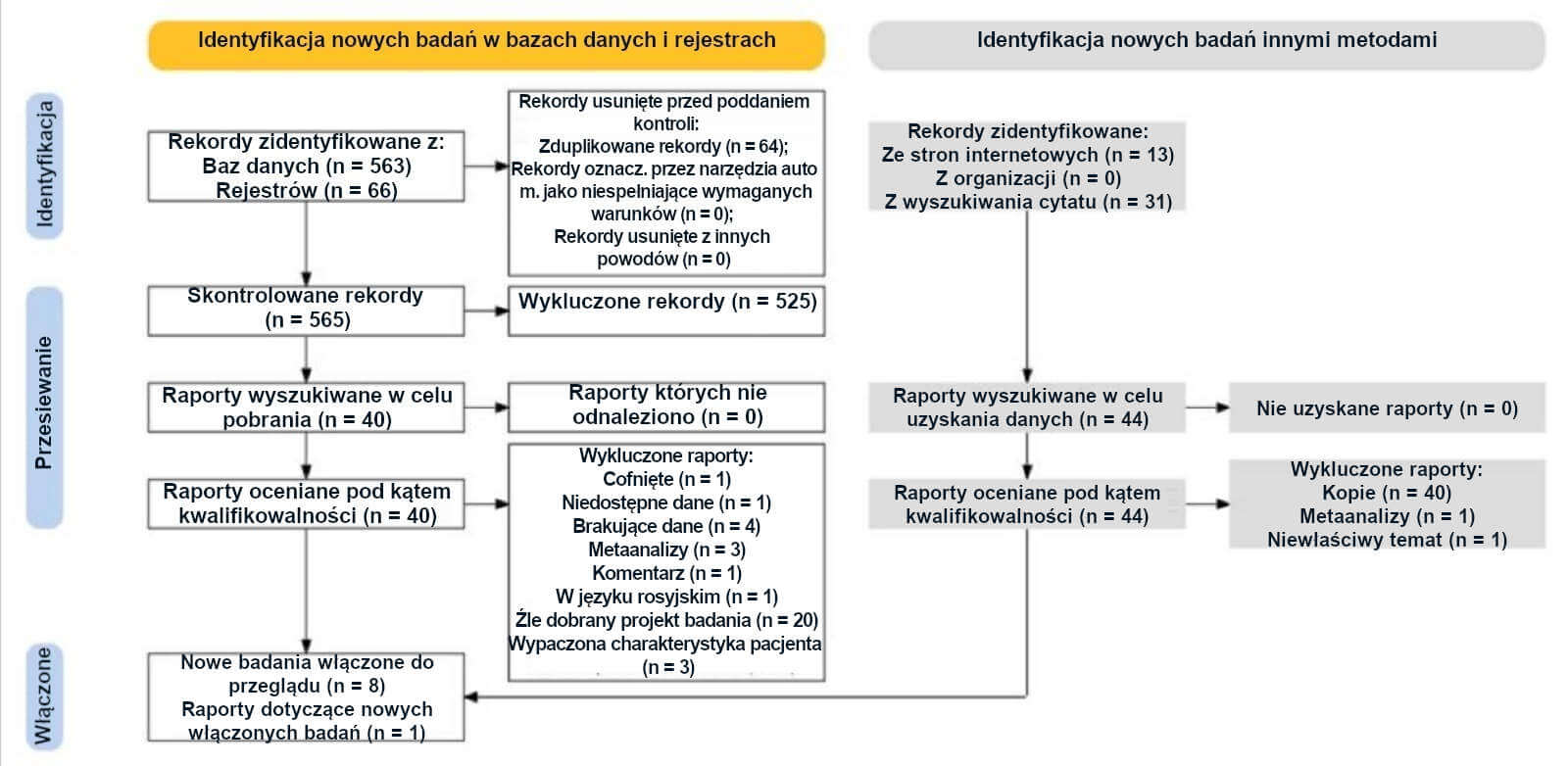
Rycina 3: Schemat blokowy strategii wyszukiwania i procesu doboru [158].
| Autor | Źródło | Kohorta | Liczba pacjentów | Wyniki laboratoryjne odnotowane przed/po zakażeniu | Liczba zgonów | Poziom witaminy D [ng/mL] |
| Ahmad i in., 2021r. | [142] | 19 krajów europejskich
|
448,785,546 | Z wyprzedzeniem do 10 miesięcy | Odnosi się do badania źródłowego | |
| Angelidi i in., 2021r. | [159] | <30ng/mL
|
79 | W ciągu 1 dnia od przyjęcia do szpitala | 25,30% | Mediana(IQR):28ng/mL
16,80-39,00 ng/mL |
| ≤30ng/mL | 65 | 9,20% | ||||
| <20ng/mL | 96 | 14,58% | ||||
| Charoenngam i in., 2021r. | [160] | 20-30ng/mL | 91 | Z wyprzedzeniem do roku | 16,48% | |
| ≥30ng/mL | 100 | 12,00% | ||||
| Gavioli i in., 2021r. | [126] | Niewystarczający | 177 | Z wyprzedzeniem do 3 miesięcy | 29,00% | 14,00 |
| Wystarczający | 260 | 31,00% | 31,00 | |||
| Susianti i in., 2021r. | [161] | <49,92nmol/L | 42 | W ciągu 1 dnia po przyjęciu do szpitala | 45,00% | 8,00 |
| ≥49,92nmol/L | 8 | 42,00% | 28,40 | |||
| Szeto i in., 2021r. | [127] | <20ng/mL | 35 | Z wyprzedzeniem do 12 miesięcy | 23,00% | 16,00 |
| ≥20ng/mL | 58 | 24,00% | 32,00 | |||
| Vanegas-Cedillo i in., 2021r. | [115] | ≤20ng/mL | 251 | W ciągu 1 dnia po przyjęciu do szpitala | 23,50% | |
| >20ng/mL | 300 | 19,00% | Średni ± SD 21,78 ± 9,01ng/mL | |||
| Vasilliou 2020r. | [120] | ≤19,9ng/mL | 32 | W ciągu 1 dnia po przyjęciu do szpitala | 25,00% | |
| 20-29,9ng/mL | 7 | 14,30% |
a Nie odnotowano
Obserwowana mediana (IQR) wartości witaminy D we wszystkich zebranych kohortach badawczych wynosiła 23,2 ng/mL (17,4-26,8). Rozkład częstości występowania poziomów witaminy D przedstawiono na Rycinie 4.
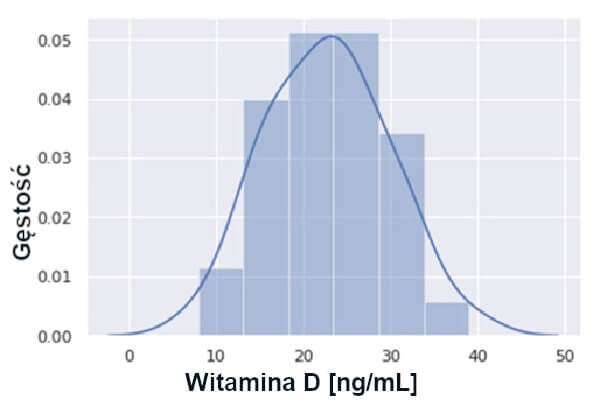
Rycina 4: Rozkład częstości występowania poziomu witaminy D we wszystkich ocenianych kohortach badawczych.
Zidentyfikowano jedno badanie populacyjne przeprowadzone przez Ahmada i in. [142]. W niniejszym badaniu zestawiono surowe współczynniki umieralności [CMR] dla 19 krajów europejskich na podstawie danych dotyczących pandemii COVID-19 z Johns Hopkins University[143] w przedziale czasowym od 21 marca 2020 r. do 22 stycznia 2021 r., a także stężenia witaminy D3 we krwi dla poszczególnych krajów zebrane na podstawie przeglądu literatury. Ponadto, zebrano odsetki populacji w wieku 70+. Mediana poziomu witaminy D3 we wszystkich krajach wyniosła 23,2 ng/mL (19,9-25,5 ng/mL). Zaobserwowano umiarkowanie ujemną korelację Spearmana z odpowiadającym jej średnim poziomem witaminy D3 w poszczególnych populacjach na poziomie rs = -0,430 (95% CI: -0,805–0,081). Ahmad nie dokonał żadnych dalszych korekt tych wartości surowych współczynników umieralności [CMR]. Korelacje przedstawione w Tabeli 3 sugerują, że rozkład według płci/wieku, cukrzyca i surowość środków zdrowia publicznego są niektórymi z przyczyn wartości odstających w zbiorze danych Ahmada. Nie ma to jednak większego wpływu na dalsze wyniki omówione poniżej.
Tabela 3
Próba skorygowania wartości CMR w badaniu populacji przeprowadzonym przez Ahmeda
| Metoda | Źródło | Wynikowy współczynnik korelacji Pearsona CMR~D3 |
| Żadna | – |
r(17) = -0.4154, p = 0.0770 |
|
Usunięto najbardziej skrajne wartości odstające
|
– |
r(15) = -0.3471, p = 0.1722 |
| Surowość środków zdrowia publicznego | [144] |
r(17) = -0.4662, p = 0.0442 |
|
Rozkład według płci/wieku, cukrzyca
|
[162,163] |
r(17) = -0.5113, p = 0.0253 |
| Oczekiwany pozytywny wskaźnik SARS-COV-2 dla
danego poziomu witaminy D3
|
[122] | r(17) = -0.5997, p = 0.0066 |
Wyodrębnione dane z siedmiu badań szpitalnych wykazały medianę poziomu witaminy D3 wynoszącą 23,2 ng/mL (14,5-30,9 ng/mL). Dane te zostały wykreślone po skorygowaniu charakterystyki pacjentów i skalowaniu w połączeniu z punktami danych z badania Ahmada na Rysunku 5.
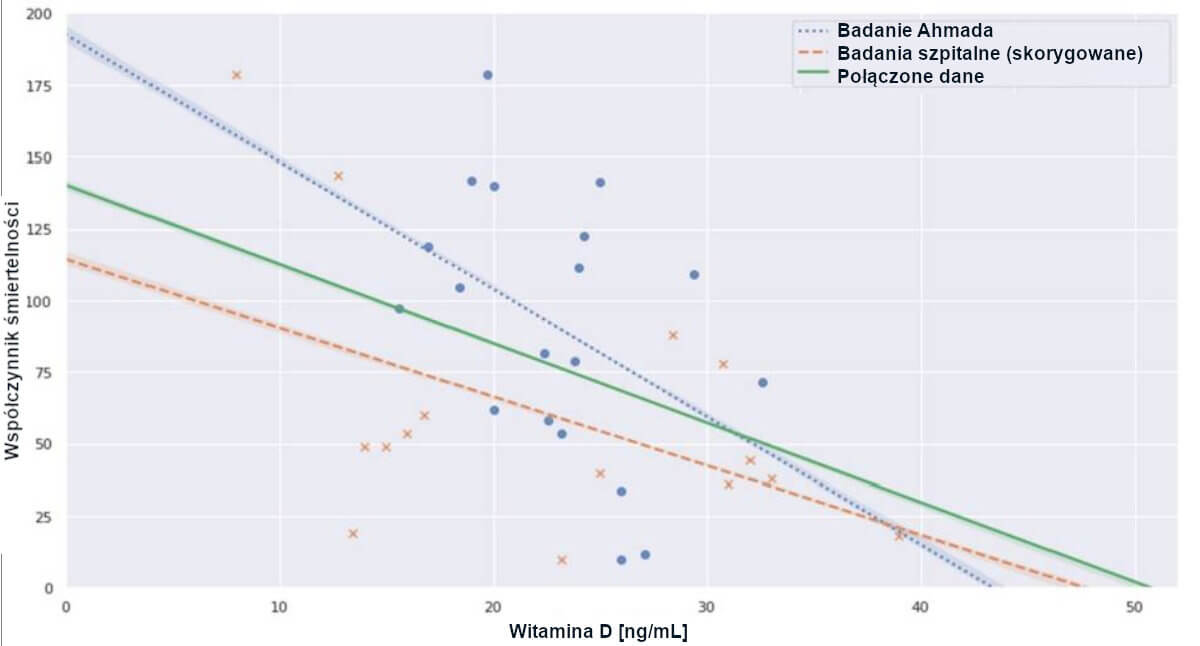
Rycina 5: Wykres punktowy i regresji OLS dla indywidualnych i połączonych zbiorów danych.
Wyniki korelacji przedstawiono w Tabeli 4, w której połączone dane wykazują istotną ujemną korelację Pearsona na poziomie r(32) = -0,3989, p = 0,0194. Wyniki regresji liniowej znajdują się w Tabeli 5. Regresja dla połączonych danych przecina oś witaminy D3 na poziomie 50,7 ng/mL, co sugeruje teoretyczny punkt zerowej śmiertelności.
Tabela 4
Korelacja współczynnika śmiertelności i poziomu witaminy D we krwi dla poszczególnych zbiorów danych
| Badanie Ahmada | Badania szpitalne (skorygowane) | Połączone zbiory danych | |
| Współczynniki korelacji Pearsona
(Śmiertelność~Witamina D) |
r(17) = -0.4154, p = 0.0770 | r(13) = -0.4886, p = 0.0646 | r(32) = -0.3989, p = 0.0194 |
| Współczynniki korelacji Spearmana
(Śmiertelność~Witamina D) |
= -0.4300, p = 0.0661, N = 19 | = -0.469, p = 0.0786, N = 15 | = -0.3698, p = 0.03136, N = 34 |
Tabela 5
Regresje liniowe [OLS] dla poszczególnych zestawów danych
| Badanie Ahmada | Badania szpitalne (skorygowane) | Połączone zbiory danych | |
| Punkt przecięcia prostej z osią współrzędnych | 192.6788 | 114.4156 | 140.2880 |
| Współczynnik | -4.4408 | -2.4015 | -2.7654 |
| R2 | 0.173 | 0.239 | 0.159 |
| Skorygowane R2 | 0.124 | 0.180 | 0.133 |
| Prob (F-Statistic) | 0.0770 | 0.0646 | 0.0194 |
| AIC | 1980.7 | 1560.5 | 3560.8 |
| BIC | 2000.6 | 1580.0 | 2590.8 |
| Prob (Omnibus) | 0.342 | 0.568 | 0.436 |
| Durbin-Watson | 10.238 | 10.514 | 10.217 |
| Prob (Jarque-Bera) | 0.591 | 0.662 | 0.572 |
4. Dyskusja
To badanie ilustruje, że w czasie, gdy szczepienia nie były jeszcze dostępne, to zgon w przypadku pacjentów z wystarczająco wysokim poziomem witaminy D3 w surowicy poprzedzającym zakażenie był wysoce nieprawdopodobny. Częściowe ryzyko przy tym poziomie witaminy D3 wydaje się znikać w ramach standardowego statystycznego ryzyka śmiertelności dla danego wieku i w świetle danych chorób współistniejących. Ta korelacja powinna być dobrą wiadomością, gdy szczepienia nie były dostępne, ale zamiast tego została powszechnie zignorowana. Mimo to wynik ten może dawać nadzieję na zwalczanie przyszłych wariantów szybko zmieniającego się wirusa, jak również przerażających przełomowych zakażeń u zaszczepionych osób, w których ciężki przebieg obserwuje się u 10,5% zaszczepionych w porównaniu z 26,5% nieszczepionych [164] ,przy czym przełomowe zakażenia u zaszczepionych są śmiertelne nawet w 2% przypadków [165].
Dane EU wskazują na korelację pomiędzy szczepieniem przeciwko grypie, niedoborem witaminy D i śmiertelnością z powodu COVID-19 [maj 2020]
Szczepienie przeciw grypie i koronawirus SARS-CoV-2
Konflikt interesów. WHO i „konspiracje” związane z grypą pandemiczną – Deborah Cohen i Philip Carter
Pandemia, której nie było – dr Henry I. Miller
Czy wirus, który tak łatwo się rozprzestrzenia i jest znacznie bardziej śmiercionośny niż grypa H1N1, mógłby być utrzymywany pod kontrolą, gdyby ludzki układ odpornościowy mógł pracować na pełnych obrotach? Zerowa śmiertelność, wyrażenie użyte powyżej, jest oczywiście niemożliwością, ponieważ zawsze istnieje pewien nieodłączny wskaźnik śmiertelności dla każdej grupy wiekowej. Statystyczne różnice w genetyce, jak również w stylu życia często uniemożliwiają nam zidentyfikowanie dokładnej medycznej przyczyny śmierci, zwłaszcza gdy czynniki ryzyka (tj. choroby współistniejące) i ostra infekcja konkurują ze sobą. Czynniki ryzyka mają również tendencję do wzajemnego wzmacniania się. W przypadku COVID-19 powszechnie wiadomo, że cukrzyca typu II, otyłość i wysokie ciśnienie krwi łatwo podwajają ryzyko zgonu [166], w zależności od wieku. Dyskusja na temat tego, czy pacjent zmarł „z powodu” lub „w czasie zakażenia” COVID-19, czy „z powodu” lub tylko „mając” choroby współistniejące, wydaje się więc nieaktualna. Infekcja SARS-CoV-2 statystycznie tylko zwiększa ogólne ryzyko śmiertelności, ale oczywiście w znacznie większym stopniu niż większość innych chorób zakaźnych lub ogólnych czynników ryzyka.
COVID – dlaczego terminologia ma znaczenie? – dr Malcolm Kendrick
W rozdziale dotyczącym kontekstu wykazano, że układ witaminy D odgrywa kluczową rolę nie tylko w zakresie zdrowia i wytrzymałości układu kostnego (krzywica/osteoporoza), ale także w zakresie rezultatu wielu chorób zakaźnych i/lub autoimmunologicznych [167,168]. Wcześniej istniejący niedobór witaminy D3 jest wysoce skorelowany we wszystkich tych wcześniej wymienionych przypadkach.
Wielu twierdzi, że ponieważ korelacja nie sugeruje przyczynowości, niski poziom witaminy D3 może być jedynie biomarkerem istniejącej choroby, a nie jej przyczyną. Aczkolwiek zakres chorób, dla których istniejące dowody empiryczne wykazują odwrotną zależność pomiędzy dotkliwością choroby a długotrwałym poziomem witaminy D3 sugeruje, że to założenie powinno być odwrócone [169].
Witamina D powyżej 50 ng/mL
W tym badaniu rozpatrywano korelację pomiędzy poziomem witaminy D jako markera odporności pacjenta a odpornością na COVID-19 i przypuszczalnie inne infekcje układu oddechowego. Porównano i połączono dane z dwóch zupełnie różnych zbiorów danych. Mocna strona wybranego podejścia leży w jego różnorodności, ponieważ dane z przeciwległych i niezależnych części zbioru danych dały podobne wyniki. Wynik ten wzmacnia hipotezę, że zgon w wyniku zakażenia wirusem odpowiedzialnym za COVID-19, oprócz innych czynników ryzyka, jest silnie zależny od poziomu witaminy D u pacjenta. Regresja zasugerowała, że dolny próg dla zdrowego poziomu witaminy D powinien wynosić około 125 nmol/L lub 50 ng/mL 25(OH)D3, co uratowałoby większość istnień ludzkich, zmniejszając wpływ wirusa nawet w przypadku pacjentów z różnymi chorobami współistniejącymi.
Jest to, według naszej wiedzy, pierwsze badanie, które miało na celu określenie optymalnego poziomu witaminy D3 w celu zminimalizowania śmiertelności związanej z COVID-19, ponieważ inne badania zazwyczaj ograniczają się do określenia ilorazów szans dla 2-3 kohort pacjentów rozdzielonych na 30 ng/mL lub niższe.
W innym badaniu potwierdzono, że liczba zakażeń wyraźnie korelowała z odpowiednimi poziomami witaminy D3, przy wielkości kohorty zbliżonej do 200.000 [122]. Minimalną liczbę infekcji zaobserwowano przy poziomie 55 ng/mL.
Czy to oznacza, że witamina D chroni ludzi przed zakażeniem? Z fizycznego punktu widzenia, infekcja występuje, gdy wirusy lub bakterie przechwytują komórki ciała i wnikają do nich. Z medycznego punktu widzenia, infekcje definiuje się jako posiadające znamienne następstwa. Jednakże pozytywny wynik testu PCR oznacza, że dana osoba zaraża, nawet jeśli nie ma żadnych objawów klinicznych, co może być podstawą do skierowania jej na kwarantannę. Istnieją liczne dowody na to, że wiele osób z potwierdzonym zakażeniem SARS-CoV-2 nie wykazywało żadnych objawów [170].
W czterech więzieniach w USA prawie 3300 osadzonych przeszło testy na koronawirusa z wynikiem pozytywnym – 96% bez żadnych objawów
Hrabstwo Santa Clara: nawet 85 razy więcej ludzi zainfekowane Covid-19
Nieoczekiwane wykrycie przeciwciał na SARS-CoV-2 w okresie przed pandemicznym we Włoszech. [wrzesień 2019]
Dane CDC sugerują że COVID-19 był w USA już w listopadzie 2019 roku
Dr Denis Rancourt: Śmiertelność ze wszystkich przyczyn podczas COVID-19: Żadnej zarazy, prawdopodobna oznaka masowego morderstwa z powodu reakcji rządu [2 czerwca 2020]
PCR-yzm czyli współczesny łysenkizm – prof. dr hab. Roman Zieliński
„Infekcji fizycznej”, którą później można wykryć za pomocą testu PCR, można uniknąć jedynie poprzez zastosowanie środków fizycznych, takich jak dezynfekcja, maseczki i/lub spraye wirusobójcze, które uniemożliwią wirusowi wniknięcie do organizmu lub przyłączenie się do komórek ciała w celu ich zainfekowania. Jeśli jednak zdefiniujemy „infekcję” jako dającą objawy kliniczne, to będziemy musieli określić ją jako „niemą”, aby opisać to, co dzieje się, gdy układ odpornościowy zwalcza wirusa bez przejawiania żadnych objawów, poza produkcją specyficznych limfocytów T lub przeciwciał. Niemniej jednak, test PCR wykaże, że takie osoby są „ zakażone/zarażają”, co uzasadnia zaliczanie ich do „przypadków” nawet bez potwierdzenia objawami klinicznymi, np. w Worldometer Statistics [171].
Bezobjawowy nosiciel? Wywiad Dela Bigtree z dr Clare Craig
Diagnostyka za pomocą testów PCR. Objaśnienie Progu cyklu odcięcia. Błędna interpretacja wyników.
Tak jak poziom witaminy D3 koreluje nie tylko z nasileniem objawów, ale także z długością trwania choroby [172], można założyć, że to samo rozumowanie dotyczy także cichych infekcji. Stąd czas, w którym cicha infekcja sama w sobie jest aktywna, tzn. zakaźna i dlatego da pozytywny wynik PCR, może zostać skrócony. Sugerujemy, że może to mieć wyraźny wpływ na wskaźnik reprodukcji. Tak więc, wydaje się jasne, że dobra odporność, czy to naturalnie obecna z powodu dobrego przygotowania, czy z nabytej odporności krzyżowej z wcześniejszych infekcji ludzkim koronawirusem, nie może „chronić” przed infekcją jak środki fizyczne, ale może chronić przed objawami klinicznymi. Stwierdzenie tylko o połowę mniejszej liczby „zakażonych” pacjentów (potwierdzonych testami PCR) z poziomem witaminy D >30 ng/mL [122] nie dowodzi ochrony przed fizycznym zakażeniem, ale raczej przed jego konsekwencjami – zmniejszenie liczby dni, w których ludzie zarażali, musi statystycznie prowadzić do wykazanego wyniku tylko o połowę mniejszej liczby pozytywnych testów PCR odnotowanych w grupie >30 ng/mL w porównaniu do grupy <30 ng/mL. Ta „ochrona” była najbardziej skuteczna przy stężeniu ~55 ng/mL, co zgadza się z naszymi wynikami.
Wynik ten został również potwierdzony w badaniu z 2012 roku, które wykazało, że jeden ze śmiertelnych i siejących postrach objawów COVID-19, wymykający się spod kontroli stan zapalny prowadzący do niewydolności oddechowej, jest bezpośrednio skorelowany z poziomem witaminy D. Komórki inkubowane w 30 ng/mL witaminy D i powyżej wykazywały znacznie zmniejszoną reakcję na lipopolisacharydy (LPS), przy czym największe zahamowanie stanu zapalnego obserwowano przy dawce 50 ng/mL [173].
Wynik ten pasuje do danych naukowych na temat naturalnych poziomów witaminy D3 obserwowanych wśród łowców/zbieraczy prowadzących tradycyjny styl życia, egzystujących w wysoce zakaźnym środowisku, które wynosiły 110-125 nmol/L (45-50 ng/mL) [174].
Istnieje poważna rozbieżność jeśli chodzi o dawkę 30 ng/mL witaminy D3 uznawaną przez WHO za próg wystarczalności i limit 20 ng/mL przyjmowany przez Niemcy, Austrię i Szwajcarię.
Trzech dyrektorów irańskiego szpitala w Dubaju podaje również na podstawie swoich praktycznych doświadczeń, że wśród 21 pacjentów z COVID-19 z poziomem witaminy D3 powyżej 40 ng/mL (suplementowanych witaminą D3 przez okres do dziewięciu lat z powodów okulistycznych), że żaden z nich nie był hospitalizowany przez ponad 4 dni, nie wystąpiła u nich burza cytokin, nadkrzepliwość krwi ani deregulacja stanu zdrowia [175].
Dlatego stawiamy hipotezę, że długotrwała suplementacja witaminy D3 poprzedzająca infekcję o ostrym przebiegu zmniejszy ryzyko zgonu praktycznie do zera i ogólnie złagodzi przebieg choroby.
Aczkolwiek musimy zaznaczyć, że istnieją wyjątki od tej reguły natury: jak w każdym wieloczynnikowym otoczeniu, odkrywamy rozkład krzywej dzwonowej w aktywacji ogromnej liczby genów, które są pod kontrolą witaminy D. Mogą istnieć genetyczne powody tego odkrycia, ale istnieją również dodatkowe parametry wpływające niezbędne do produkcji enzymów i komórek układu odpornościowego, takie jak magnez, cynk i selen. Carlberg i in. natrafili na ten rozkład krzywej dzwonowej podczas sprawdzania aktywacji 500-700 genów przyczyniających się do produkcji komórek i białek istotnych dla układu odpornościowego po suplementacji witaminą D3 [176]. Uczestnicy z dolnej granicy wykazywali tylko aktywację na poziomie 33%, podczas gdy inni z górnej granicy wykazywali ponad 80% „z 36 parametrów wyzwalanych przez witaminę D3″. Carlberg użył terminu (witamina D3) „osoby słabo i wysoce reagujące”, aby opisać to, co widział.
To odkrycie może wyjaśnić, dlaczego osoba wysoce reagująca z „niedoborem witaminy D3″ może wykazywać jedynie łagodne lub nawet nie wykazywać żadnych objawów, podczas gdy osoba słabo reagująca może umrzeć. Wyjaśnia również, dlaczego, z jednej strony, wiele tak zwanych chorób „autoimmunologicznych” opartych na zapaleniu wysoko koreluje z poziomem witaminy D3 w oparciu o, np. wyższe szerokości geograficzne lub wyższy wiek, kiedy produkcja witaminy D3 spada, ale dlaczego tylko część populacji jest dotknięta: przypuszczalnie to właśnie osoby słabo reagujące są najbardziej dotknięte chorobą. Stąd, dla 68-95% (1 lub 2 sigma SD), sugerowany poziom witaminy D3 może być wystarczający do zwalczania powszednich infekcji, a dla 2,5-16% osób wysoce reagujących jest więcej niż wystarczający i jest całkowicie nieszkodliwy. Jednak dla 2,5-16% osób słabo reagujących na leczenie, poziom ten powinien być podniesiony do 75 ng/mL lub nawet >100 ng/mL, aby osiągnąć ten sam stan odporności, jak w przypadku osoby średnio reagującej na leczenie. Badanie poziomu witaminy D3 przed rozpoczęciem jakiejkolwiek suplementacji w połączeniu z osobistą historią chorób pacjenta mógłby dostarczyć dobrych wskazówek co do tego, do której grupy należy pacjent i czy 50 ng/mL będzie dla niego wystarczającą dawką, czy też, jeśli „normalny” poziom witaminy D3 zostanie stwierdzony (pomiędzy 20 a 30 ng/mL) wraz z którąkolwiek ze znanych chorób autoimmunologicznych zależnych od witaminy D3, należy zapobiegawczo dążyć do wyższego poziomu, zwłaszcza, że poziomy do 120 ng/mL są uznawane przez WHO za nie wywołujące negatywnych skutków ubocznych.
Jako że przyszłe mutacje wirusa SARS-CoV-2 mogą nie być podatne na odporność nabytą w wyniku szczepienia lub poprzedniego zakażenia, to cała populacja powinna jak najszybciej podnieść poziom witaminy D w surowicy do bezpiecznego poziomu. Tak długo, jak dostarczana jest wystarczająca ilość witaminy K2, sugerowane poziomy witaminy D3 są całkowicie bezpieczne do osiągnięcia poprzez suplementację. Aczkolwiek organizm nie jest ani monotematyczny, ani jedno przyczynowy, lecz stanowi skomplikowany system zależności i interakcji wielu różnych metabolitów, hormonów, witamin, mikroelementów, enzymów itp. Poziom selenu, magnezu, cynku oraz witamin A i E we krwi również powinien być kontrolowany i powinny być one uzupełniane w razie potrzeby, aby zoptymalizować warunki dla dobrze funkcjonującego układu odpornościowego.
Rola witaminy A w rozwoju i funkcjonowaniu organizmu – Sally Fallon Moreli i dr Thomas S. Cowan
Leczenie krztuśca witaminą C – dr Suzanne Humphries
Proste badanie obserwacyjne mogłoby udowodnić lub obalić wszystkie powyższe stwierdzenia. Gdyby zbadać natychmiast kontakty osoby zakażonej z pozytywnym wynikiem testu PCR na poziom witaminy D3, tj. przed wystąpieniem jakichkolwiek objawów, a następnie obserwować je przez 4 tygodnie i odnieść przebieg ich symptomatologii do poziomu witaminy D3, należy uzyskać taki sam wynik, jak pokazano powyżej: regresja powinna przekroczyć zerową linię podstawową przy 45-55 ng/mL. Dlatego zdecydowanie zalecamy przeprowadzenie takiego badania, które można by przeprowadzić bardzo niewielkim nakładem ludzkim i ekonomicznym.
Nawet choroby spowodowane niskim poziomem witaminy D3 nie mogą być całkowicie wyleczone poprzez zapewnienie określonego (stałego) poziomu witaminy D3 dla populacji, ponieważ aktywacja układu odpornościowego jest zmienna. Jednakże, aby realizować wciąż aktualny cytat Skryboniusza Largusa: „Primum non nocere, secundum cavere, tertium sanare” z 50 r. n.e., obowiązkiem zawodu lekarza powinno być dokładne przyjrzenie się lekowi lub suplementowi, który może pomóc (tertium sanare), tak długo, jak nie ma znanych zagrożeń (primum non nocere) w granicach dawek, które są potrzebne dla wspomnianego poziomu krwi (secundum cavere).
Niestety, nie oznacza to, że w przypadku zakażenia SARS-CoV-2 o ostrym przebiegu, świeżo rozpoczęta suplementacja 25(OH)D3 będzie pomocnym lekarstwem, gdy niedobór kalcydiolu jest oczywisty, zwłaszcza jeśli ten niedobór był długotrwały i spowodował lub zaostrzył typowy przebieg chorób współistniejących, które mogą teraz pogorszyć skutki infekcji. Nie było to pytanie, na które chcieliśmy odpowiedzieć w tym badaniu.
5. Ograniczenia
Niniejsze badanie nie kwestionuje istotnej roli, jaką odegrają szczepienia w radzeniu sobie z pandemią COVID-19. Nie twierdzi również, że w przypadku ostrego przebiegu zakażenia SARS-CoV-2, wysoki wzrost stężenia 25(OH)D3 jest lub mógłby być pomocnym środkiem zaradczym, gdy niedobór witaminy D jest oczywisty, ponieważ jest to inna kwestia. Co więcej, dane empiryczne dotyczące śmiertelności w grupie pacjentów zakażonych COVID-19 dla stężenia witaminy D3 we krwi powyżej 35 ng/mL są skąpe.
6. Wnioski
Chociaż istnieje ogromna liczba publikacji potwierdzających związek między ciężkością przebiegu i śmiertelnością zakażeń SARS-CoV-2 a stężeniem witaminy D3 we krwi, to nadal pozostaje otwarta dyskusja dotycząca tego, czy związek ten ma charakter przyczynowy. Wynika to z faktu, że w większości badań poziom witaminy D był oznaczany kilka dni po rozpoczęciu infekcji, dlatego niski poziom witaminy D może być skutkiem, a nie czynnikiem wyzwalającym przebieg infekcji.
W niniejszej publikacji posłużyliśmy się metaanalizą dwóch niezależnych zestawów danych. Jedna analiza oparta jest na długoterminowych średnich poziomach witaminy D3 udokumentowanych dla 19 krajów. Druga analiza opiera się na 1601 hospitalizowanych pacjentach, z których 784 miało zmierzony poziom witaminy D w ciągu doby po przyjęciu do szpitala, i 817, u których poziom witaminy D był znany przed zakażeniem. Oba zestawy danych wykazują silną korelację pomiędzy wskaźnikiem zgonów spowodowanych przez SARS-CoV-2 a poziomem witaminy D we krwi. Przy progowym poziomie 30 ng/mL, śmiertelność znacznie spada. Ponadto nasza analiza pokazuje, że korelacja dla połączonych zestawów danych przecina oś przy około 50 ng/mL, co sugeruje, że ten poziom witaminy D3 we krwi może zapobiegać nadmiernej śmiertelności. Odkrycia te są potwierdzane nie tylko przez duże badanie dotyczące infekcji, wykazujące to samo optimum, ale także przez normalne poziomy obserwowane u ludzi żyjących w regionie, z którego pochodzi ludzkość, którzy byli w stanie zwalczyć większość (nie wszystkie) infekcji u większości (nie wszystkich) osób.
Szczepienia są i będą ważnym filarem w naszej walce z SARS-CoV-2. Aczkolwiek obecne dane wyraźnie pokazują, że same szczepienia nie są w stanie zapobiec wszystkim infekcjom SARS-CoV-2 i rozprzestrzenianiu się wirusa. Scenariusz ten może ulec znacznemu pogorszeniu w przypadku pojawienia się nowych mutacji wirusa, które są mało wrażliwe na obecne szczepionki lub nawet niewrażliwe na żadną szczepionkę.
Dlatego na podstawie naszych danych, autorzy zdecydowanie zalecają połączenie szczepień z rutynowym wzmacnianiem układu odpornościowego całej populacji poprzez suplementację witaminą D3, aby stale zapewniać jej stężenie we krwi na poziomie powyżej 50 ng/mL (125 nmol/L). Z medycznego punktu widzenia nie tylko uratuje to wiele istnień ludzkich, ale także zwiększy skuteczność szczepień. Ze społecznego i politycznego punktu widzenia zmniejszy to potrzebę dalszych restrykcji dotyczących kontaktów międzyludzkich i kwarantann. Z ekonomicznego punktu widzenia, pozwoli to zaoszczędzić miliardy dolarów na całym świecie, ponieważ witamina D3 jest niedroga i wraz ze szczepionkami stwarza dobrą okazję do opanowania rozprzestrzeniania się wirusa SARS-CoV-2.
Ignorancja i uprzedzenia w medycynie – dr Vernon Coleman
Co robić, żeby lekarz cię nie zabił – dr Vernon Coleman
Raport pt. Śmierć z powodu medycyny – dr Gary Null, dr Carolyn Dean, dr Martin Feldman, dr Debora Rasio i dr Dorothy Smith. [2003]
Chociaż istnieje bardzo szerokie poparcie oparte na danych dla ochronnego działania witaminy D przeciwko zakażeniom wirusem SARS-CoV-2 o ciężkim przebiegu, zdecydowanie zalecamy rozpoczęcie dobrze zaprojektowanych badań obserwacyjnych, jak wspomniano i/lub podwójnie ślepych randomizowanych badań kontrolowanych (RCTs), aby przekonać społeczność medyczną i władze nadzorujące system ochrony zdrowia, że badania i suplementacja witaminy D są potrzebne, aby uniknąć śmiertelnych infekcji przełomowych wśród zaszczepionych i być przygotowanym na nowe niebezpieczne mutacje.
Witamina D a COVID-19
Wartość witaminy D w budowaniu naszej odporności jest dobrze udokumentowana, w ostatnim czasie okazała się również sprzymierzeńcem w walce z COVID-19. Zapraszamy do wysłuchania webinarium, w którym prof. Paweł Płudowski porusza następujące tematy:
1:34 – od czego zależy wydajność naszego układu odpornościowego 2:34 – szlak przemian witaminy D w organizmie człowieka 3:02 – niedobór witaminy D w Europie i w Polsce – jaka jest skala problemu? 5:09 – rola witaminy D w budowaniu odporności 8:04 – niedobór witaminy D a przebieg infekcji 10:11 – witamina D a działanie układu immunologicznego u dzieci 11:37 – jak działa wirus SARS-CoV-2 i jaki to ma związek z witaminą D 12:39 – poziom witaminy D we krwi a zagrożenie ciężkim przebiegiem COVID-19 14:04 – przegląd badań witamina D a COVID-19 16:06 – prawdopodobieństwo zgonu z powodu COVID-19 u pacjentów ze stężeniem witaminy D poniżej 12 ng/ml 17:27 – przegląd badań c.d. 29:28 – wpływ witaminy D na proces zakażenia i przechorowania COVID-19 30:48 – Q&A (m.in. lek czy suplement, jakie dawki, jak często, jakie badanie zrobić) 35:59 – jaki jest optymalny poziom witaminy D we krwi w czasie pandemii COVID-19
Bibligrafia:
Brawo…za realizm oceny
Świetna robota. EBM w czystej postaci. Brawo!