Paracetamol i niedobór glutationu a objawy i zgony na COVID-19
Nie mogę przecenić faktu, jak ważne jest poniższe badanie o glutationie, opublikowane w czerwcu przez Amerykańskie Towarzystwo Chemiczne (American Chemical Society), dla poprawnego radzenia sobie z chorobą COVID-19. Niestety istnieje 17-letnia luka w medycynie między badaniami a praktyką. Jak zatem mamy się postarać, żeby lekarze, pielęgniarki i szpitale, zakorzenieni w swoich procedurach (nawet jeżeli dowody wskazują, że te procedury powodują szkody?), zwrócili na to uwagę?!
Pozwól, że wyjaśnię, dlaczego ty, twój lekarz i każda osoba, która leczy pacjentów w szpitalu, powinna to wiedzieć.
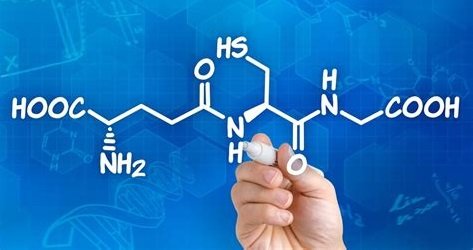
🔥 Glutation (tripeptyd składający się z cysteiny, glicyny i kwasu glutaminowego) jest najliczniej występującym antyoksydantem niskocząsteczkowym, który odgrywa bardzo istotną rolę w obronie antyoksydacyjnej przeciwko uszkodzeniom oksydacyjnym komórek przez reaktywne formy tlenu (RFT) oraz bierze udział w regulacji różnych szlaków metabolicznych istotnych dla homeostazy całego organizmu
🤒 Niedobory glutationu zaostrzają przebieg choroby w przypadku COVID-19
🚬 Pacjenci o średnim do ostrego przebiegu COVID-19 mają niższe poziomy glutationu. Potwierdzono to testami oraz przy pomocy dowodów pośrednich (palacze, astmatycy i osoby starsze stanowią dużo cięższe przypadki. Jednym wspólnym mianownikiem dla tych grup demograficznych jest niższy poziom glutationu. Zresztą, jedno badanie wykazało, że dzieci z ciężką postacią astmy miały dwukrotnie niższy poziom całkowitego glutationu w drogach oddechowych niż dzieci z występującymi objawami ze strony układu oddechowego, które nie chorują na astmę.)
💊ACETAMINOFEN (PARACETAMOL) OBNIŻA POZIOM GLUTATIONU.
Może go nawet całkiem pozbawić. Istnieją dziesiątki recenzowanych naukowo badań, które to potwierdzają. Oto dwa, którymi możesz podzielić się ze sceptycznym pracownikiem medycznym, który kręci głową i mówi, „Stosujemy go od lat, więc musi być idealnie bezpieczny”:
1) https://pubmed.ncbi.nlm.nih.gov/15878691/
2) https://www.jbc.org/content/274/15/10349.full
Teraz najlepsze. Paracetamol (Acetaminofen) jest głównym składnikiem APAPu, Panadolu i innych wynalazków (np. Coldrex, Gripex, Fervex) .
CO JEST PIERWSZĄ RZECZĄ, KTÓRĄ LEKARZE PODAJĄ PACJENTOM Z KORONAWIRUSEM? Coś na gorączkę z paracetamolem?
A zatem, nasza procedura leczenia pacjentów z koronawirusem, przyjętych z gorączką lub bólami całego ciała polega na podaniu tego właśnie leku, który pozbawia ich organizmy czegoś, czego desperacko potrzebują, żeby pokonać infekcję.
Gorączka u dziecka – dlaczego pozwolić jej spełniać swoje funkcje – dr Paul Offit
Związek paracetamolu z autyzmem – dr William Parker
Leki przeciwbólowe w czasie ciąży mogą wpływać na płodność dzieci – Uniwersytet w Edynburgu
Endogenny niedobór glutationu jako najbardziej prawdopodobna przyczyna poważnych objawów i zgonów wśród pacjentów z COVID-19
Źródło: ACS Infect. Dis. 2020, 6, 7, 1558–1562; Endogenous Deficiency of Glutathione as the Most Likely Cause of Serious Manifestations and Death in COVID-19 Patients https://pubs.acs.org/doi/10.1021/acsinfecdis.0c00288
Streszczenie
Wyższe wskaźniki poważnych zachorowań i zgonów z powodu infekcji koronawirusem SARS-CoV-2 (COVID-19) wśród osób starszych oraz wśród osób z chorobami współistniejącymi sugerują, że procesy biologiczne związane z wiekiem i chorobami sprawiają, że takie osoby są bardziej wrażliwe na czynniki szkodliwe w środowisku, w tym na czynniki zakaźne, takie jak koronawirus SARS-CoV-2. Zwłaszcza zaburzenia homeostazy redoks i związany z nią stres oksydacyjny wydają się być ważnymi procesami biologicznymi, które mogą przyczyniać się do zwiększonej indywidualnej podatności na zróżnicowane szkodliwe czynniki środowiskowe. Celem tego Stanowiska jest uzasadnienie (1) istotnej roli glutationu w określaniu indywidualnej responsywności na infekcję COVID-19 i patogenezę choroby oraz (2) wykonalności zastosowania glutationu jako środka leczenia i zapobiegania zachorowaniom na COVID-19. Hipoteza, że niedobór glutationu jest najbardziej prawdopodobnym wyjaśnieniem poważnych objawów i zgonów wśród pacjentów z COVID-19, została postawiona na podstawie gruntownej analizy piśmiennictwa i obserwacji. Hipoteza ta rozwiązuje zagadki związane z danymi epidemiologicznymi na temat czynników ryzyka determinujących ostre objawy infekcji COVID-19 oraz wysokiego ryzyka zgonu, a także otwiera realne możliwości skutecznego leczenia i zapobiegania chorobie.
Niedobór glutationu a objawy i zgony na COVID-19
Nowy koronawirus SARS-CoV-2 (COVID-19) wciąż rozprzestrzenia się na całym globie, dotykając coraz więcej ludzi; dlatego niezbędne jest określenie skutecznych leków dla zapobiegania i leczenia choroby. Przeważająca większość osób zarażonych SARS-CoV-2 przechodzi chorobę w sposób bezobjawowy, łagodny lub umiarkowany, a tylko u 14% i 5% pacjentów rozwinęła się odpowiednio choroba w postaci ciężkiej lub krytycznej.(1) Wyższe wskaźniki poważnych zachorowań i zgonów z powodu infekcji COVID-19 wśród starszych osób i tych z chorobami współistniejącymi sugerują, że procesy biologiczne związane z wiekiem i chorobami sprawiają, że takie osoby są bardziej wrażliwe na czynniki szkodliwe w środowisku, w tym na czynniki zakaźne, takie jak koronawirus SARS-CoV-2. Zwłaszcza zaburzenia homeostazy redoks i związany z nią stres oksydacyjny wydają się być ważnymi procesami biologicznymi, które mogą przyczyniać się do zwiększonej indywidualnej podatności na zróżnicowane szkodliwe czynniki środowiskowe.
Stres oksydacyjny jest nieswoistym stanem patologicznym odzwierciedlającym brak równowagi między zwiększoną produkcją reaktywnych form tlenu (RFT) a niezdolnością systemów biologicznych do detoksykacji reaktywnych produktów pośrednich lub do naprawy powstałych uszkodzeń.(2)
Przede wszystkim, reaktywne form tlenu [RFT] są ściśle związane ze starzeniem, ponieważ pośredniczą między reakcją na stres a uszkodzeniami zależnymi od wieku.(3) Liczne dowody popierają pogląd, że stres oksydacyjny i związany z nim stan zapalny, wynikające ze zwiększonej produkcji RFT i/lub obniżonej obrony antyoksydacyjnej przyczyniają się do patogenezy wielu chorób przewlekłych,(4) łącznie z cukrzycą i chorobami układu oddechowego i układu krążenia, co do których wiadomo, że zwiększają ryzyko ciężkiego przebiegu choroby i zgonu wśród pacjentów z COVID-19.(5) Wiadomo również, że wywołane przez wirusa modyfikacje reakcji antyoksydacyjnej nosiciela stanowią istotny czynnik decydujący o rozwoju szeregu chorób wirusowych.(6) Z tego względu system obrony antyoksydacyjnej, chroniący przed stresem oksydacyjnym ma wielkie znaczenie w kontekście zrozumienia podstawowych mechanizmów nieswoistej wrażliwości lub odporności na czynniki zakaźne.
Glutation (tripeptyd złożony z cysteiny, glicyny i kwasu glutaminowego) jest najliczniej występującym antyoksydantem niskocząsteczkowym, który odgrywa bardzo istotną rolę w obronie antyoksydacyjnej przeciwko uszkodzeniom oksydacyjnym komórek przez reaktywne formy tlenu (RFT) oraz bierze udział w regulacji różnych szlaków metabolicznych, istotnych dla homeostazy całego organizmu.(7) Utrzymanie najwyższych (milimolowych) stężeń glutationu zredukowanego (GSH) w większości rodzajów komórek wskazuje na jego istotną i wielofunkcyjną rolę w kontrolowaniu różnych procesów biologicznych, takich jak detoksykacja związków obcych i endogennych, zwijanie białek, regeneracja witamin C i E, utrzymanie funkcji mitochondriów, obrona antywirusowa, regulacja proliferacji komórek, apoptoza i reakcja immunologiczna.(7) Pomimo wielu publikacji na temat korzystnego wpływu glutationu na ludzkie zdrowie, kluczowa rola tego silnego antyoksydantu w ludzkiej fizjologii i patologii oraz w zastosowaniu klinicznym wciąż pozostaje niedoceniona.
Celem tego Stanowiska jest uzasadnienie (1) istotnej roli glutationu w określaniu indywidualnej responsywności na infekcję COVID-19 i patogenezę choroby oraz (2) wykonalności zastosowania glutationu jako środka leczenia i zapobiegania zachorowaniom na COVID-19.
Czy niedobór glutationu pogarsza rokowania COVID-19 z powodu czynników ryzyka?
Liczne badania wykazują, że endogenny niedobór glutationu przyczyniał się do obniżenia biosyntezy i/lub zwiększonego wyczerpania zredukowanego glutationu [GSH], co w istotnym stopniu przyczynia się do patogenezy różnych chorób poprzez mechanizmy wywołujące stres oksydacyjny i stany zapalne. Diagram 1 zawiera podsumowanie najczęstszych przyczyn odpowiadających za endogenny niedobór glutationu oraz mechanizmy, poprzez które ten niedobór może przyczynić się do ciężkiego przebiegu COVID-19.
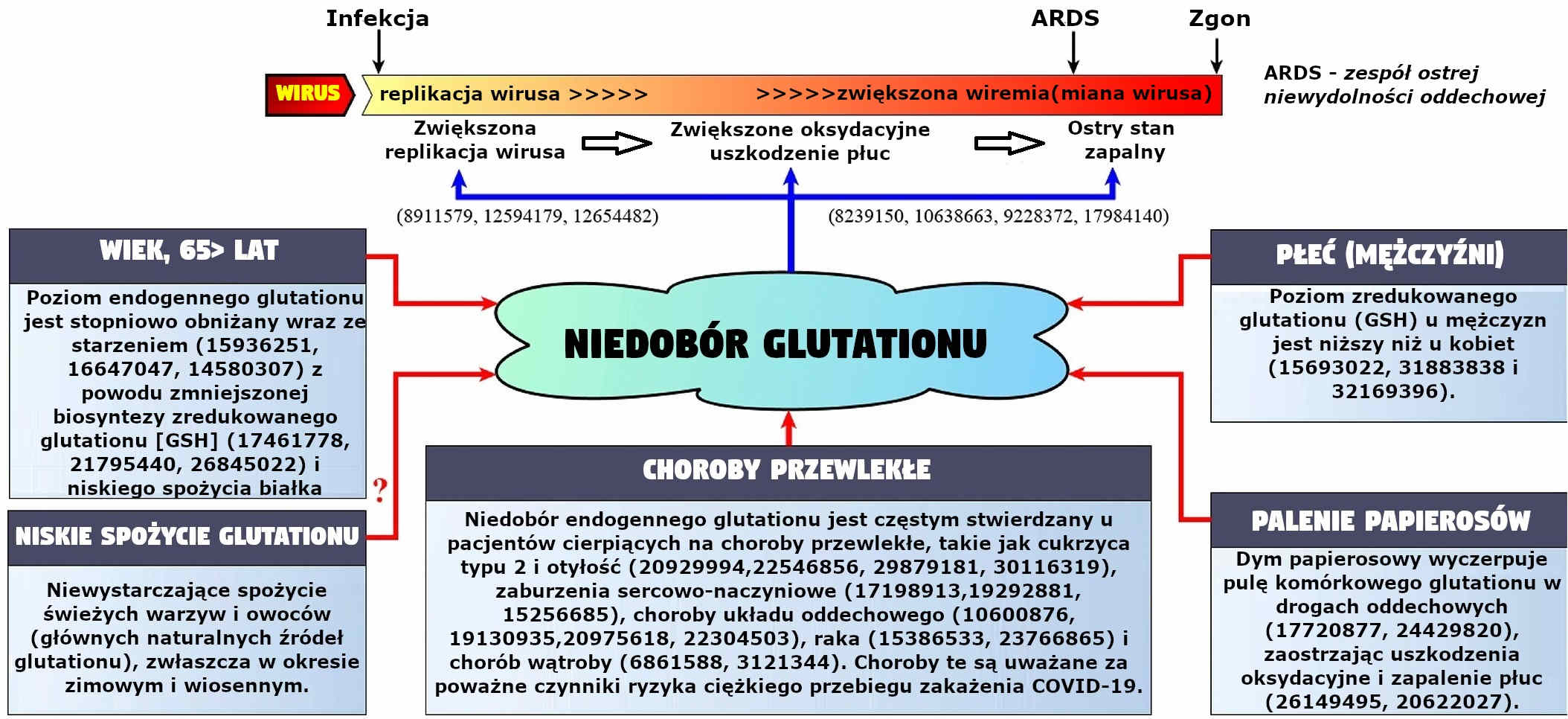
Diagram 1. Czynniki odpowiadające za endogenny niedobór glutationu oraz mechanizmy, poprzez które ten niedobór może przyczynić się do patogenezy i [druzgocących] efektów COVID-19. U dołu diagramu pokazano, że czynniki ryzyka ciężkiego przebiegu infekcji COVID-19 są związane z obniżeniem/wyczerpaniem poziomu glutationu wewnątrz komórkowego. U góry diagramu pokazano potencjalne mechanizmy, poprzez które niedobór glutationu może wpływać na objawy kliniczne i efekty w przypadku zachorowania na COVID-19. Liczby w nawiasach oznaczają bibliografię PubMed (PMID).
Wiek jest dobrze znanym czynnikiem ryzyka rozwoju ciężkiego przebiegu choroby, komplikacji i zgonów z powodu infekcji COVID-19.(8) Co ciekawe, badania nad zwierzętami i ludźmi wskazują, że poziomy endogennego glutationu stopniowo spadają wraz z wiekiem, przez co komórki osób starszych stają się bardziej podatne na uszkodzenia oksydacyjne spowodowane różnymi czynnikami środowiskowymi w porównaniu do młodszych osób.
Choroby współistniejące uważane są za jeden z najważniejszych czynników ryzyka, odpowiadających za słabe rokowania u pacjentów z COVID-19.(5) Co ciekawe, niedobór endogennego glutationu często obserwuje się u osób z chorobami przewlekłymi oraz u osób z pogarszającymi się rokowaniami wśród osób chorujących na COVID-19. To oznacza, że obniżone poziomy glutationu, występujące u pacjentów z COVID-19 i chorobami przewlekłymi mogą stanowić czynnik wyzwalający, który przesuwa homeostazę redoks w kierunku stresu oksydacyjnego, tym samym zaostrzając stan zapalny w płucach i prowadząc do zespołu ostrej niewydolności oddechowej (ARDS), niewydolności wielonarządowej i zgonu.
Śmiertelność z powodu COVID-19 związana z płcią jest jednym z powszechnych odkryć epidemiologicznych na całym świecie,(9) wskazującym na znaczenie dymorfizmu płciowego w podatności na ciężki przebieg choroby. Zaobserwowano, że mężczyźni znacznie częściej odczuwają poważne skutki infekcji COVID-19 i dotyczy ich większy wskaźnik zgonów niż kobiet.(9) Poza tym, mężczyźni mają w osoczu niższe stężenia glutationu zredukowanego (GSH) niż kobiety, przez co są bardziej podatni na stres oksydacyjny i stany zapalne niż kobiety.
Palenie papierosów również jest brane pod uwagę jako czynnik ryzyka wystąpienia poważnych komplikacji i zgonu z powodu COVID-19.(10) Wiadomo, że dym papierosowy wyczerpuje zapasy glutationu komórkowego w drogach oddechowych, pogłębiając uszkodzenia oksydacyjne i stany zapalne w płucach, co prawdopodobnie jest przyczyną tego, że palacze z COVID-19 częściej wymagają intensywnej pomocy medycznej.
Czynniki żywieniowe również mogą przyczyniać się do endogennego niedoboru glutationu u pacjentów z ciężkim przebiegiem COVID-19. W szczególności niewystarczające spożywanie świeżych warzyw i owoców, które stanowią naturalne źródło glutationu, wydaje się być ważnym, jednak jeszcze nie ustalonym czynnikiem odpowiedzialnym za niedobory glutationu u pacjentów z ciężkim przebiegiem COVID-19.
A zatem, związek między czynnikami ryzyka a ostrymi objawami i zgonami pacjentów z COVID-19 można przypisać wspólnej przyczynie, niedoborom glutationu.
Jaka jest główna przyczyna ostrego przebiegu COVID-19: niedobory witaminy D czy glutationu?
Nowa hipoteza mówiąca, że niedobór witaminy D odpowiada za ostre objawy i zgony wśród pacjentów z COVID-19 została sformułowana(11) i jest przedmiotem ożywionych dyskusji w środowisku naukowym. Kilka badań wykazało, że poziomy glutationu pozytywnie korelują z aktywną witaminą D.(12,13) Stwierdzono również niższe poziomy L-cysteiny (ograniczającej tempo zużycia prekursora GSH) i zredukowany glutation [GSH] skorelowane z białkiem wiążącym witaminę D (VDBP) oraz poziomem witaminy D u pacjentów z cukrzycą typu 2.(14) Wiadomo, że suplementacja L-cysteiny poprawia poziom zredukowanego glutationu [GSH] poprzez podwyższenie ekspresji białka wiążącego witaminę D, 25-hydroksylazy witaminy D oraz receptora witaminy D, tym samym podnosząc poziom witaminy D i obniżając biomarkery stanu zapalnego u szczurów z cukrzycą.(15)
Co ciekawe, niedawno przeprowadzone badania eksperymentalne(16) wykazały, że niedobory zredukowanego glutationu [GSH] i związany z nimi wzrost stresu oksydacyjnego w sposób epigenetyczny, zmieniają geny regulatorowe witaminy D, a w rezultacie stłumiona ekspresja genu obniża biosyntezę witaminy D, ostatecznie doprowadzając co wtórnego niedoboru witaminy D. Warto zauważyć, że uzupełnienie zredukowanego glutationu [GSH] poprzez leczenie L-cysteiną w sposób korzystny zmieniło epigenetyczne enzymy metylotransferazy oraz zwiększyło ekspresję genów metabolicznych witaminy D. Badanie to dostarcza istotne informacje na temat tego, że glutation jest niezbędny do kontrolowania endogennej biosyntezy witaminy D oraz prezentuje potencjalne korzyści z leczenia [podniesienia poziomu] zredukowanego glutationu na zmniejszanie niedoborów witaminy D. Reasumując, wyniki te wskazują, że to raczej niedobór glutationu niż witaminy D jest główną przyczyną podstawowych zaburzeń biochemicznych, w tym spadku biosyntezy witaminy D oraz odpowiada za ostre objawy i zgony wśród pacjentów z COVID-19.
W prosty sposób o metylacji – Czym jest metylacja?
Dane EU wskazują na korelację pomiędzy szczepieniem przeciwko grypie, niedoborem witaminy D i śmiertelnością z powodu COVID-19
Antywirusowe, przeciwzapalne i przeciwzakrzepowe właściwości glutationu
Szereg badań wskazuje, że wyższe poziomy glutationu mogą poprawić indywidualną responsywność na infekcje wirusowe. W szczególności wiadomo, że glutation chroni komórki odpornościowe nosiciela dzięki swojemu mechanizmowi antyoksydacyjnemu oraz odpowiada za optymalne funkcjonowanie różnych komórek, które wchodzą w skład układu odpornościowego. Należy zauważyć, że istnieją dowody, że glutation hamuje replikację różnych wirusów na różnych stadiach ich cyklów życiowych (Diagram 1), i ta antywirusowa właściwość zredukowanego glutationu [GSH] wydaje się zapobiegać powiększaniu ilości kopii wirusa oraz w następstwie masowemu uwalnianiu komórek zapalnych do płuc (“burzy cytokinowej”).
Burza cytokin i koronawirus SARS-CoV-2 – Douglas Perry
Antywirusowe działanie glutationu wykazano w badaniu przeprowadzonym przez S. De Flora i in.(17) , które wykazało, że profilaktyczne podawanie N-acetylocysteiny (NAC, prekursor glutationu) przez 6 miesięcy znacznie obniżyło występowanie klinicznie widocznych epizodów grypy i grypopodobnych, zwłaszcza u osób starszych, z grupy podwyższonego ryzyka. Oprócz tego takie warunki patofizjologiczne, jak uszkodzenia komórek płuc i stany zapalne u pacjentów z ciężką postacią ARDS określono jako cele leczenia za pomocą NAC. W szczególności odkryto, że niedobory zredukowanego glutationu w cieczy w pęcherzykach płucnych u pacjentów z zespołem ostrej niewydolności oddechowej [ARDS] zwiększają uszkodzenia komórek płuc poprzez stres oksydacyjny/ RFT i stany zapalne, a uszkodzeniom tym można skutecznie zapobiegać i je leczyć poprzez podawanie NAC (Diagram 1). Niedobory glutationu mogą również sprzyjać zwiększeniu aktywności czynnika von Willebranda, powodującego koagulopatie u pacjentów z COVID-19.
Niedobory glutationu zaostrzają przebieg COVID-19: moje obserwacje
Uniwersytet Medyczny w Kursku od grudnia 2016 roku uczestniczy w projekcie nad genetyką homeostazy redoks przy cukrzycy typu 2 (T2D). W kwietniu 2020 roku u czworga pacjentów z grupy kontrolnej potwierdzono COVID-19. Od pacjentów pobrano próbki krwi i natychmiast po pobraniu wykorzystano je do pomiaru poziomu reaktywnych form tlenu [RFT] i zredukowanego glutationu [GSH] w osoczu. Cała czwórka pacjentów to były kobiety, niepalące i bez chorób przewlekłych. Tabela 1 pokazuje opis tych przypadków. Pacjenci z umiarkowanym i ciężkim przebiegiem COVID-19 mieli niższe poziomy glutationu i wyższe poziomy reaktywnych form tlenu [RFT] oraz stosunek RFT/GSH w osoczu niż pacjenci z łagodnym przebiegiem choroby, co wyraźnie wskazuje na niedobór glutationu i oznaki stresu oksydacyjnego u pacjentów z poważnymi objawami choroby. Znamienne jest to, że tylko pacjentka z ciężkim przebiegiem choroby i oznaczonym spadkiem glutationu nadal jest ciężko chora, podczas gdy pozostałe pacjentki z wysokim/średnim poziomem GSH wyzdrowiały.
Tabela 1. Charakterystyka kliniczna i laboratoryjna czterech pacjentów z COVID-19a
| przypadki | nasilenie choroby | BMI, kg/m2/historia rodzinna (FH) | dzień początku klinicznego po kontakcie z zarażonym pacjentem | objawy kliniczne | dzień, w którym objawy ustąpiły | parametry statusu redoks, μmol/Lb |
| 1. kobieta M. (wiek 34) | łagodne | 23.8 | 8 | temperatura 38 °C, lekkie bóle mięśni | 6 | GSH, 0,712; ROS, 2,075; stosunek ROS/GSH, 2,9 |
| 2. kobieta P. (wiek 47) | łagodne | 21.0 | 10 | temperatura 37,3 °C, lekkie zmęczenie | 4 | GSH, 0,933; ROS, 1,143; stosunek ROS/GSH, 1,2 |
| 3. kobieta C. (wiek 44) | ciężkie | 22.5, FH cukrzyca | 4 | codziennie temperatura między 37,1 i 38,5 °C, suchy kaszel, chrypka, znaczne bóle mięśni i zmęczenie (radiograficznie potwierdzone zapalenie płuc) | wciąż chora, 24. dzień choroby (03.05.2020) | GSH, 0,079 (!); ROS, 2,73; stosunek ROS/GSH, 34,6 (!) |
| 4. kobieta R. (wiek 56) | umiarkowane do ciężkiego | 33.0, FH cukrzyca | 7 | temperatura do 39 °C, silny suchy kaszel, duszności, znaczne zmęczenie i tachykardia (radiograficznie potwierdzone zapalenie płuc) | 16 | GSH, 0,531; ROS, 3,677 (!); stosunek ROS/GSH, 6,9 (!) |
a Wszystkie cztery przypadki były osobami niepalącymi bez chorób przewlekłych. Infekcję COVID-19 potwierdzono we wszystkich przypadkach testem PCR.
b Pomiaru parametrów dokonano 2 miesiące przed tym, zanim pacjenci zostali zarażeni koronawirusem SARS-CoV-2.
Hipoteza
Niedobory endogennego glutationu wydają się być kluczowym czynnikiem, zwiększającym uszkodzenia oksydacyjne płuc wywołane przez SARS-CoV-2 i w rezultacie prowadzą do poważnych objawów, takich jak zespół ostrej niewydolności oddechowej, niewydolność wielonarządowa i zgony u pacjentów z COVID-19. Jeżeli weźmie się pod uwagę antywirusowe działanie zredukowanego glutationu [GSH], osoby z niedoborami glutationu wydają się być bardziej podatne na niekontrolowaną replikację wirusa SARS-CoV-2, a tym samym cierpieć z powodu rosnącego miana wirusa. Nasilenie objawów klinicznych u pacjentów z COVID-19 wyznacza najwyraźniej stopień zaburzenia homeostazy redoks, który można przypisać niedoborom zredukowanego glutationu i zwiększonej produkcji reaktywnych form tlenu [RFT]. To założenie mogą potwierdzać wyniki naszych badań. W szczególności to, że pacjenci z umiarkowanym i poważnym przebiegiem COVID-19 mieli niższe poziomy glutationu, wyższe poziomy reaktywnych form tlenu [RFT], i wyższy status redoks (stosunek RFT/GSH) niż pacjenci z łagodnym przebiegiem COVID-19. Długotrwałe i ostre objawy infekcji COVID-19 u jednej z naszych pacjentek z wyraźnym niedoborem glutationu sugerują, że stopień obniżenia poziomu glutationu koreluje negatywnie z tempem replikacji wirusa i że rosnące miano wirusa nasila uszkodzenia oksydacyjne płuc. Powyższe ustalenie sugeruje, że wirus nie może tak aktywnie replikować się przy wyższym stężeniu glutationu komórkowego, dlatego obserwuje się łagodniejsze objawy kliniczne z niższym mianem wirusa.
Niedobór glutationu jest stanem nabytym wynikającym z obniżonej biosyntezy i/lub zwiększonego wyczerpania zapasów endogennego zredukowanego glutationu [GSH], spowodowanym czynnikami ryzyka, takimi jak starzenie, płeć męska, choroby współistniejące oraz palenie – pojedynczo lub w kombinacjach. Niedobór glutationu u pacjentów z ciężkim przebiegiem COVID-19 może również wynikać ze zmniejszonego spożycia świeżych warzyw i owoców (zwłaszcza zimą i wiosną), co stanowi ponad 50% glutationu przyjmowanego wraz z pożywieniem. Ta hipoteza sugeruje, że wirus SARS-CoV-2 stanowi zagrożenie tylko dla osób z niedoborami endogennego glutationu, bez względu na to, które z czynników – starzenie, przewlekłe choroby współistniejące, palenie czy jakieś inne były odpowiedzialne za ten deficyt. Ta hipoteza stanowi nowatorski wgląd na etiologię i mechanizmy odpowiedzialne za poważne objawy infekcji COVID-19 oraz stanowi uzasadnienie obiecujących możliwości skutecznego leczenia i zapobiegania chorobie poprzez odbudowywanie poziomu glutationu przy pomocy N-acetylocysteiny i zredukowanego glutationu.
Ponieważ efekt antywirusowy glutationu jest niespecyficzny, istnieje powód aby wierzyć, że glutation działa również aktywnie przeciwko SARS-CoV-2. Dlatego też odbudowa poziomów glutationu u pacjentów z COVID-19 może być obiecującą metodą radzenia sobie z nowym koronawirusem SARS-CoV-2. Zwłaszcza długotrwałe doustne podawanie N-acetylocysteiny zostało już sprawdzone jako skuteczny środek zapobiegawczy w przypadku wirusowych infekcji dróg oddechowych.(1) N-Acetylocysteina jest powszechnie dostępna, bezpieczna oraz tania i mogłaby być użyta do zastosowań pozarejestracyjnych.Ponadto, zastrzyki z NAC albo zredukowanym glutationem (GSH jest lepiej przyswajalny niż NAC) mogłyby stanowić skuteczną terapię pacjentów z ciężkim przebiegiem COVID-19. Horowitz i in.(18) właśnie opublikowali artykuł, potwierdzający tę hipotezę: autorzy poinformowali o skuteczności terapii glutationem w łagodzeniu duszności wywołanych zapaleniem płuc przy COVID-19. Tym niemniej, zaproponowana hipoteza musi zostać potwierdzona szerszymi badaniami epidemiologicznymi i eksperymentalnymi, jak również potrzebne są badania kliniczne, aby obiektywnie ocenić skuteczność N-acetylocysteiny i zredukowanego glutationu w leczeniu i zapobieganiu infekcji COVID-19.
Bibliografia:
1. Wu Z.; McGoogan J. M. (2020) Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China: Summary of a Report of 72 314 Cases From the Chinese Center for Disease Control and Prevention. JAMA 323, 1239.10.1001/jama.2020.2648.
2. Betteridge D. J. (2000) What is oxidative stress?. Metab., Clin. Exp. 49 (2 Suppl 1), 3–8. 10.1016/S0026-0495(00)80077-3.
3. Hekimi S.; Lapointe J.; Wen Y. (2011) Taking a ″good″ look at free radicals in the aging process. Trends Cell Biol. 21, 569–576. 10.1016/j.tcb.2011.06.008.
4. Pisoschi A. M.; Pop A. (2015) The role of antioxidants in the chemistry of oxidative stress: A review. Eur. J. Med. Chem. 97, 55–74. 10.1016/j.ejmech.2015.04.040.
5. Yang J.; Zheng Y.; Gou X.; Pu K.; Chen Z.; Guo Q.; Ji R.; Wang H.; Wang Y.; Zhou Y. (2020) Prevalence of comorbidities and its effects in coronavirus disease 2019 patients: A systematic review and meta-analysis. Int. J. Infect. Dis. 94, 91–95. 10.1016/j.ijid.2020.03.017.
6. Lee C. (2018) Therapeutic Modulation of Virus-Induced Oxidative Stress via the Nrf2-Dependent Antioxidative Pathway. Oxid. Med. Cell. Longevity 2018, 6208067.10.1155/2018/6208067.
7. Forman H. J.; Zhang H.; Rinna A. (2009) Glutathione: overview of its protective roles, measurement, and biosynthesis. Mol. Aspects Med. 30, 1–12. 10.1016/j.mam.2008.08.006.
8. Zhou F.; Yu T.; Du R.; Fan G.; Liu Y.; Liu Z.; Xiang J.; Wang Y.; Song B.; Gu X.; Guan L.; Wei Y.; Li H.; Wu X.; Xu J.; Tu S.; Zhang Y.; Chen H.; Cao B. (2020) Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet 395, 1054–1062. 10.1016/S0140-6736(20)30566-3.
9. Borges do Nascimento I. J.; Cacic N.; Abdulazeem H. M.; von Groote T. C.; Jayarajah U.; Weerasekara I.; Esfahani M. A.; Civile V. T.; Marusic A.; Jeroncic A.; Carvas Junior N.; Pericic T. P.; Zakarija-Grkovic I.; Meirelles Guimarães S. M.; Luigi Bragazzi N.; Bjorklund M.; Sofi-Mahmudi A.; Altujjar M.; Tian M.; Arcani D. M. C.; O’Mathúna D. P.; Marcolino M. S. (2020) Novel Coronavirus Infection (COVID-19) in Humans: A Scoping Review and Meta-Analysis. J. Clin. Med. 9, 941.10.3390/jcm9040941.
10. Vardavas C. I.; Nikitara K. (2020) COVID-19 and smoking: A systematic review of the evidence. Tob. Induced Dis. 18, 20.10.18332/tid/119324.
11. Grant W. B.; Lahore H.; McDonnell S. L.; Baggerly C. A.; French C. B.; Aliano J. L.; Bhattoa H. P. (2020) Evidence that Vitamin D Supplementation Could Reduce Risk of Influenza and COVID-19 Infections and Deaths. Nutrients 12, 988.10.3390/nu12040988.
12. Alvarez J. A.; Chowdhury R.; Jones D. P.; Martin G. S.; Brigham K. L.; Binongo J. N.; Ziegler T. R.; Tangpricha V. (2014) Vitamin D status is independently associated with plasma glutathione and cysteine thiol/disulphide redox status in adults. Clin. Endocrinol. (Oxford, U. K.) 81, 458–466. 10.1111/cen.12449.
13. Jain S. K.; Micinski D.; Huning L.; Kahlon G.; Bass P. F.; Levine S. N. (2014) Vitamin D and L-cysteine levels correlate positively with GSH and negatively with insulin resistance levels in the blood of type 2 diabetic patients. Eur. J. Clin. Nutr. 68, 1148–1153. 10.1038/ejcn.2014.114.
14. Jain S. K.; Kahlon G.; Bass P.; Levine S. N.; Warden C. (2015) Can L-Cysteine and Vitamin D Rescue Vitamin D and Vitamin D Binding Protein Levels in Blood Plasma of African American Type 2 Diabetic Patients?. Antioxid. Redox Signaling 23, 688–693. 10.1089/ars.2015.6320.
15. Jain S. K.; Kanikarla-Marie P.; Warden C.; Micinski D. (2016) L-cysteine supplementation upregulates glutathione (GSH) and vitamin D binding protein (VDBP) in hepatocytes cultured in high glucose and in vivo in liver, and increases blood levels of GSH, VDBP, and 25-hydroxy-vitamin D in Zucker diabetic fatty rats. Mol. Nutr. Food Res. 60, 1090–1098. 10.1002/mnfr.201500667.
16. Parsanathan R.; Jain S. K. (2019) Glutathione deficiency induces epigenetic alterations of vitamin D metabolism genes in the livers of high-fat diet-fed obese mice. Sci. Rep. 9, 14784.10.1038/s41598-019-51377-5.
17. De Flora S.; Grassi C.; Carati L. (1997) Attenuation of influenza-like symptomatology and improvement of cell-mediated immunity with long-term N-acetylcysteine treatment. Eur. Respir. J. 10, 1535–1541. 10.1183/09031936.97.10071535.
18. Horowitz R. I.; Freeman P. R.; Bruzzese J. (2020) Efficacy of glutathione therapy in relieving dyspnea associated with COVID-19 pneumonia: A report of 2 cases. Respir Med. Case Rep 30, 101063.10.1016/j.rmcr.2020.101063.