Szczepionki mRNA na COVID-19 – dr James Odell
1. Historia badań na zwierzętach ze szczepionką koronawirusową i Poszczepienne Wzmocnienie Infekcji Zależne od Przeciwciał (ADE)
2. Bardziej techniczne zrozumienie mechanizmów SARS-CoV-2 ADE
3. Szczepionki tradycyjne vs. mRNA
4. Mechanizmy szczepionek mRNA (na COVID-19)
5. PEG-ylowane nanocząsteczki lipidów
6. Produkcja szczepionek mRNA
7. Obecne szczepionki mRNA i potencjalne skutki uboczne
8. Składniki i dawkowanie szczepionek Moderna i Pfizer
9. Wydalanie/rozsiewanie wirusa po podaniu szczepionk mRNA oraz poszczepienna interferencja wirusowa
10. Białko kolcowe SARS-CoV-2 ma wspólną sekwencję z ludzkim białkiem Syncytyna-1
11. Adiuwanty
12. Stabilność i przechowywanie
13. Wdrożenie szczepień
14. Brak odpowiedzialności wynikający z ustawy PREP Act
Leczenie chorób wirusowych: czy prawdę ukrywano przez dziesięciolecia? – dr Lee D. Merritt
Szczepionka mRNA przeciw COVID-19 a neurodegeneracyjne choroby prionowe.
Stabilizowanie kodu – mRNA i receptory Toll-podobne – dr Mike Williams
Przewaga wariantów SARS-CoV-2 opornych na przeciwciała w przypadkach C-19 pomimo szczepienia z rejonu Zatoki San Francisco w stanie Kalifornia
Szczepionki mRNA na COVID-19
W związku z niedawnym licencjonowaniem i wprowadzaniem do obrotu szczepionek na COVID-19 w Wielkiej Brytanii, Kanadzie, Stanach Zjednoczonych (Pfizer/BioNTech i Moderna) i Rosji (Sputnik) istnieje kilka poważnych obaw dotyczących bezpieczeństwa, które nie zostały uwzględnione lub nawet wspomniane w mediach medycznych. Krótko mówiąc, podawanie tych eksperymentalnych szczepionek milionom ludzi jest czymś więcej niż lekkomyślnym i całkowicie niepotrzebnym, gdy dostępne są tylko ograniczone krótkoterminowe dane dotyczące bezpieczeństwa. Absolutnie nie przeprowadzono żadnych długoterminowych badań bezpieczeństwa, aby upewnić się, że żadna z tych szczepionek nie powoduje raka, drgawek, chorób serca, alergii i chorób autoimmunologicznych, tak jak zaobserwowano to w przypadku innych szczepionek we wcześniejszych badaniach na zwierzętach nad szczepionkami koronawirusowymi. Ponieważ badania na zwierzętach zostały pominięte w przypadku tych szczepionek z powodu „szybkiej procedury”, miliony ludzi obecnie stało się ludzkimi szczurami laboratoryjnymi.
„W pracach nad nową szczepionką pominięto standardowo wymaganą fazę przedkliniczną z wykorzystaniem modeli zwierzęcych. W przypadku tego konkretnego preparatu konieczne byłoby przeprowadzenie testów na transgenicznych gryzoniach. (…) Wyhodowanie adekwatnej ilości zwierząt GMO potrzebnych do badań zajęłoby wiele tygodni. Ze względu na rozwijającą się sytuację pandemiczną stwierdzono, że konieczne jest przyspieszenie prac badawczych, z pominięciem tego etapu”. – Źródło: Mechanizm działania eksperymentalnej szczepionki mRNA-1273, Biotechnologia pl, 17.06.2020 https://biotechnologia.pl/biotechnologia/mechanizm-dzialania-eksperymentalnej-szczepionki-mrna-1273,19826
Szczepionki mRNA na COVID-19
Ponadto szczepionki te zostały opracowane przy użyciu całkowicie nowej technologii jaką jest mRNA, która nigdy nie była licencjonowana do użytku na ludziach. W istocie nie mamy absolutnie żadnej wiedzy, czego możemy się spodziewać po tych nowych szczepionkach mRNA na COVID-19. Ponieważ wirusy często mutują, szansa, że jakakolwiek szczepionka będzie działać dłużej niż rok, jest mało prawdopodobna. Dlatego szczepionka przeciwko grypie zmieniana jest co roku. W tym artykule szczegółowo omówiono aktualne kwestie dotyczące opracowywania, podawania i bezpieczeństwa [głównie] szczepionek mRNA [na COVID-19].
Kwas rybonukleinowy (RNA) to kwas nukleinowy obecny we wszystkich żywych komórkach. Jego główną rolą jest działanie jako posłaniec niosący instrukcje od DNA do kontrolowania syntezy białek. Chociaż w przypadku niektórych wirusów zamiast RNA, to DNA przenosi informację genetyczną. W każdej komórce żywego organizmu DNA jest cząsteczką zawierającą informację genetyczną organizmu. Składa się z szeregu czterech bloków budulcowych, których sekwencja podaje instrukcje do wytwarzania białek. Proces ten wymaga przejściowego pośrednika zwanego matrycowe RNA, które przenosi informację genetyczną do maszynerii komórkowej odpowiedzialnej za syntezę białek. RNA jest jedyną znaną cząsteczką, która rekapituje wszystkie biochemiczne funkcje życia: definiowanie, kontrolę i przekazywanie informacji genetycznej, tworzenie określonych trójwymiarowych struktur, aktywność enzymatyczna i magazynowanie energii.
Zmodyfikowane RNA ma bezpośredni wpływ na DNA
RNA stało się przedmiotem intensywnych badań w medycynie molekularnej na początku XXI wieku. Wirusowe matrycowe RNA (mRNA) jest obecnie wykorzystywane w opracowywaniu szczepionek, jednak stosowanie tej technologii nasuwa wiele pytań i poważnych problemów zdrowotnych, na które producenci szczepionek nie odpowiedzieli. W przeciwieństwie do poprzednich szczepionek, szczepionka mRNA na COVID-19 jest nowym rodzajem szczepionki, która wprowadza fragmenty wirusowego mRNA do ludzkich komórek, które są przeprogramowywane w celu produkcji antygenów patogenów, które następnie, jeśli wszystko pójdzie dobrze, stymulują adaptacyjną odpowiedź immunologiczną przeciwko docelowemu patogenowi. Wydaje się to proste, ale co jeszcze zawierają szczepionki i czy ta nowa technologia jest naprawdę bezpieczna i skuteczna?
Historia badań na zwierzętach ze szczepionką koronawirusową i Poszczepienne Wzmocnienie Infekcji Zależne od Przeciwciał (ADE)
Naukowcy próbowali opracować szczepionkę na koronawirusa od czasu wybuchu epidemii Zespołu Ostrej Ciężkiej Niewydolności Oddechowej (SARS-1) w 2002 roku. Tak więc w ciągu 18 lat przeprowadzono wiele badań nad szczepionką koronawirusową na zwierzętach, podczas których niestety pojawiły się istotne i poważne efekty uboczne. Albo zwierzęta nie były w pełni chronione, albo poważnie zachorowały na przyspieszone dolegliwości autoimmunologiczne, albo zmarły.[1, 2, 3, 4, 5, 6, 7]
Koronawirusy i badania typu „uzyskiwania funkcji” – dr David Martin
Skutki uboczne i zgony zwierząt przypisywano głównie zjawisku zwanemu poszczepiennym wzmocnieniem infekcji zależnym od przeciwciał (ADE). W latach sześćdziesiątych immunolodzy odkryli Wzmocnienie Infekcji Zależne od Przeciwciał (ADE) i od tego czasu intensywnie badali i zidentyfikowali jego mechanizm. Wirusowe Wzmocnienie Infekcji Zależne od Przeciwciał (ADE) to mechanizm biochemiczny, w którym przeciwciała specyficzne dla wirusa (zwykle ze szczepionki) ułatwiają wejście i/lub replikację innego wirusa do białych krwinek, takich jak monocyty, makrofagi czy komórki granulocytów. To następnie moduluje zbyt silną odpowiedź immunologiczną (nienormalnie ją wzmacnia) i wywołuje przewlekłe zapalenie, limfopenię i/lub „burzę cytokin”, z których jedna lub więcej, jak opisano, powoduje ciężką chorobę, a nawet śmierć. Zasadniczo Wzmocnienie Infekcji Zależne od Przeciwciał (ADE) to cykl rozprzestrzeniania się choroby, powodujący, że osoby z wtórną infekcją są bardziej immunologicznie regulowane w górę niż podczas ich pierwszej infekcji (lub wcześniejszego szczepienia) innym szczepem. Wzmocnienie choroby zależne od przeciwciał (ADE) jest zawsze przedmiotem troski przy opracowywaniu szczepionek i terapii przeciwciałami, ponieważ mechanizmy leżące u podstaw ochrony za pomocą przeciwciał przed jakimkolwiek wirusem mają teoretyczny potencjał do wzmacniania infekcji lub wywoływania szkodliwej immunopatologii. [8, 9, 10] Zaobserwowano i opisano mechanizm wzmocnienia infekcji zależnego od przeciwciał (ADE) dla wielu wirusów, w tym koronawirusów.[11, 12, 13] Zasadniczo wykazano, że przeciwciała celują w jeden serotyp [szczep] wirusów, ale tylko subneutralizują inne, prowadząc do wzmocnienia infekcji zależnego od przeciwciał tych ostatnich wirusów na które zostanie wystawiony organizm w przyszłości. W związku z tym wzmocnienie infekcji zależnego od przeciwciał związane z wtargnięciem wirusa jest głównym problemem i przeszkodą w opracowywaniu szczepionek i terapii lekowych opartych na przeciwciałach. Na przykład wykazano, że gdy pacjenci są zakażeni jednym serotypem [szczepem] wirusa dengi (tj. zakażenie pierwotne), wytwarzają przeciwciała neutralizujące skierowane przeciwko temu samemu serotypowi wirusa. Jeśli jednak ci pacjenci zostaną później zakażeni innym serotypem wirusa dengi (tj. zakażenie wtórne), istniejące wcześniej przeciwciała nie mogą w pełni zneutralizować wirusa.
Zamiast tego przeciwciała najpierw wiążą się z wirusem, a następnie wiążą się z receptorami Fc IgG na komórkach odpornościowych i pośredniczą w wnikaniu wirusa do tych komórek.[14] Podobny mechanizm zaobserwowano w przypadku wirusów HIV, Ebola i wirusów grypy. Zatem przeciwciała subneutralizujące (lub w niektórych przypadkach przeciwciała nieneutralizujące) są odpowiedzialne za wzmocnienie infekcji zależne od przeciwciał (ADE) w przypadku tych wirusów.[15, 16, 17, 18, 19, 20]
Ogólnie rzecz biorąc, wnioski niektórych z tych badań były takie, że należy zachować dużą ostrożność podczas przechodzenia do badań na ludziach, przede wszystkim ze względu na możliwość przyspieszonej reakcji autoimmunizacyjnej.
Ponieważ wykazano zjawisko wzmocnienia infekcji zależnej od przeciwciał (ADE) na zwierzętach[21], badania nad szczepionką przeciwko koronawirusowi nigdy nie przeszły do fazy badań na ludziach, przynajmniej do czasu obecnej przyspieszonej kampanii związanej z SARS-Cov-2.
Bardziej techniczne zrozumienie mechanizmów SARS-CoV-2 ADE
Jak wspomniano powyżej, potencjalną barierą w opracowaniu bezpiecznych i skutecznych szczepionek na COVID-19 jest ryzyko, że niewystarczające miana przeciwciał neutralizujących mogą doprowadzić do wzmocnienia choroby zależnej od przeciwciał (ADE). Wcześniejsze badania nad zakażeniem SARS-CoV wykazały, że w wzmocnieniu infekcji zależnej od przeciwciał (ADE) pośredniczy zaangażowanie receptorów Fc (FcR) występujących na różnych komórkach odpornościowych, w tym monocytach, makrofagach i limfocytach B.[22, 23, 24] Receptor Fc to białko występujące na powierzchni niektórych komórek – w tym m.in. limfocyty B, pęcherzykowe komórki dendrytyczne, komórki NK, makrofagi, neutrofile, eozynofile, bazofile, płytki krwi ludzkiej i komórki tuczne – które biorą udział w funkcjach ochronnych układu odpornościowego.
Akiko Iwasaki i współpracownicy opisują ten mechanizm koronawirusowego wzmocnienia infekcji zależnej od przeciwciał (ADE) bardziej szczegółowo w badaniach opublikowanych w 2020 roku w Nature Reviews Immunology.[25] Potwierdzają, że istniejące wcześniej przeciwciała specyficzne dla SARS-CoV mogą w ten sposób promować wnikanie wirusa do komórek posiadających receptor Fc. Proces ten jest niezależny od ekspresji ACE2, endosomalnego pH i proteaz, co sugeruje odrębne szlaki komórkowe wnikania wirusów za pośrednictwem ACE2 i receptora Fc.

Krótko mówiąc, wcześniejsze doświadczenia z weterynaryjnymi szczepionkami na koronawirusa i modelami zwierzęcymi dla zakażenia SARS-CoV i MERS-CoV wzbudziły obawy dotyczące bezpieczeństwa związane z możliwością wystąpienia ADE i/lub związanej ze szczepionką nasilonej choroby układu oddechowego. Zdarzenia te były związane z koronawirusami makrofagowo-tropicznymi podatnymi na zależne od przeciwciał wzmocnieniem replikacji lub z antygenami szczepionkowymi, które indukowały przeciwciała o słabej aktywności neutralizującej i odpowiedziach immunologicznych z przewagą Th2.
Po dwóch dekadach nieudanych badań na zwierzętach pojawia się pytanie, dlaczego szczepionka przeciwko koronawirusowi przepychana przez organy regulacyjne w ekspresowym tempie przyniesie teraz inny wynik? Biorąc pod uwagę fakt, że w wielu z tych przyspieszonych badań pominięto badania na zwierzętach, przeprowadzano je tylko na zdrowych ochotnikach i dzieciach (nie na osobach starszych lub z chorobami współistniejącymi) oraz że część badań jest prowadzona bez obojętnego placebo, i nie trwały wystarczająco dużo czasu na zaobserwowanie skutków w badaniach na ludziach, istnieje poważne zagrożenie bezpieczeństwa. Wielu wirusologów i epidemiologów uważa, że ta przyspieszona polityka jest receptą na masową katastrofę. Mikrobiolog dr Sucharit Bhakdi i dr Karina Reiss w swojej nowej książce „Koronawirus fałszywy alarm? Liczby, konkrety, konteksty” objaśniają wiele problemów związanych z pandemią, oraz obecnymi szczepionkami na koronawirusa.
Szczepionki tradycyjne vs. mRNA
Historycznie rzecz biorąc, proces produkcji szczepionek wiąże się z wieloma tajemnicami handlowymi oraz wieloma innymi składnikami, takimi jak adiuwanty i konserwanty[27,28] „Szczepionki tradycyjne lub klasyczne” mogą zawierać atenuowane lub inaktywowane wirusy i bakterie lub białka, a także adiuwanty, takie jak sole glinu, do stymulowania odpowiedzi immunologicznej, która ma wytwarzać sztuczną odporność, a także wielu innych składników zwanych „substancjami pomocniczymi”. Na przykład starsze szczepionki wirusowe przeciwko ospie i odrze zawierają żywe atenuowane wirusy; szczepionki przeciw grypie do wstrzykiwań zawierają inaktywowane wirusy; rekombinowana szczepionka przeciw wirusowi zapalenia wątroby typu B jest szczepionką podjednostkową białkową, podczas gdy nowsza szczepionka przeciw wirusowi brodawczaka ludzkiego (HPV) zawiera cząsteczki podobne do wirusa.
Obecnie opracowywanych jest kilka różnych typów potencjalnych szczepionek przeciwko COVID-19, w tym:
–Inaktywowane lub osłabione szczepionki wirusowe, które wykorzystują postać wirusa, która została inaktywowana lub osłabiona, ale nadal generuje sztuczną odpowiedź immunologiczną.
— Szczepionki na bazie białka, które wykorzystują fragmenty białek lub osłonki białkowe naśladujące wirusa COVID-19, aby wygenerować sztuczną odpowiedź immunologiczną.
–Szczepionki z wektorami wirusowymi, które wykorzystują wirus, który został zmodyfikowany genetycznie w celu wytworzenia sztucznej odpowiedzi immunologicznej.
— Szczepionki RNA i DNA, które wykorzystują genetycznie zmodyfikowane RNA lub DNA do generowania białka [przez komórki organizmu], które samo wywołuje sztuczną odpowiedź immunologiczną.
Technologie wytwarzania szczepionek
Wirusy w szczepionkach – żywe, atenuowane i inaktywowane
Naukowcy ostrzegają, że niektóre szczepionki przeciwko Covid-19 mogą zwiększać ryzyko infekcji HIV
Przez ostatnie dwie dekady naukowcy eksperymentowali z nowymi platformami technologicznymi, zwłaszcza tymi, które wprowadzają obce DNA i RNA do komórek ciała, aby opracować eksperymentalne szczepionki przeciwko SARS, MERS, HIV i innym chorobom, ale historycznie żadna nie została uznana za skuteczną i bezpieczną dla ludzi.
Tak więc w przypadku tradycyjnej szczepionki antygen jest wprowadzany do organizmu w celu wywołania odpowiedzi immunologicznej. Jednak w przypadku szczepionek opartych na DNA lub RNA nie jest wprowadzany żaden antygen, a jedynie RNA lub DNA zawierające informację genetyczną potrzebną do wytworzenia antygenu. Oznacza to, że w przypadku tej szczególnej klasy szczepionek wprowadzenie DNA i RNA zapewnia organizmowi instrukcje dotyczące produkcji samego antygenu[29].
Szczepionki mRNA na COVID-19 znacznie różnią się pod względem konstrukcji i mechanizmów biochemicznych od tradycyjnych szczepionek. Tradycyjne szczepionki stymulują odpowiedź przeciwciał poprzez wstrzyknięcie człowiekowi antygenów (białek lub peptydów), atenuowanego wirusa lub rekombinowanego wektora wirusowego kodującego antygen. Składniki te są przygotowywane i hodowane poza organizmem człowieka, co wymaga czasu, a nawet po wstrzyknięciu do krwiobiegu nie dostają się do ludzkiej komórki[30].
W przeciwieństwie do tego, szczepionki mRNA wprowadzają syntetycznie utworzony fragment lub wycinek sekwencji RNA wirusa bezpośrednio do ludzkich komórek (tzw. transfekcja). Ten wycinek wirusowego RNA aktywuje następnie enzym zwany odwrotną transkryptazą, który wielokrotnie replikuje wycinek RNA. To następnie przeprogramowuje komórki tak, aby wytwarzały same antygeny wirusowe, które, jeśli wszystko pójdzie zgodnie z planem, będą stymulować adaptacyjną odpowiedź immunologiczną, prowadząc do produkcji nowych przeciwciał, które wiążą się z antygenem i aktywują limfocyty T. [31, 32, 33]
Mówiąc najprościej, nowe szczepionki oparte o mRNA wstrzykują (transfekują) do naszych komórek cząsteczki syntetycznego materiału genetycznego ze źródeł innych niż ludzkie (sekwencje wirusowe). W komórkach materiał genetyczny wchodzi w interakcję z naszym transferowym RNA (tRNA), tworząc obce białko, które rzekomo uczy organizm niszczenia zakodowanego na niego wirusa. Te utworzone białka nie są regulowane przez nasze własne DNA i dlatego są całkowicie obce dla naszych komórek. To, do czego są w pełni zdolni, jest zupełnie nieznane.
Do tej pory szczepionki z matrycowym RNA nigdy nie były licencjonowane do użytku publicznego. W ciągu ostatnich dwóch dziesięcioleci uzyskano znaczne fundusze na rozwój szczepionek mRNA przeciwko chorobom zakaźnym, szczególnie w ramach obecnie ogłoszonej pandemii i przyspieszone kampanii na rzecz szczepionek. Historycznie, ich zastosowanie było do niedawna ograniczone przez niestabilność i nieefektywne dostarczanie mRNA in vivo. Nowe postępy technologiczne w biologii, chemii, stabilności i systemach dostarczania RNA przyspieszyły obecnie opracowywanie w pełni syntetycznych szczepionek mRNA. Konsensus jest taki, że szczepionki mRNA są szybsze i tańsze w produkcji niż tradycyjne szczepionki, a dla producentów szczepionek większa opłacalność oznacza większe zyski. Z pewnością istnieją wyjątkowe i nieznane zagrożenia dla szczepionek z matrycowym RNA, w tym miejscowe i ogólnoustrojowe reakcje zapalne (ADE), które mogą prowadzić do chorób autoimmunologicznych.
Mechanizmy szczepionek mRNA (na COVID-19)
Szczepionki mRNA zawierają nici materiału genetycznego zwanego mRNA wewnątrz specjalnej powłoki. Ta powłoka chroni mRNA przed enzymami w organizmie, które w przeciwnym razie mogłyby go rozłożyć. Powłoka ta pomaga również mRNA dostać się do komórek mięśniowych w pobliżu miejsca szczepienia. Szczepionki mRNA wykorzystują inne podejście, które wykorzystuje proces, którego komórki używają do tworzenia białek: komórki wykorzystują DNA jako szablon do tworzenia cząsteczek matrycowego RNA (mRNA), które są następnie poddawane translacji w celu budowy białek. Szczepionka RNA składa się z nici mRNA, która koduje antygen specyficzny dla choroby. Gdy mRNA znajdzie się w komórce, biologia człowieka przejmuje kontrolę. Rybosomy odczytują kod i budują białko, a komórki wydzielają z siebie białko. Zatem komórki wykorzystują informacje genetyczne do wytwarzania antygenu specyficznego dla choroby. Ten antygen jest następnie prezentowany na powierzchni komórki, gdzie jest rozpoznawany przez układ odpornościowy[34].
Szczepionki mRNA były wcześniej badane pod kątem grypy, wirusa Zika, wścieklizny i wirusa cytomegalii. Koncepcja opracowania szczepionki mRNA jest raczej prosta. Po zidentyfikowaniu wybranego antygenu z docelowego patogenu gen jest sekwencjonowany, syntetyzowany i klonowany do plazmidu szablonu DNA. mRNA jest następnie transkrybowane in vitro i szczepionka jest dostarczana pacjentowi. Szczepionka mRNA wykorzystuje maszynerię komórki gospodarza do translacji in vivo mRNA do odpowiedniego antygenu, naśladując w ten sposób infekcję wirusową, wywołując silną humoralną i komórkową odpowiedź immunologiczną. Ostateczna lokalizacja komórkowa antygenu jest określana przez peptyd sygnałowy i domenę transbłonową. Może to być nierozerwalnie związane z naturalną sekwencją białka lub zmodyfikowane tak, aby skierować białko do pożądanego przedziału komórkowego.[35, 36]
Po wstrzyknięciu wirusowego mRNA do organizmu, reaguje on na odpowiedź immunologiczną zaprogramowaną tak, aby go zniszczyć. Nasze komórki wypracowały skomplikowane mechanizmy obronne, których celem jest niszczenie obcego, niezabezpieczonego lub „nagiego” RNA. Jednak podatność mRNA na degradację można zmniejszyć modyfikując RNA podczas syntezy. Jedną z modyfikacji jest dodanie „analogów nukleozydów”, które przypominają normalne nukleozydy występujące w RNA (A, U, C i G), ale mają niewielkie zmiany strukturalne, które czynią RNA bardziej odpornym na degradację enzymatyczną przez rybonukleazy organizmu. (Nukleozydy są strukturalną podjednostką kwasów nukleinowych, takich jak DNA i RNA.)
Dodatkowe modyfikacje strukturalne i włączenie sekwencji regulatorowych mogą również poprawić stabilność mRNA[37]. Na przykład mRNA wirusa szczepionki jest dostarczane w postaci kompleksu z nanocząsteczkami lipidów, aby ustabilizować mRNA, ułatwiając penetrację komórki, i zwiększyć ilość wytwarzanego antygenu przez komórkę[38]. Formulacje nanocząstek lipidowych również wywołują silniejszą odpowiedź immunologiczną w porównaniu z nagim mRNA[39]. W tym miejscu sytuacja staje się trudniejsza i potencjalnie niebezpieczna, ponieważ niektóre nanocząsteczki lipidowe opracowane dla tych szczepionek mRNA mogą być silnie reaktywne immunologicznie i wywoływać niepożądaną reakcję autoimmunologiczną.
PEG-ylowane nanocząsteczki lipidów
Zatem mRNA jest zagrożone przez szybką degradację przez wszechobecne zewnątrzkomórkowe rybonukleazy, zanim zostanie pobrane przez komórki.[40] Cząsteczka mRNA jest również podatna na zniszczenie w wyniku zmian temperatury, a także naszego układu odpornościowego. Zatem skuteczność szczepionek mRNA wymaga „czynników kompleksujących”, które chronią RNA przed degradacją. Kompleksowanie może również zwiększyć wychwyt przez komórki i/lub polepszyć dostarczanie do mechanizmu translacji w cytoplazmie. W tym celu mRNA często tworzy kompleksy z lipidami lub polimerami. Te szczepionki mRNA są pokryte PEG-ylowanymi nanocząsteczkami lipidowymi (glikol polietylenowy). Ta powłoka ukrywa mRNA przed naszym układem odpornościowym, który normalnie atakowałby, niszczyłby i zabijał wszelkie obce materiały wstrzyknięte do organizmu. PEG-ylowane nanocząsteczki lipidowe są od lat stosowane w kilku różnych lekach. Niestety, wykazano, że PEG-ylowane nanocząsteczki lipidów zaburzają równowagę niektórych odpowiedzi immunologicznych i mogą wywoływać alergie, a nawet choroby autoimmunologiczne.[41, 42, 43, 44, 45, 46]
Badanie z 2016 roku opublikowane w czasopiśmie Analytical Chemistry wykazało wykrywalne, a czasami wysokie poziomy przeciwciał anty-PEG (w tym przeciwciał IgM pierwszej linii obrony i przeciwciał IgG z późniejszego stadium) w około 72% próbek pochodzących od ludzi i około 56% próbek historycznych z lat pomiędzy 1970 a 1990 rokiem. Spośród 72% osób z przeciwciałami na PEG IgG, 8% miało przeciwciała anty-PEG IgG> 500 ng/ml, co jest uważane za bardzo podwyższone.[47] Ekstrapolując te wyniki do populacji USA wynoszącej 330 milionów osób, która może otrzymać tę szczepionkę, to 16,6 miliona osób może mieć poziomy przeciwciał na PEG związane z działaniami niepożądanymi Naukowcy przyznali, że wyniki były całkowicie nieoczekiwane. Autorzy doszli do wniosku, że:
„… czułe wykrywanie i precyzyjne oznaczenie ilościowe poziomów przeciwciał anty-PEG w warunkach klinicznych będzie miało zasadnicze znaczenie dla zapewnienia w przyszłości bezpiecznego stosowania leków PEG-ylowanych we wszystkich docelowych populacjach pacjentów”. – Anal Chem. 2016 Dec 6; 88(23): 11804–11812. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6512330/
W wielu wcześniejszych badaniach dotyczących rozpowszechnienia przeciwciał anty-PEG w populacji stwierdzono, że wstępne badanie przesiewowe należy przeprowadzić przed podaniem jakiegokolwiek leku zawierającego PEG. Badania przesiewowe prawdopodobnie będą jeszcze ważniejsze w przypadku szczepionki przeznaczonej do podawania pozajelitowego możliwie jak największej liczbie ludzi, zawierającej substancję, wobec której większość populacji nieświadomie posiada przeciwciała anty-PEG.
Produkcja szczepionek mRNA
Aby lepiej zrozumieć PEG-ylowane nanocząstki lipidowe i ich rolę w dostarczaniu zawartości szczepionek do komórek, warto nieco lepiej zrozumieć, w jaki sposób wytwarzana jest szczepionka mRNA. Główną zaletą produkcyjną szczepionek mRNA jest to, że RNA można wytwarzać w laboratorium z szablonu DNA przy użyciu łatwo dostępnych materiałów. Przypomne jeszcze raz, że jest to mniej kosztownie i szybsze niż konwencjonalna produkcja szczepionek, które wykorzystują różne typy komórek, takich jak jaja kurze lub inne komórki ssaków, jak np. linie komórkowe powstałe z abortowanych płodów[48]. Wszystko sprowadza się do ekonomii. Tego rodzaju szczepionki są szybsze i tańsze w wykonaniu.
Tradycyjne szczepionki zwykle zawierają silny adiuwant (często sole glinu) dostarczający wzmocnionego sygnału do zainicjowania adaptacyjnej odpowiedzi immunologicznej. Uważa się jednak, że szczepionki mRNA mają swój własny efekt adiuwantowy, częściowo dzięki temu, że są obcymi kwasami nukleinowymi. Nie ujawniono, czy którykolwiek z tych kandydatów (jakiejkolwiek firmy) ma dodany adiuwant. (Więcej informacji na temat adiuwantów w dalszej części tego artykułu).
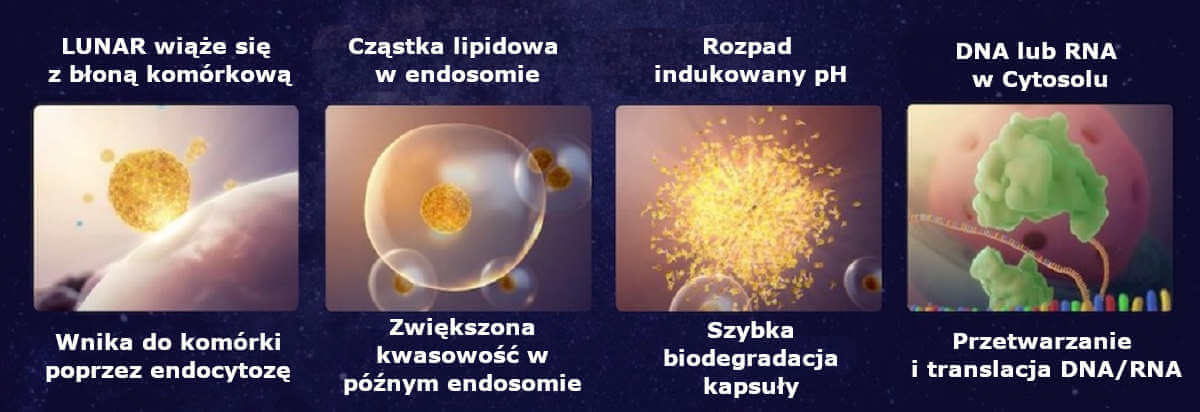
Co więcej, według Arcturus, firmy produkującej system dostarczania lipidów dla Pfizer/BioNTech, [technologia ta] obejmuje wieloskładnikowy system dostarczania zwany LUNAR® (modyfikowane RNA aktywowane lipidami z odblokowanym nukleomonomerem). „Ten system ma dostęp do ponad 150 zastrzeżonych lipidów, które zostały wykorzystane w szczepionkach COVID-19 opartych na mRNA”[49]. Zasadniczo wiemy tylko, że dotyczy to zastrzeżonych PEG-ylowanych nanocząsteczek lipidowych.
Obecne szczepionki mRNA i potencjalne skutki uboczne
Według WHO i Milken Institute, w sierpniu 2020 roku nad szczepionkami na koronawirusa pracowały 202 firmy i uniwersytety na całym świecie. Typy szczepionek są różnorodne, od tradycyjnych szczepionek (np. Inaktywowane i żywe atenuowane), przez szczepionki, które dopiero niedawno uzyskały aprobatę kliniczną (np. podjednostkowe), do tych, które do tej pory nigdy nie były licencjonowane do stosowania u ludzi (np. mRNA, DNA , niereplikujący się wektor wirusowy, replikujący wektor wirusowy). Uderzającą cechą krajobrazu rozwoju szczepionek przeciwko SARS-CoV-2 jest zakres ocenianych platform technologicznych, w tym kwas nukleinowy (DNA i RNA), cząstka wirusopodobna, peptyd, wektor wirusowy (replikujący i niereplikujący), białko rekombinowane, żywe atenuowane wirusy i inaktywowane wirusy. Po 9 listopada firma Moderna, gigant farmaceutyczny Pfizer i jego niemiecki współpracownik BioNTech oraz Rosyjski Instytut przedstawiły „wstępne dowody na to, że ich szczepionki oparte na białku kolcowym mRNA mogą osiągnąć ponad 90% skuteczność ochronną”.
Badania kliniczne szczepionek na Covid-19 pokazują, że protokoły opracowane są tak, żeby zakończyły się sukcesem. – prof. William A. Haseltine
Jak skuteczna jest szczepionka na COVID-19?
Peter Doshi: Szczepionki w 95% skuteczne? Potrzebujemy więcej szczegółów i surowych danych od firm Pfizer i Moderna
Przemysł farmaceutyczny twierdzi, że szczepionka na bazie mRNA jest „bezpieczniejsza dla pacjenta” niż szczepionki klasyczne. Ale czy to twierdzenie zostało potwierdzone? Producent zakłada, że mRNA jest niezakaźną, nieintegrującą platformą, nie ma potencjalnego ryzyka infekcji lub mutagenezy insercyjnej. Ponieważ szczepionki mRNA nigdy nie były licencjonowane i nie przeszły długoterminowych testów, nie możemy tego wiedzieć na pewno. Ponadto istnieje również obawa, że te mRNA zawarte w szczepionce mogą mieć długotrwałe tragiczne konsekwencje dla odporności organizmu, płodności i integralności DNA.
Zmodyfikowane RNA ma bezpośredni wpływ na DNA
Potencjalne problemy autoimmunologiczne szczepionek na Covid-19
Według naukowców z University of Pennsylvania i Duke University[50], szczepionki mRNA mają następujące potencjalne problemy z bezpieczeństwem:
–Zapalenie miejscowe i ogólnoustrojowe.
–Biodystrybucja i trwałość wydalanego immunogenu.
–Stymulacja przeciwciał autoreaktywnych.
–Indukcja silnej odpowiedzi interferonu typu 1, która jest związana ze stanem zapalnym i potencjalną autoimmunizacją. W związku z tym należy zidentyfikować osoby ze zwiększonym ryzykiem reakcji autoimmunologicznych przed szczepieniem szczepionką mRNA.
–Obecność zewnątrzkomórkowego RNA, który może przyczyniać się do powstawania obrzęków i patogennego tworzenia się skrzepów (skrzepy krwi). Wykazano, że zewnątrzkomórkowe nagie RNA zwiększa przepuszczalność ściśle upakowanych komórek śródbłonka i może w ten sposób przyczyniać się do obrzęku.[51] Inne badanie wykazało, że zewnątrzkomórkowe RNA sprzyja krzepnięciu krwi i patologicznemu tworzeniu się skrzepliny[52].
–Potencjalne skutki toksyczne wszelkich obcych nukleotydów i składników układu dostarczania (szczególnie tych, które nie zostały ujawnione przez producentów).
Istnieje również obawa o potencjalne modyfikacje mRNA w genetyce organizmu. Po wstrzyknięciu do organizmu szczepionki mRNA, RNA z wirusa przenosi się do komórki, gdzie może on powodować niepożądane szkodliwe modyfikacje genetyczne. W ciągu ostatnich pięciu lat nastąpił ogromny wzrost liczby badań nad modyfikacjami RNA; ta dziedzina nazywa się epitranskryptomiką. Rola modyfikacji DNA w regulacji genów jest dobrze znana, ale znacznie mniej wiadomo na temat tego, jak modyfikacja mRNA wpływa na sposób ekspresji genów. W rzeczywistości liczne badania wykazały, że wirusowe mRNA odgrywają rolę kierowcy w niektórych formach raka i chorób autoimmunologicznych.[53, 54, 55, 56]
Dlatego też długoterminowa ocena bezpieczeństwa jest niezbędna i powinna poprzedzać licencjonowanie różnych modalności i systemów dostarczania mRNA. Zwykle opracowywanie szczepionek jest długim i skomplikowanym procesem, często trwającym 10-15 lat i obejmującym połączenie zaangażowania publicznego i prywatnego. Niestety, rozbujana konkurencja na poziomie globalnym między firmami farmaceutycznymi w celu opracowania szczepionki COVID-19 ominęła wiele kontroli bezpieczeństwa, co sprawia, że wynik jest zarówno wątpliwy, jak i potencjalnie niebezpieczny dla społeczeństwa. Interesy finansowe mają pierwszeństwo przed zdrowiem i bezpieczeństwem publicznym. Pośpieszne opracowywanie szczepionek jest zawsze ryzykowne i tylko dokładne badania uwzględniające wszystkie środki ostrożności doprowadzą do bezpiecznej i skutecznej szczepionki.
Obecnie licencjonowane szczepionki na COVID-19 do czasu opublikowania tego artykułu nie były oferowane kobietom w ciąży. Dzieje się tak, ponieważ naukowcy nie wiedzą wystarczająco dużo o tym, jak szczepienie na COVID-19 może wpłynąć na dzieci, kobiety w ciąży lub ich potomstwo. Brak jest również danych dotyczących bezpieczeństwa szczepionek przeciw COVID-19 dla kobiet karmiących piersią. Szczepionka Pfizer/BioNTech nie jest dostępna dla dzieci poniżej 16 roku życia.
Składniki i dawkowanie szczepionek Moderna i Pfizer
Choć brzmi to niewiarygodnie, ani firma Pfizer/BioNTech, ani Moderna nie ujawniły „całkowicie” wszystkiego w swoich szczepionkach. Najwyraźniej, aby uzyskać licencję w amerykańskiej Agencji ds. Żywności i Leków [FDA], nie muszą ujawniać opinii publicznej całego składu swojej szczepionki. Oto, co wiemy. Zarówno szczepionki Moderna, jak i Pfizer/BioNTech są szczepionkami mRNA i różnią się składem, sposobem dostarczania i przechowywaniem. Mają różne analogi nukleozydów, a każda z nich ma unikalne sposoby, aby zasadniczo osłabić zdolność informacyjnego/matrycowego RNA do indukowania wrodzonej odporności. Każda z nich ma inny złożony system dostarczania płynów i jest to jeden z powodów, dla którego jedna znacznie bardziej nadaje się do transportowania i przechowywania w temperaturze minus 20ºC, podczas gdy druga wymaga transportowania i przechowywania w temperaturze minus 70ºC.
Szczepionka firmy Moderna zawiera 100 mikrogramów RNA na dawkę, podczas gdy szczepionka Pfizer-BioNTech wykorzystuje tylko 30 mikrogramów. Zarówno w szczepionkach Moderna, jak i Pfizer-BioNTech mRNA jest zamknięty w nanocząstkach lipidowych (LPN). Te mikroskopijne kropelki oleistej cieczy – o średnicy około 0,1 mikrona – otaczają i chronią mRNA podczas ich produkcji, transportu i wstrzykiwania ludziom. Jak wcześniej wspomniano, skład nanocząstek lipidowych jest różny w obu szczepionkach.
Pfizer/BioNTech pozyskuje nanocząsteczki od wyspecjalizowanej kanadyjskiej firmy Acuitas, natomiast Moderna opracowała własną technologię lipidową.
Wymienione składniki szczepionki Pfizer/BioNTech COVID-19 obejmują:
–30 mcg informacyjnego/matrycowego RNA zmodyfikowanego nukleozydem (modRNA) kodującego glikoproteinę kolcową (S) wirusa SARS-CoV-2
-lipidy (0,43 mg (4-hydroksybutylo)azanediyl)bis(heksano-6,1-diyl)bis(2-dekanian heksylu)
-0,05 mg 2-[(glikol polietylenowy)-2000]-N,N-ditetradecyloacetamid
-0,09 mg 1,2-distearoilo-sn-glicero-3-fosfocholina (DSPC),
-0,2 mg cholesterolu
-.01 chlorek potasu
-0,01 mg fosforan monopotasowy
-0,36 mg sodu chlorek
-0,07 mg disodu fosforan dwuwodny
-6 mg sacharoza
– rozcieńczalnik (0,09 procent roztworu chlorku sodu do wstrzyknięć) zapewnia dodatkowe 2,16 mg chlorku sodu na dawkę
Do tej pory ujawniono w domenie publicznej, że szczepionka Moderna (mRNA-1273) na COVID-19 w szczególności zawiera nanocząsteczki lipidowe zawierające mRNA, który koduje stabilizowane przed fuzją białko kolcowe SARS-Cov-2. Szczepionka mRNA-1273 składa się z mRNA, który jest wytwarzany w postaci nanocząstek lipidowych składających się z zastrzeżonego jonizowalnego lipidu,, SM-102 i 3 dostępnych w handlu lipidów, cholesterolu, DSPC (1,2-distearoilo-sn-glicero-3-fosfocholina, jest to fosfatydylocholina z łańcuchem alkilowym zawierającym 18 atomów węgla) i PEG2000 DMG (1,2-dimirystoilo-rac-glicero-3-metoksypolietylenoglikol-2000). Adiuwanty i inne biotechnologie, jeśli zostały dodane, nie zostały ujawnione publicznie. Ta szczepionka wymaga dwóch wstrzyknięć w odstępie 28 dni.
Więcej informacji na temat badań klinicznych wszystkich opracowywanych szczepionek koronawirusowych można znaleźć w Regulatory Affairs Professionals Society (RAPS)[58].
Wydalanie/rozsiewanie wirusa po podaniu szczepionk mRNA oraz poszczepienna interferencja wirusowa
Poszczepienne wydalanie/rozsiewanie to termin używany do określenia uwolnienia wirusa po podaniu szczepionki zawierającej żywe wirusy. Było to szczególnie widoczne w przypadku podawania żywych szczepionek przeciwko polio. Żadna ze szczepionek w dystrybucji ani w opracowaniu nie wykorzystuje żywego wirusa powodującego COVID-19. Tak więc obecny konsensus wśród twórców szczepionek jest taki, że nie oczekuje się poszczepiennego wydalania wirusa ze szczepionek w przypadku szczepionek mRNA. Należy jednak pamiętać, że szczepionki przeciw wirusowe typu mRNA to nowa platforma, więc ten problem obecnie jest nieznany.
Interferencja wirusowa to sytuacja, w której zakażenie lub szczepienie szczepionką jednym wirusem ogranicza zakażenie i replikację drugiego wirusa. Na przykład badania epidemiologiczne pokazują, że po zakażeniu wirusem grypy występuje krótki okres, w którym żywiciel jest mniej podatny na zakażenie innymi podobnymi wirusami. Wydaje się, że ta interferencja wirusowa jest niezależna od jakichkolwiek podobieństw antygenowych między wirusami. Z pewnością jest możliwe, że szczepionka mRNA może wywołać poszczepienną interferencje wirusową i spowodować, że ludzie będą bardziej podatni na inne wirusy, takie jak grypa.
Szczepienie przeciw grypie i koronawirus SARS-CoV-2
Niespecyficzne skutki szczepień cz.1 – dr Suzanne Humphries
Niespecyficzne skutki szczepień cz.2 – dr Suzanne Humphries
Jak działają szczepionki? W dużej mierze nie mamy pojęcia. – Dr Peter Aaby
Białko kolcowe SARS-CoV-2 ma wspólną sekwencję z ludzkim białkiem Syncytyna-1
Syncytyna-1 to białko, które bierze udział w rozwoju łożyska i dlatego jest niezbędne dla płodności. Piętnaście lat temu zaproponowano, że można opracować syntetyczną szczepionkę z Syncytyną-1 jako środek antykoncepcyjny, który będzie działał w celu wytwarzania przeciwciał przeciwko ludzkiej Syncytynie-1[59].
Niektórzy lekarze sugerują, że szczepionka Pfizera na COVID może wywołać odpowiedź przeciwciał przeciwko Syncytynie-1 i powodować bezpłodność z powodu, podobnej lub wspólnej sekwencji aminokwasów w białku kolcowym SARS-CoV-2 i białku łożyskowym Syncytyna-1. Weryfikatorzy faktów sponsorowani pośrednio lub bezpośrednio instytucje związane z farmaceutykami, oraz wirusolodzy opłacani przez firmę Pfizer szybko odrzucili taki pomysł jako „mało prawdopodobny”. Twierdzą, że ta sekwencja aminokwasów w szczepionce jest zbyt krótka, aby układ odpornościowy mógł w znaczący sposób pomylić ją z tym ważnym białkiem łożyskowym. Jednak mało prawdopodobne, jeśli później okaże się to prawdą w przypadku niektórych podatnych kobiet, może to spowodować niepłodność o nieokreślonym czasie trwania. Weź pod uwagę, że konsensus naukowy nie daje stuprocentowej pewności, że te podobne sekwencje aminokwasów spowodują produkcję przeciwciał przeciwko Syncytynie-1. Rola białek retrowirusowych, zwłaszcza syncytyn, w procesie fuzji trofoblastycznej i morfogenezie łożyska została zidentyfikowana i wysunięta jako hipoteza dopiero około 20 lat temu[60]. Wciąż wiele pozostaje do nauczenia się i nadal dużo nie wiemy o podobnych sekwencjach aminokwasów i ich wpływie na fizjologię człowieka. W związku z tym kwestia ta wymaga dalszych badań i do tego czasu powinniśmy postępować ostrożnie i zakładać, że może to spowodować szkody na poziomie populacji.
Adiuwanty
Adiuwanty to immunostymulujące cząsteczki podawane razem ze szczepionką w celu wzmocnienia odpowiedzi immunologicznej, głównie poprzez aktywację dodatkowych receptorów molekularnych, które głównie rozpoznają patogeny lub sygnały zagrożenia. Szlaki te funkcjonują głównie w obrębie wrodzonego układu odpornościowego. Każdy adiuwant ma ogólnie inny zakres stymulacji tych receptorów od wykrywania zagrożenia lub niebezpieczeństwa. Chociaż celem szczepionki jest stymulowanie rozpoznawania i odpowiedzi przez limfocyty, a nie komórki odporności wrodzonej, aktywacja komórek wrodzonej odporności jest wymagana do aktywacji limfocytów w celu uzyskania odpowiedzi zarówno limfocytów B, jak i T. Wiele adiuwantów zawiodło wcześniej w warunkach klinicznych z powodu problemów z toksycznością. Te chemikalia mogą mieć szeroki zakres składów, w tym lipidy, białka, kwasy nukleinowe, a nawet materiały nieorganiczne, takie jak sole glinu. Łączy je to, że hiper-stymulują receptory w komórkach odpornościowych, a większość z nich czyni to poprzez toksyczność komórkową.
Słowa Alergia i Anafilaksja zostały utworzone, aby opisać szkody po szczepionkach
Aluminium jest stosowane do tworzenia alergii na modelach zwierzęcych
Pfizer/BioNTech i Moderna nie wspominają wyraźnie o zastosowaniu adiuwanta w swoich szczepionkach, ale RNA sam z siebie zawiera właściwości immunostymulujące, a jego obecność stanowi sygnał dla receptorów rozpoznających patogen. Okaże się z czasem, czy immunostymulacja z RNA jest wystarczająco silna, aby zapewnić pełną ochronę przed SARS-CoV-2. Istnieje również możliwość, że nośniki nanocząstek lipidowych, które wykorzystują w szczepionkach, same posiadają właściwości adiuwantowe. Lub też mogą wywołać niepożądaną reakcję autoimmunologiczną.
Nie wiadomo, czy jakiekolwiek przyszłe licencjonowane szczepionki mRNA na COVID-19 będą zawierały sole glinu lub coś innego jako adiuwant, tak jak jest to powszechnie stosowane w innych szczepionkach wirusowych. Pomimo prawie 90 lat powszechnego stosowania adiuwantów glinu, wiedza medyczna na temat mechanizmów ich działania jest nadal niezwykle słaba. Niepokojący jest również brak danych dotyczących toksykologii i farmakokinetyki tych związków.
Wytyczne Dotyczące Przedklinicznych Badań Farmakologicznych i Toksykologicznych Szczepionek – EMA
„Bezpieczny” poziom glinu/aluminium opiera się na przestarzałych informacjach, nieuzasadnionych założeniach i błędach – dr James Lyons-Weiler
Mimo to fałszywy pogląd, że sole glinu zawarte w szczepionkach są bezpieczne, wydaje się być powszechnie akceptowany. Badania eksperymentalne wyraźnie pokazują, że adiuwanty glinowe mogą wywoływać poważne zaburzenia immunologiczne u ludzi. Glin w postaci adiuwanta niesie ryzyko autoimmunizacji, długotrwałego zapalenia mózgu i powiązanych powikłań neurologicznych, a zatem może spowodować poważne i rozległe niekorzystne konsekwencje zdrowotne[61].
Stabilność i przechowywanie
Te szczepionki mRNA wymagają przechowywania w niskiej temperaturze, aby utrzymać nanocząstki [w postaci nanocząsteczek] i powstrzymać degradację mRNA. Szczepionka Pfizer/BioNTech (BNT162b2) ma być przechowywana w temperaturze -70 stopni Celsjusza i będzie nadawać się do użycia tylko przez 24 godziny w temperaturach chłodniczych między 1.6° a 7.7° Celsjusza. Zostanie wysłana w suchym lodzie (–80°C). Szczepionka firmy Moderna (mRNA-1273) musi być przechowywana w temperaturze -20°C i wysyłana w tej temperaturze -20 °C w opakowaniach żelowych[62].
Zatem utrzymanie tej stałej niskiej temperatury jest główną przeszkodą we wdrażaniu kampanii marketingowej szczepionek, w szczególności szczepionki Pfizer/BioNTech. Biorąc pod uwagę te ograniczenia, analitycy argumentowali, że szczepionka firmy Pfizer może być stosowana tylko w niektórych szpitalach i klinikach z odpowiednim sprzętem i wymagałaby intensywnych jednodniowych szczepień w takich miejscach, które obejmowałyby ułamek zdrowej populacji. Nie tylko większość miejsc szczepień nie spełnia takich wymagań dotyczących zamrażania, ale również firmy żeglugowe nie są obecnie w stanie wysyłać masowych ilości ultrazimnych szczepionek. Pfizer nawiązał współpracę z UPS w celu opracowania ultrazimnych pojemników transportowych, które mogą pomieścić szczepionkę w wymaganej temperaturze. Opakowania wykorzystują odporne na zimno szklane fiolki do przechowywania szczepionki oraz suchy lód w celu utrzymania niskich temperatur. Chociaż może się to wydawać zrównoważonym rozwiązaniem, w USA występuje obecnie niedobór zarówno suchego lodu (ze względu na niedobór CO2), jak i szkła odpornego na zimno.[63]. Transport masowy przy użyciu tych kontenerów spowodowałby ogromne obciążenie łańcucha dostaw i prawdopodobnie wymagałoby inwestycji rzędu miliardów dolarów[64].
Wdrożenie szczepień
Pfizer-BioNTech poinformował, że będzie w stanie dostarczyć 50 milionów dawek do końca 2020 roku i około 1,3 miliarda do końca 2021 roku. Moderna poinformowała, że jeśli uzyska licencję, zamierza dostarczyć rządowi Stanów Zjednoczonych 20 milionów dawek do końca 2020 roku i wyprodukuje od 500 milionów do miliarda dawek w 2021 roku. Obecnie opracowywanych jest ponad 320 kandydatów na szczepionki przeciw Covid-19. Kilka z nich, w tym szczepionka Oxford/AstraZeneca, wychodzi z badań fazy III, więc wkrótce możemy spodziewać się kolejnych takich ogłoszeń w tym temacie.
Brak odpowiedzialności wynikający z ustawy PREP Act
Wraz z nadchodzącymi szczepionkami na SARS-Cov-2 przemysł szczepionkowy jest całkowicie wolny od odpowiedzialności (nie ponosi odpowiedzialności prawnej). Rządowa gwarancja braku odpowiedzialności za szczepionki producentów aktualnie wdrażanych szczepionek mRNA lub wszelkich przyszłych szczepionek wprowadzanych w trybie przyspieszonym, została wydana przez Urząd ds. Autoryzacji w Sytuacjach Wyjątkowych (EUA Authority), który wywodzi się z projektu Bioshield Project [Projekt Tarcza Biologiczna]. Ustawa ‘Bioshield Act’ była ustawą uchwaloną przez Kongres Stanów Zjednoczonych w 2004 roku, w której wzywano do 5 miliardów dolarów na zakup szczepionek, które zostaną użyte w przypadku ataku bioterrorystycznego. Zostało to następnie zdefiniowane w Ustawie o Gotowości i Przygotowaniu na Wypadek Sytuacji Kryzysowych („PREP Act”) z 2005 r., która dodatkowo wyklucza odpowiedzialność producentów szczepionek, opisaną wcześniej w Programie Odszkodowań z 1986 r. za szczepionki dziecięce.
Transkrypt filmu pt. Ustawa z 1986 roku
Deklaracja Departamentu Zdrowia i Opieki Społecznej w ramach ustawy PREP o zapewnieniu immunitetu za działania związane z medycznymi środkami zaradczymi przeciwko COVID-19
10 marca 2020 roku Sekretarz powołał się na ustawę PREP i stwierdził, że COVID-19 stanowi stan zagrożenia zdrowia publicznego. W związku z tym deklaracja HHS na podstawie ustawy PREP do zwolnienia z odpowiedzialności za „produkcję, testowanie, rozwój, dystrybucje, podawanie i stosowanie” objętych ochroną środków zaradczych. Nowelizacja ustawy PREP, której dokonano w kwietniu[65], stanowi, że firmy „nie mogą być pozywane do sądu o odszkodowanie pieniężne” w związku z urazami spowodowanymi przez środki medyczne przeciwko Covid-19. Takie środki zaradcze obejmują szczepionki, środki lecznicze i urządzenia oddechowe. Jedynym wyjątkiem od tego immunitetu jest sytuacja, gdy śmierć lub poważne obrażenia ciała są spowodowane „umyślnym działaniem”. Nawet wtedy osoby poszkodowane będą musiały spełniać zaostrzone standardy „umyślnego wykroczenia”, które są korzystne dla oskarżonych[66].
Cicha Pandemia: Błędy medyczne zabiją dużo więcej Amerykanów niż COVID-19. – dr Matthew Young
Pielęgniarka z epicentrum. Rozmowa z Erin Marie Olszewski.
Podczas gdy ludzie poszkodowani przez szczepionki na inne choroby mogą wnosić roszczenia do Narodowego Programu Odszkodowań za Obrażenia Poszczepienne, który został ustanowiony w 1986 r., to ustawa PREP zabrania korzystania z tego programu teraz każdemu, kto czuje się skrzywdzony przez szczepionkę przeciwko koronawirusowi.
Ustawa PREP daje producentom szczepionek nieograniczoną swobodę tworzenia, opracowywania i wprowadzania na rynek szczepionek bez jakiejkolwiek odpowiedzialności. Producentom pozwolono ominąć badania na zwierzętach i przejść bezpośrednio do badań na ludziach. Mogą również dodać wszystko, co uznają za ważne, do wybranej przez siebie formuły szczepionki – niezależnie od tego, czy będzie to znana toksyna, czy substancja kancerogenna. Wszelka odpowiedzialność jest chroniona ustawą PREP, co oznacza, że jeśli ktoś doświadczy efektów ubocznych lub nawet śmierci spowodowanej tą szczepionką, naprawdę nie ma prawnej możliwości, aby coś z tym zrobić. Zostało to wpisane do Rejestru Federalnego w marcu 2020 roku i wygaśnie pod koniec 2024 roku.
Tak więc wszystko, co zostanie opracowane w ciągu najbliższych czterech lat, a dotyczy czynnika biologicznego, czy to będzie szczepionka, lek lub biotechnologia, bez względu na to jak nikczemne to będzie, będzie to chronione przed odpowiedzialnością w ramach parasola o nazwie COVID-19.
Wniosek
Świat, popychany przez media będące w kieszeni przemysłu farmaceutycznego, domaga się bezpiecznej i skutecznej szczepionki przeciwko COVID-19. Wiele laboratoriów i firm starało się szybko opracować te szczepionki, co zaowocowało ponad 200 kandydatami na szczepionki. Bez rzetelnego przeprowadzenia i kontynuowania badań na zwierzętach, wiele z tych firm przeszło do badań klinicznych I, II i III fazy na ludziach w krótkim okresie 6 miesięcy. „Szczepionki” firmy Pfizer/BioNTech i Moderna szybko przeszły przez testy na ludziach, nie dając czasu na właściwą ocenę wcześniejszych faz. Nie zostały zatwierdzone ani licencjonowane w normalnym trybie przez Amerykańską Agencję ds. Żywności i Leków (FDA), ale zamiast tego otrzymały zezwolenie FDA na użycie w nagłych wypadkach na podstawie zezwolenia na użycie w nagłych wypadkach (EUA) do stosowania u osób w wieku 16 lat i starszych i są obecnie podawane milionom ludzi.
Czego nie wiemy o szczepionce na COVID-19 [FDA -17 grudnia 2020]
Potencjalne niebezpieczeństwa wynikają z powodu przyspieszonego procesu, który ogranicza czas niezbędny do badań na dużą skalę. Dzięki przyspieszonemu procesowi rozwoju, wstępne dane z trwających badań klinicznych i przedklinicznych szczepionek są publikowane niemal w czasie rzeczywistym [przeważnie w oświadczeniach]. W rezultacie kluczowe informacje o trwałości i jakości poszczepiennej odporności [przeciwciał] indukowane szczepionką są niedostępne. Przyspieszona procedura zatwierdzania prowadzi firmy do wrzucenia szczepionki na rynek, zanim wyniki szeroko zakrojonego badania wykażą bezpieczeństwo i skuteczność szczepionki. Naukowcy i epidemiolodzy stanowczo potwierdzają, że głównym celem badań nad szczepionkami jest udowodnienie, że są one bezpieczne dla dużej populacji lub grupy, zanim zostaną wprowadzone na rynek. Badania kliniczne powinny oferować przejrzyste zbiory danych przed udostępnieniem szczepionki na masową skalę klientom (milionom, jeśli nie miliardom ludzi). Bez przejrzystych, sprawdzonych w dłuższym okresie zbiorów danych dotyczących dużej populacji nie można zapewnić, że szczepionka jest bezpieczna dla większości ludzi w kraju.
Pfizer opublikował w czasopiśmie New England Journal of Medicine recenzowane badanie zatytułowane Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine[67].
W badaniach szczepionek Pfizer/BioNTech COVID-19 przeprowadzonych w Stanach Zjednoczonych odnotowano więcej reakcji alergicznych w grupie zaszczepionej niż w grupie kontrolnej placebo[68]. Chociaż reakcje alergiczne wystąpiły u mniej niż jednego procenta osób otrzymujących szczepionkę COVID, należy zauważyć, że osoby z „historią ciężkich działań niepożądanych związanych ze szczepionką i/lub ciężka reakcja alergiczna (np. anafilaksja) na którykolwiek składnik interwencji w ramach badania” zostały wykluczone z badań klinicznych firmy Pfizer[69,70].
Dalsze długotrwałe badania kliniczne i odpowiednie testy mogą również zidentyfikować kolejne schorzenia lub alergie u osób, które mogą nie kwalifikować się do przyjęcia szczepionki. Dzięki przyspieszonej procedurze wprowadzenia szczepionki na rynek, prawdopodobieństwo wystąpienia szkód spowodowanych reakcjami alergicznymi, reakcjami autoimmunologicznymi, powikłaniami u osób z już istniejącymi problemami zdrowotnymi, interakcjami z niektórymi lekami lub innymi pokrewnymi problemami może wzrosnąć w porównaniu z sytuacją gdy przeprowadzono badania o dłuższych ramach czasowych. Krótko mówiąc, badania kliniczne muszą udowodnić, że szczepionka jest bezpieczna, co w przypadku szczepienia zwykle wymaga lat, a nie miesięcy.
Liczby wskazują, że śmiertelność z powodu COVID powróciła do normalnego wskaźnika śmiertelności grypy na początku września 2020 roku. Wielu naukowców uważa obecnie, że pandemia koronawirusa się skończyła. Dlatego szczepionka nie jest już potrzebna; jest więc całkowicie niepotrzebna i wiąże się z potencjalnym niebezpieczeństwem. Być może najsmutniejszą częścią tego ogólnoświatowego pośpiechu w kierunku szczepionek jest obserwowanie, jak mało wiary ludzie mają we własny układ odpornościowy. W jakiś sposób moce, którym nie powinno się to udać, przekonały większość ludzi, że nasz układ odpornościowy jest tylko teorią spiskową i zamiast wzmacniać naszą wrodzoną zdolność do leczenia i regeneracji naszych ciał, powinniśmy oddać naszą wiarę w ręce korporacji farmaceutycznych, które zarabiają na chorobach.
Wall Street chce najlepszych patentów, a nie najlepszych leków – Joe Nocera
Dyrektor firmy farmaceutycznej: „Zarabiamy dla akcjonariuszy, a nie pomagamy chorym.” – Ron Delancer
Kiedy zatrzymamy się na chwilę, aby zachwycić się zdolnością własnej skóry do wygojenia rany lub kości do samoistnego wyzdrowienia, zdamy sobie sprawę, że nasze ciała posiadają własną bioregulacyjną inteligencję. Ta organiczna, żywa inteligencja jest daleko poza możliwościami jakiejkolwiek nanotechnologii lub syntetycznych mikstur stworzonych w laboratorium, które jedynie próbują naśladować naturę i jej wspaniały projekt.
Zarazkowa teoria Pasteura vs Komórkowa teoria Béchampa – Walene James
Nasz układ odpornościowy i zdrowe biologiczne środowisko są naszą najlepszą obroną przed patogenami i istnieje kilka sprawdzonych sposobów utrzymania go w dobrej formie. Minerał cynk jest ważny dla wielu enzymów immunologicznych i może być przyjmowany codziennie.
Wykazano, że poziom witaminy D3 jest niski lub bardzo niski u osób, u których rozwinęła się poważna infekcja z związana z koronawirusem. Dlatego przyjmowanie witaminy D3 jest działaniem zapobiegawczym i może być przyjmowana codziennie, aby utrzymać jej terapeutyczny poziom w organizmie. Skuteczność witaminy C w ochronie przed infekcjami [i/lub lżejszym przechodzeniem infekcji] również została szeroko udokumentowana. Świeże powietrze i światło słoneczne, bycie aktywnym i dobrze nawodnionym oraz cieszenie się radosnymi zajęciami towarzyskimi są pomocne w utrzymaniu dobrego samopoczucia.
Na koniec, szczepionki mRNA nigdy wcześniej nie były licencjonowane, a teraz są [na wariackich papierach] podawane milionom ludzi bez odpowiedzialności ze strony producenta. Społeczeńśtwo stało się poligonem doświadczalnym dla tej nowej technologii. Jeśli te szczepionki mRNA na koronawirusa później okażą się szkodliwe dla wrażliwych struktur genetycznych komórek, nie będzie można tego cofnąć. Zasadniczo potrzebujemy znacznie lepszego zrozumienia ich potencjalnych skutków ubocznych i większej ilości dowodów na ich długoterminową skuteczność. Opracowanie szczepionki wymaga czasu, ponieważ należy udowodnić, że szczepionki nie tylko zapewniają ochronę, ale także są bezpieczne. W przeciwieństwie do innych leków, które są dostarczane chorym pacjentom, szczepionki są podawane zdrowym pacjentom i dlatego wymagają bardzo wysokiego marginesu bezpieczeństwa. Wciąż istnieje wiele badań, które należało przeprowadzić w zakresie bezpieczeństwa, zanim szczepionki mRNA na COVID-19 zostaną wprowadzone do powszechnego użytku. Niestety, tak się nie dzieje obecnie, a co za tym idzie, może to przekształcić się w katastrofę na masową skalę.
Uwaga:
Ludzie zajmujący się szczepieniem mają zgłaszać do Rządowego Systemu Zgłaszania Odczynów Poszczepiennych [VAERS] zdarzenia niepożądane, które występują po szczepieniach. Jednak osoby zaszczepione, które doświadczyły takiego niepożądanego odczynu poszczepiennego lub członek rodziny również mogą złożyć takie zgłoszenie, jeśli pracownik służby zdrowia tego nie zrobi.
W USA rejestruje się mniej niż 1% NOPów – Harvard Pilgrim Health Care
Według jednego z badań finansowanych przez rząd w 2011 roku, mniej niż jeden procent wszystkich reakcji na szczepionki jest zgłaszanych VAERS.
Źródło: COVID-19 mRNA Vaccines
Przypisy:
1. Takano, Tomomi, Shinji Yamada, Tomoyoshi Doki, and Tsutomu Hohdatsu. „Pathogenesis of oral type I feline infectious peritonitis virus (FIPV) infection: Antibody-dependent enhancement infection of cats with type I FIPV via the oral route.” Journal of Veterinary Medical Science (2019): 18-0702. https://www.jstage.jst.go.jp/article/jvms/advpub/0/advpub_18-0702/_pdf
2. Czub, Markus, Hana Weingartl, Stefanie Czub, Runtao He, and Jingxin Cao. „Evaluation of modified vaccinia virus Ankara based recombinant SARS vaccine in ferrets.” Vaccine 23, no. 17-18 (2005): 2273-2279. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7115540/
3. Fett, Craig, Marta L. DeDiego, Jose A. Regla-Nava, Luis Enjuanes, and Stanley Perlman. „Complete protection against severe acute respiratory syndrome coronavirus-mediated lethal respiratory disease in aged mice by immunization with a mouse-adapted virus lacking E protein.” Journal of virology 87, no. 12 (2013): 6551-6559. https://jvi.asm.org/content/jvi/87/12/6551.full.pdf
4. Wang, Qidi, Lianfeng Zhang, Kazuhiko Kuwahara, Li Li, Zijie Liu, Taisheng Li, Hua Zhu et al. „Immunodominant SARS coronavirus epitopes in humans elicited both enhancing and neutralizing effects on infection in non-human primates.” ACS infectious diseases 2, no. 5 (2016): 361-376. https://pubs.acs.org/doi/full/10.1021/acsinfecdis.6b00006
5. Pedersen, Niels C. „An update on feline infectious peritonitis: virology and immunopathogenesis.” The Veterinary Journal 201, no. 2 (2014): 123-132. https://www.sciencedirect.com/science/article/pii/S1090023314001786
6. Kam, Yiu Wing, François Kien, Anjeanette Roberts, Yan Chung Cheung, Elaine W. Lamirande, Leatrice Vogel, Shui Ling Chu et al. „Antibodies against trimeric S glycoprotein protect hamsters against SARS-CoV challenge despite their capacity to mediate FcγRII-dependent entry into B cells in vitro.” Vaccine 25, no. 4 (2007): 729-740. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7115629/
7. Bolles, Meagan, Damon Deming, Kristin Long, Sudhakar Agnihothram, Alan Whitmore, Martin Ferris, William Funkhouser et al. „A double-inactivated severe acute respiratory syndrome coronavirus vaccine provides incomplete protection in mice and induces increased eosinophilic proinflammatory pulmonary response upon challenge.” Journal of virology 85, no. 23 (2011): 12201-12215. https://jvi.asm.org/content/jvi/85/23/12201.full.pdf
8. Tirado, S. M. C., & Yoon, K. J. (2003). Antibody-dependent enhancement of virus infection and disease. Viral immunology, 16(1), 69-86. https://www.liebertpub.com/doi/abs/10.1089/088282403763635465
9. Takada, Ayato, and Yoshihiro Kawaoka. „Antibody‐dependent enhancement of viral infection: molecular mechanisms and in vivo implications.” Reviews in medical virology 13, no. 6 (2003): 387-398. https://onlinelibrary.wiley.com/doi/abs/10.1002/rmv.405
10. Wang, Sheng-Fan, Sung-Pin Tseng, Chia-Hung Yen, Jyh-Yuan Yang, Ching-Han Tsao, Chun-Wei Shen, Kuan-Hsuan Chen et al. „Antibody-dependent SARS coronavirus infection is mediated by antibodies against spike proteins.” Biochemical and biophysical research communications 451, no. 2 (2014): 208-214. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7092860/
11. Wan, Yushun, Jian Shang, Shihui Sun, Wanbo Tai, Jing Chen, Qibin Geng, Lei He et al. „Molecular mechanism for antibody-dependent enhancement of coronavirus entry.” Journal of virology 94, no. 5 (2020). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7022351/
12. Dutry, Isabelle, Hui-ling Yen, Horace Lee, Malik Peiris, and Martial Jaume. „Antibody-dependent enhancement (ADE) of infection and its possible role in the pathogenesis of influenza.” In BMC proceedings, vol. 5, no. 1, p. P62. BioMed Central, 2011. https://bmcproc.biomedcentral.com/track/pdf/10.1186/1753-6561-5-S1-P62?site=http://bmcproc.biomedcentral.com
13. Ruckwardt, Tracy J., Kaitlyn M. Morabito, and Barney S. Graham. „Immunological lessons from respiratory syncytial virus vaccine development.” Immunity 51, no. 3 (2019): 429-442.+ https://www.sciencedirect.com/science/article/pii/S1074761319303334
14. Dejnirattisai, Wanwisa, Amonrat Jumnainsong, Naruthai Onsirisakul, Patricia Fitton, Sirijitt Vasanawathana, Wannee Limpitikul, Chunya Puttikhunt et al. „Cross-reacting antibodies enhance dengue virus infection in humans.” Science 328, no. 5979 (2010): 745-748. https://europepmc.org/article/PMC/3837288
15. Beck, Zoltán, Zoltán Prohászka, and George Füst. „Traitors of the immune system—enhancing antibodies in HIV infection: their possible implication in HIV vaccine development.” Vaccine 26, no. 24 (2008): 3078-3085.
16. Burke, Donald S. „Human HIV vaccine trials: does antibody-dependent enhancement pose a genuine risk?.” Perspectives in Biology and Medicine 35, no. 4 (1992): 511-530. https://muse.jhu.edu/article/459161/pdf
17. Takada, Ayato, Heinz Feldmann, Thomas G. Ksiazek, and Yoshihiro Kawaoka. „Antibody-dependent enhancement of Ebola virus infection.” Journal of virology 77, no. 13 (2003): 7539-7544. https://jvi.asm.org/content/jvi/77/13/7539.full.pdf
18. Takada, Ayato, Shinji Watanabe, Katsunori Okazaki, Hiroshi Kida, and Yoshihiro Kawaoka. „Infectivity-enhancing antibodies to Ebola virus glycoprotein.” Journal of virology 75, no. 5 (2001): 2324-2330.
19. Gauger PC, Vincent AL, Loving CL, Lager KM, Janke BH, Kehrli ME Jr., and Roth JA: Enhanced pneumonia and disease in pigs vaccinated with an inactivated human-like (delta-cluster) H1N2 vaccine and challenged with pandemic 2009 H1N1 influenza virus. Vaccine 2011;29:2712–2719. https://lib.dr.iastate.edu/cgi/viewcontent.cgi?article=1075&context=vmpm_pubs
20. Rajão, Daniela S., Hongjun Chen, Daniel R. Perez, Matthew R. Sandbulte, Phillip C. Gauger, Crystal L. Loving, G. Dennis Shanks, and Amy Vincent. „Vaccine-associated enhanced respiratory disease is influenced by haemagglutinin and neuraminidase in whole inactivated influenza virus vaccines.” Journal of General Virology 97, no. 7 (2016): 1489-1499. https://www.microbiologyresearch.org/docserver/fulltext/jgv/97/7/1489_vir000468.pdf?expires=1591728632&id=id&accname=guest&checksum=5007EAF2D1FCFBE1C2DD06ED7D1C8FFE
21. Olsen, CHRISTOPHER W., W. V. Corapi, C. K. Ngichabe, J. D. Baines, and F. W. Scott. „Monoclonal antibodies to the spike protein of feline infectious peritonitis virus mediate antibody-dependent enhancement of infection of feline macrophages.” Journal of virology 66, no. 2 (1992): 956-965. https://jvi.asm.org/content/jvi/66/2/956.full.pdf
22. Wang, Sheng-Fan, Sung-Pin Tseng, Chia-Hung Yen, Jyh-Yuan Yang, Ching-Han Tsao, Chun-Wei Shen, Kuan-Hsuan Chen et al. „Antibody-dependent SARS coronavirus infection is mediated by antibodies against spike proteins.” Biochemical and biophysical research communications 451, no. 2 (2014): 208-214. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7092860/
23. Wan, Yushun, Jian Shang, Shihui Sun, Wanbo Tai, Jing Chen, Qibin Geng, Lei He et al. „Molecular mechanism for antibody-dependent enhancement of coronavirus entry.” Journal of virology 94, no. 5 (2020). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7022351/
24. Jaume, Martial, Ming S. Yip, Chung Y. Cheung, Hiu L. Leung, Ping H. Li, Francois Kien, Isabelle Dutry et al. „Anti-severe acute respiratory syndrome coronavirus spike antibodies trigger infection of human immune cells via a pH-and cysteine protease-independent FcγR pathway.” Journal of virology 85, no. 20 (2011): 10582-10597. https://jvi.asm.org/content/jvi/85/20/10582.full.pdf
25. Iwasaki, Akiko, and Yexin Yang. „The potential danger of suboptimal antibody responses in COVID-19.” Nature Reviews Immunology (2020): 1-3. https://www.nature.com/articles/s41577-020-0321-6?fbclid=IwAR2OHhAhzFzJpqZOEI_ifMLBpihW-beWYoGQ0L4XJ5cDQRpleOQ5kQ9lH28
26. https://www.chelseagreen.com/product/corona-false-alarm/
27. Pulendran, Bali, and Rafi Ahmed. „Translating innate immunity into immunological memory: implications for vaccine development.” Cell 124, no. 4 (2006): 849-863. https://www.sciencedirect.com/science/article/pii/S0092867406001942
28. Baxter, David. „Active and passive immunity, vaccine types, excipients and licensing.” Occupational Medicine 57, no. 8 (2007): 552-556. https://academic.oup.com/occmed/article/57/8/552/1474357
29. Sahin, Ugur, Katalin Karikó, and Özlem Türeci. „mRNA-based therapeutics—developing a new class of drugs.” Nature reviews Drug discovery 13, no. 10 (2014): 759-780. https://www.nature.com/articles/nrd4278?cacheBust=1508171532658
30. Minor, Philip D. „Live attenuated vaccines: Historical successes and current challenges.” Virology 479 (2015): 379-392. https://www.sciencedirect.com/science/article/pii/S0042682215001725
31. Lundstrom, Kenneth. „Latest development on RNA-based drugs and vaccines.” Future science OA 4, no. 5 (2018): FSO300. https://www.future-science.com/doi/full/10.4155/fsoa-2017-0151?utm_source=TrendMD&utm_medium=cpc&utm_campaign=Future_science_OA_TrendMD_1&
32. Sahin, Ugur, Katalin Karikó, and Özlem Türeci. „mRNA-based therapeutics—developing a new class of drugs.” Nature reviews Drug discovery 13, no. 10 (2014): 759-780. https://www.nature.com/articles/nrd4278?cacheBust=1508171532658
33. Scorza, Francesco Berlanda, and Norbert Pardi. „New kids on the block: RNA-based influenza virus vaccines.” Vaccines 6, no. 2 (2018): 20. https://www.mdpi.com/2076-393X/6/2/20/htm
34. Brito, Luis A., Sushma Kommareddy, Domenico Maione, Yasushi Uematsu, Cinzia Giovani, Francesco Berlanda Scorza, Gillis R. Otten et al. „Self-amplifying mRNA vaccines.” In Advances in genetics, vol. 89, pp. 179-233. Academic Press, 2015. https://www.sciencedirect.com/science/article/abs/pii/S0065266014000066
35. Pardi, Norbert, Michael J. Hogan, Frederick W. Porter, and Drew Weissman. „mRNA vaccines—a new era in vaccinology.” Nature reviews Drug discovery 17, no. 4 (2018): 261. https://www.nature.com/articles/nrd.2017.243.
36. Pardi, Norbert, and Drew Weissman. „Measuring the Adjuvant Activity of RNA Vaccines.” In RNA Vaccines, pp. 143-153. Humana Press, New York, NY, 2017. https://link.springer.com/protocol/10.1007/978-1-4939-6481-9_8
37. Holtkamp, S. et al. (2006) Modification of antigen-encoding RNA increases stability, translational efficacy, and T-cell stimulatory capacity of dendritic cells. Blood 108, 4009–4017. https://pdfs.semanticscholar.org/5a61/5fed2165a18d63d5718cc945fb163845057b.pdf
38. Geall, A.J. et al. (2012) Nonviral delivery of self-amplifying RNA vaccines. Proc. Natl Acad. Sci. USA 109, 14604–14609. https://www.pnas.org/content/pnas/109/36/14604.full.pdf
39. Lutz J. et al. (2017) Unmodified mRNA in LNPs constitutes a competitive technology for prophylactic vaccines. NPJ Vaccines (2017) 2, 29. https://www.nature.com/articles/s41541-017-0032-6
40. Probst, Jochen, Sonja Brechtel, Birgit Scheel, Ingmar Hoerr, Günther Jung, Hans-Georg Rammensee, and Steve Pascolo. „Characterization of the ribonuclease activity on the skin surface.” Genetic vaccines and therapy 4, no. 1 (2006): 4. https://link.springer.com/article/10.1186/1479-0556-4-4
41. Yang, Qi, and Samuel K. Lai. „Anti‐PEG immunity: emergence, characteristics, and unaddressed questions.” Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology 7, no. 5 (2015): 655-677. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4515207/
42. Garay, Ricardo P., Raafat El-Gewely, Jonathan K. Armstrong, George Garratty, and Pascal Richette. „Antibodies against polyethylene glycol in healthy subjects and in patients treated with PEG-conjugated agents.” (2012): 1319-1323. https://www.tandfonline.com/doi/pdf/10.1517/17425247.2012.720969
43. Zhang, Peng, Fang Sun, Sijun Liu, and Shaoyi Jiang. „Anti-PEG antibodies in the clinic: Current issues and beyond PEGylation.” Journal of Controlled Release 244 (2016): 184-193. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5747248/
44. Ganson, Nancy J., Thomas J. Povsic, Bruce A. Sullenger, John H. Alexander, Steven L. Zelenkofske, Jeffrey M. Sailstad, Christopher P. Rusconi, and Michael S. Hershfield. „Pre-existing anti–polyethylene glycol antibody linked to first-exposure allergic reactions to pegnivacogin, a PEGylated RNA aptamer.” Journal of Allergy and Clinical Immunology 137, no. 5 (2016): 1610-1613. https://www.jacionline.org/article/S0091-6749(15)01667-X/fulltext
45. Richter, Ary Wolfgang, and Eva Åkerblom. „Polyethylene glycol reactive antibodies in man: titer distribution in allergic patients treated with monomethoxy polyethylene glycol modified allergens or placebo, and in healthy blood donors.” International Archives of Allergy and Immunology 74, no. 1 (1984): 36-39. https://www.karger.com/Article/Abstract/233512
46. Ishida, Tatsuhiro, XinYu Wang, Taro Shimizu, Kosuke Nawata, and Hiroshi Kiwada. „PEGylated liposomes elicit an anti-PEG IgM response in a T cell-independent manner.” Journal of controlled release 122, no. 3 (2007): 349-355. https://www.sciencedirect.com/science/article/abs/pii/S0168365907002428
47. Yang, Qi, Timothy M. Jacobs, Justin D. McCallen, Dominic T. Moore, Justin T. Huckaby, Jasmine N. Edelstein, and Samuel K. Lai. „Analysis of pre-existing IgG and IgM antibodies against polyethylene glycol (PEG) in the general population.” Analytical chemistry 88, no. 23 (2016): 11804-11812. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6512330/
48. Rauch, Susanne, Edith Jasny, Kim E. Schmidt, and Benjamin Petsch. „New vaccine technologies to combat outbreak situations.” Frontiers in immunology 9 (2018): 1963. https://www.frontiersin.org/articles/10.3389/fimmu.2018.01963/full
49. https://arcturusrx.com/proprietary-technologies/
50. Pardi, Norbert, Michael J. Hogan, Frederick W. Porter, and Drew Weissman. „mRNA vaccines—a new era in vaccinology.” Nature reviews Drug discovery 17, no. 4 (2018): 261. https://www.nature.com/articles/nrd.2017.243.
51. Fischer, Silvia, Tibo Gerriets, Carina Wessels, Maureen Walberer, Sawa Kostin, Erwin Stolz, Kirila Zheleva, Andreas Hocke, Stefan Hippenstiel, and Klaus T. Preissner. „Extracellular RNA mediates endothelial-cell permeability via vascular endothelial growth factor.” Blood 110, no. 7 (2007): 2457-2465. https://www.researchgate.net/profile/Andreas_Hocke/publication/6259977_Extracellular_RNA_Mediates_Endothelial_Cell_Permeability_via_Vascular_Endothelial_Growth_Factor/links/00463523c326a4024e000000/Extracellular-RNA-Mediates-Endothelial-Cell-Permeability-via-Vascular-Endothelial-Growth-Factor.pdf
52. Kannemeier, Christian, Aya Shibamiya, Fumie Nakazawa, Heidi Trusheim, Clemens Ruppert, Philipp Markart, Yutong Song et al. „Extracellular RNA constitutes a natural procoagulant cofactor in blood coagulation.” Proceedings of the National Academy of Sciences 104, no. 15 (2007): 6388-6393. https://www.pnas.org/content/pnas/104/15/6388.full.pdf
53. Tusup, Marina, Thomas Kundig, and Steve Pascolo. „Epitranscriptomics of cancer.” World Journal of Clinical Oncology 9, no. 3 (2018): 42. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5997933/
54. Hsu, Phillip J., Hailing Shi, and Chuan He. „Epitranscriptomic influences on development and disease.” Genome biology 18, no. 1 (2017): 197. https://genomebiology.biomedcentral.com/articles/10.1186/s13059-017-1336-6?optIn=true
55. Lian, Hao, Qin-Hua Wang, Chang-Bin Zhu, Jie Ma, and Wei-Lin Jin. „Deciphering the epitranscriptome in cancer.” Trends in cancer 4, no. 3 (2018): 207-221.
56. Dinescu, Sorina, Simona Ignat, Andreea Daniela Lazar, Carolina Constantin, Monica Neagu, and Marieta Costache. „Epitranscriptomic signatures in lncRNAs and their possible roles in cancer.” Genes 10, no. 1 (2019): 52.
57. https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=908ecbe7-2f1b-42dd-94bf-f917ec3c5af8
58. https://www.raps.org/news-and-articles/news-articles/2020/3/covid-19-vaccine-tracker
59. Frank, Hans-George, Patrick Bose, Andrea Albieri-Borges, Marcus Borges, Alexandra Greindl, Josepf Neulen, Andy JG Pötgens, and Peter Kaufmann. „Evaluation of fusogenic trophoblast surface epitopes as targets for immune contraception.” Contraception 71, no. 4 (2005): 282-293. https://www.sciencedirect.com/science/article/abs/pii/S0010782405000181
60. Mi, Sha, Xinhua Lee, Xiang-ping Li, Geertruida M. Veldman, Heather Finnerty, Lisa Racie, Edward LaVallie et al. „Syncytin is a captive retroviral envelope protein involved in human placental morphogenesis.” Nature 403, no. 6771 (2000): 785-789.
61. https://www.biologicalmedicineinstitute.com/articles-aluminum1
62. Jones, Kathryn L., Debbie Drane, and Eric J. Gowans. „Long-term storage of DNA-free RNA for use in vaccine studies.” Biotechniques 43, no. 5 (2007): 675-681. https://www.future-science.com/doi/pdf/10.2144/000112593
63. Gelles D. How to Ship a Vaccine at -80°C, and Other Obstacles in the Covid Fight. The New York Times [Internet] 2020 Sep 19 [Cited 2020 Oct 11]. Available from:
64. Brown, T. T. H. „Pfizer’s Major Setback in the COVID-19 Vaccine Race.” http://ursa.browntth.com/the-blog/pfizers-major-setback-in-the-covid-19-vaccine-race
65. Federal Register :: Amendment to Declaration Under the Public Readiness and Emergency Preparedness Act for Medical Countermeasures Against COVID-19
66. https://www.phe.gov/Preparedness/legal/prepact/Pages/default.aspx
67. Polack, Fernando P., Stephen J. Thomas, Nicholas Kitchin, Judith Absalon, Alejandra Gurtman, Stephen Lockhart, John L. Perez et al. „Safety and efficacy of the BNT162b2 mRNA covid-19 vaccine.” New England Journal of Medicine (2020). https://www.nejm.org/doi/full/10.1056/NEJMoa2034577
68. FDA. FDA Briefing Document: Pfizer-BioNTech COVID-19 Vaccine. VRBPAC Committee Meeting Dec. 10, 2020.
69. Pfizer. Study to Describe the Safety, Tolerability, Immunogenicity, and Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Adults. Exclusion Criteria. Sept. 28, 2020.
70. Weintraub K. ‘Very inconsistent’: 2 allergic reactions in the UK to COVID-19 vaccine puzzle researchers.USA Today Dec. 9, 2020.
Kilka „smaczków” z Charakterystyki Produktu Leczniczego szczepionki AstraZeneca. Zawsze warto rozmawiać w oparciu o fakty. Oto kilka z nich:
1. Skład jakościowy:
Wytwarzany w genetycznie zmodyfikowanych, ludzkich embrionalnych komórkach nerki (HEK) 293 oraz za pomocą technologii rekombinacji DNA.
Ten produkt zawiera organizmy modyfikowane genetycznie (GMO).
2.Okres utrzymywania się ochrony:
Okres utrzymywania się ochrony zapewnianej przez szczepionkę jest nieznany, ponieważ jest to nadal ustalane w toczących się badaniach klinicznych.
3.Ograniczenia dotyczące skuteczności szczepionki:
Obecnie dostępne dane z badań klinicznych nie pozwalają na oszacowanie skuteczności szczepionki u osób w wieku powyżej 55 lat.
4. Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Nie przeprowadzono badań dotyczących interakcji.
Nie przeprowadzono badań dotyczących jednoczesnego podawania szczepionki COVID-19 Vaccine AstraZeneca z innymi szczepionkami.
5. Wpływ na płodność, ciążę i laktację:
Nie ukończono badań dotyczących szkodliwego wpływu na reprodukcję u zwierząt. Na podstawie wyników badań wstępnych nie przewiduje się żadnego wpływu na rozwój płodu.
6.Skuteczność kliniczna:
Z badań klinicznych wykluczono uczestników z ciężkimi i/lub niekontrolowanymi: chorobami sercowo-naczyniowymi, żołądkowo-jelitowymi, chorobami wątroby, nerek, chorobami endokrynologicznymi/metabolicznymi oraz zaburzeniami neurologicznymi; jak również osoby z ciężką immunosupresją, kobiety w ciąży oraz uczestników z udokumentowanym przebiegiem zakażenia wirusem SARS-CoV-2.
7. Dopuszczenie warunkowe:
Ten produkt leczniczy został dopuszczony do obrotu zgodnie z procedurą dopuszczenia warunkowego. Oznacza to, że oczekiwane są dalsze dowody świadczące o korzyści ze stosowania produktu leczniczego
8. Przedkliniczne dane o bezpieczeństwie:
Genotoksyczność/rakotwórczość
Nie przeprowadzono badań genotoksyczności ani rakotwórczości. Nie przewiduje się, aby składniki szczepionki miały potencjalne działanie genotoksyczne.
Toksyczny wpływ na reprodukcję
Badania na zwierzętach dotyczące potencjalnego, szkodliwego wpływu na reprodukcję i rozwój nie zostały zakończone. Wstępne badania dotyczące toksyczności w odniesieniu do reprodukcji u myszy nie wykazały szkodliwego wpływu na zarodki lub płody.
Co zrobili nasi rodzimi eksperci po lekturze tego dokumentu? Zamówili 16 milionów dawek! Ktoś jeszcze uważa, że to nie jest eksperyment medyczny?
https://ec.europa.eu/health/documents/community-register/2021/20210129150842/anx_150842_pl.pdf
1. Jaka jest sekwencja wszystkich fragmentów/cząstek RNA i/lub DNA zawartych w preparatach nazywanych “szczepionkami”.
2. Ulotka z UK dotycząca preparatów mRNA firmy Pfizer zawiera informację o tym, że mRNA było produkowane in vitro a ponieważ robi się to w tzw. lizatach komórkowych lub w maszynach do syntezy kwasów nukleinowych – powstaje pytanie czy w przypadku wykorzystania lizatów komórkowych pochodziły one lub pochodzą z komórek otrzymywanych z ludzkich płodów? Jaka jest gwarancja, że w końcowym preparacie nie ma pozostałości z tych ” nieśmiertelnych” lizatów komórkowych?
3. Jakie modyfikacje mRNA zastosowano, w tym czy zastosowano również, a jeśli tak to w jaki sposób, zmodyfikowane nukleotydy w czasie syntezy mRNA in vitro?
4. Czy preparaty mRNA zawierają technologię CRISPR-Cas9 lub jej warianty?
5. Czy istnieje, a jeśli tak, to jak wysokie prawdopodobieństwo, że odpowiedź immuno wygenerowana na bazie wytworzonego w komórce fragmentu białka S po podaniu do niej mRNA “szczepionki” będzie także skierowana przeciwko syncytynie lub innym białkom własnym człowieka?
6. Jakie jest prawdopodobieństwo efektu wzmocnienia choroby i/lub tzw. kondycjonowania patogenicznego (ang. pathogenic priming) i/lub reakcji autoimmunologicznej? Czy antygenty znajdujące się na zastosowanym fragmencie białka S różnią się zasadniczo od antygenów występujących na białkach własnych człowieka?
7. Jak trwałe jest mRNA dostarczane do komórki? Ile cykli translacji może przejść jedna cząsteczka mRNA i ile szacunkowo cząsteczek mRNA może zostać dostarczonych do jednej komórki? Jaka jest średnia wydajność transfekcji komórek po podaniu “szczepionki”?
8. Czy zastosowane mRNA należy do klasy samo-replikujących się szczepionek mRNA?
9. Jakie inne adjuvanty o charakterze biochemicznym oraz fizycznym znajdują się w preparacie mRNA?
10. Czy w preparatach mRNA znajdują się “dodatki”, które można określić jako nanotechnologia? Jeśli tak to jakie i jaka jest ich rola w “szczepionce”?
11. Czy w preparatach zastosowano składniki lub modyfikacje fluorescencyjne, natury chemicznej lub enzymatycznej? Jeśli tak to w jakim celu?
12. Czy w tych “szczepionkach” znajdują się inne typy RNA, takie jak np. short interfering RNA, czyli siRNA lub inne? Jeśli tak to jaka jest ich rola? Z patentu MODERNA widać, że mogą być, by zmieniać funkcje genów.