Adwersomika: nowy paradygmat bezpieczeństwa i projektowania szczepionek
Źródło: Adversomics: a new paradigm for vaccine safety and design

Adwersomika: nowy paradygmat bezpieczeństwa i projektowania szczepionek
Streszczenie
Pomimo ogromnych korzyści, jakie niosą społeczeństwu szczepienia rutynowe, niepożądane odczyny i reakcje poszczepienne, czy to rzeczywiste czy postrzegane, stanowią jedną z największych barier dla akceptacji szczepień – a tym samym dla zapobieganiu chorobom zakaźnym – na całym świecie. Aby zrozumieć mechanizmy stojące za niepożądanymi odczynami poszczepiennymi, przewidzieć je, a następnie zastosować tę wiedzę opracowując nowe podejścia do projektowania szczepionek, po przyjęciu których liczba takich odczynów jest mniejsza lub reakcje w ogóle nie występują, potrzebne jest prawdziwie zintegrowane podejście kliniczne i translacyjne z uwzględnieniem badań podstawowych. Termin „adwersomika” wprowadzono po raz pierwszy w 2009 roku i odnosi się on do badania niepożądanych odczynów poszczepiennych z zastosowaniem podejścia immunogenomicznego oraz wiedzy z zakresu biologii systemów. W niniejszym przeglądzie przedstawiamy stan obecny badań z dziedziny adwersomiki, weryfikujemy poznane związki i mechanizmy niepożądanych odczynów/reakcji poszczepiennych, a także prezentujemy plan dalszego rozwoju tej nowo powstałej dziedziny badań.
Dr Paul Thomas – zawieszone prawo wykonywania zawodu za badanie szczepionek.
Krztusiec wśród całkowicie zaszczepionych dzieci w ośrodkach opieki dziennej w Izraelu [2000]
Prognoza zachorowalności na odrę w wysoko wyszczepionej populacji – podejście modelowe – dr D.L. Levy
Przykłady szczepionkowych porażek opisane w literaturze medycznej
Film Szczepionka DPT: Szczepionkowa Ruletka [kwiecień 1982]
Jak działają szczepionki? W dużej mierze nie mamy pojęcia. – Dr Peter Aaby
Niepożądane Odczyny i Reakcje Poszczepienne
Zastosowanie szczepionek w zapobieganiu chorobom zakaźnym zalicza się do największych osiągnięć w dziedzinie zdrowia publicznego XX wieku[1]. Jednak pomimo postępu technologicznego w opracowywaniu nowych i skuteczniejszych preparatów, ulepszeniom na poziomie systemowym narodowych programów szczepień oraz ekspansji tych programów do odległych zakątków rozwijającego się świata, naukowcy i pracownicy służby zdrowia na całym świecie wciąż walczą z liczącym sobie wiek nieprzyjacielem szczepionek – konkretnie, ze strachem[2-9]. Strach ten waha się od logicznych obaw i nielogicznego niepokoju związanego ze znanymi niepożądanymi reakcjami poszczepiennymi do paniki wywołanej przez nieudowodnione i urojone następstwa szczepień[2, 4, 10-13]. W jednym z badań kliniczno-kontrolnych przyczyn odmowy rodziców przyjęcia szczepionki przez ich dzieci w Stanach Zjednoczonych, najczęstszym powodem odmowy zaszczepienia był strach, że szczepionka jako taka może wyrządzić krzywdę (57%)[12]. Szczepionki profilaktyczne muszą spełniać wyższe standardy bezpieczeństwa niż wiele innych leków i produktów biologicznych głównie z tego powodu, że podaje się je w dużej mierze zdrowym społeczeństwom z zamiarem zapobieżenia, nie zaś leczenia choroby.
Wytyczne Dotyczące Przedklinicznych Badań Farmakologicznych i Toksykologicznych Szczepionek – EMA
Czy na pewno szczepionki to najlepiej przebadane produkty firm farmaceutycznych? Sprawdźmy.
Szczepionki opracowywane są w taki sposób, aby stymulować odpowiedź immunologiczną na antygeny, a czyniąc to wywołują często działanie zapalne. Reakcje te są zazwyczaj łagodne i objawiają się jako łagodne miejscowe lub ogólnoustrojowe reakcje niepożądane na szczepienie takie jak zaczerwienienie, opuchlizna czy gorączka. Nieczęsto zdarza się, że odpowiedź immunologiczna wywołuje poważniejszą lub bardziej długotrwałą reakcję niepożądaną. Rzadko po szczepieniu może wystąpić zagrażająca życiu reakcja alergiczna.
Anafilaksja po szczepieniu ~1% zgłaszane jako NOP
W USA rejestruje się mniej niż 1% NOPów – Harvard Pilgrim Health Care
USA: Tuszowanie Niepożądanych Odczynów Poszczepiennych – Deborah Conrad
Słowa Alergia i Anafilaksja zostały utworzone, aby opisać szkody po szczepionkach
Szczepionki są bardzo bezpieczne – dr Soumya Swaminathan, WHO
Opracowano konkretne kryteria diagnostyczne ustalenia przypadku wstrząsu anafilaktycznego po szczepieniu[14]. Niepożądana reakcja poszczepienna została zdefiniowana przez amerykańskie Centra Kontroli i Zapobiegania Chorobom (ang. Centers for Disease Control and Prevention, CDC) jako „nieprzewidziany skutek spowodowany przez szczepionkę uboczny dla głównego celu tej szczepionki, którym jest wytworzenie odporności”[15]. Niepożądane reakcje poszczepienne określa się często jako skutki uboczne szczepienia. Termin „niepożądany odczyn poszczepienny” odnosi się do każdego nieprzewidzianego zdarzenia medycznego, które występuje w następstwie szczepienia[15]. Niepożądany odczyn może być faktyczną reakcją niepożądaną spowodowaną przez szczepienie lub niezwiązanym przypadkowym zdarzeniem. Należy przeprowadzić badanie, aby stwierdzić czy odczyn niepożądany jest skutkiem zaszczepienia. Światowa Organizacja Zdrowia (ang. World Health Organization, WHO) opublikowała instrukcję oceny przyczynowości niepożądanych odczynów poszczepiennych (ang. adverse events following immunization, AEFI) [16,17]. Ważne jest dokonanie systematycznej oceny wszystkich możliwych przyczyn AEFI, w której mieści się ocena związku czasowego, prawdopodobieństwa biologicznego, uwzględnienie alternatywnych wyjaśnień (np. istniejąca wcześniej choroba, wystąpienie nowego schorzenia nie związanego ze szczepieniem, spontaniczne wystąpienie odczynu bez znanych czynników ryzyka, pojawienie się choroby genetycznie zaprogramowanej, niedawny kontakt z innym zakaźnym czynnikiem lub toksyną poprzedzający wystąpienie odczynu, pojawienie się tego odczynu w przeszłości niezależnie od szczepienia, możliwe skutki przyjmowania leków), a także wcześniejsze dowody wskazujące, że dana szczepionka powoduje ten konkretny odczyn [16]. Ocena przyczynowości WHO obejmuje czterostopniowy proces oceny kwalifikacji odczynu jako AEFI, który skutkuje sklasyfikowaniem tego odczynu jako „stały związek przyczynowy ze szczepieniem”, „niejasny”, „niestały związek przyczynowy ze szczepieniem” (przypadkowy) lub „nieklasyfikowalny” (Tabela 1)[16]. Związek jest „niejasny”, kiedy dostępne są wystarczające informacje na temat danego AEFI, ale nie jest możliwe przyporządkowanie go do kategorii „stały związek przyczynowy ze szczepieniem” lub „niestały związek przyczynowy ze szczepieniem”. Odczyn jest „nieklasyfikowalny”, gdy do ustalenia przyczynowości konieczne są dodatkowe informacje[16]. Reakcje na produkt szczepionkowy mogą być związane z antygenem(antygenami) w szczepionce, innym składnikiem szczepionki i adjuwantem (jeżeli jest obecny) lub z kombinacją antygenu(antygenów) i adjuwantu.
Częstotliwość występowania niepożądanych reakcji poszczepiennych różni się w zależności od rodzaju preparatu i właściwości badanej populacji pacjentów. Szczepionki mogą ujawniać podatność na niepożądany odczyn poszczepienny w określonych populacjach (np. gorączka po szczepieniu może skutkować drgawkami gorączkowymi u dzieci z predyspozycją do napadów drgawkowych). Na immunogenność szczepionki mają wpływ liczne indywidualne czynniki dotyczące pacjenta (np. wiek, płeć, choroby współistniejące, genetyka) oraz czynniki związane ze szczepionką (np. dawka antygenów, mechanizm podania preparatu, harmonogram szczepień i adjuwant w szczepionce). Czynniki te mogą również wpływać na reakcję zapalną, co z kolei może prowadzić do wystąpienia niepożądanych skutków poszczepiennych. WHO klasyfikuje reakcje związane ze szczepionką samą w sobie i reakcje związane z wadliwą jakością szczepionki jako „związane ze sposobem podania lub miejscem podania”, „immunologiczne” i „reakcje jako skutek replikacji czynnika drobnoustrojowego związanego ze szczepionką” (Tabela 1). „Reakcje jako skutek replikacji czynnika drobnoustrojowego związanego ze szczepionką” z większym prawdopodobieństwem występują u pacjentów z obniżoną odpornością. Mechanizmy stojące za tymi niepożądanymi reakcjami na szczepionki zawierające atenuowane drobnoustroje różnią się od reakcji immunologicznych na szczepionki inaktywowane.
Tabela 1. Klasyfikacja Niepożądanych Odczynów Poszczepiennych WHO.
| Klasyfikacja Przyczynowości WHO [16] | Przykłady/Komentarze |
| A. Stały związek przyczynowy ze szczepieniem | |
| A1 i A2. Reakcje związane ze szczepionką samą w sobie i reakcje związane z wadliwą jakością szczepionki | |
| • Reakcje związane ze sposobem podania lub miejscem podania | Miejscowy ból występujący w miejscu iniekcji |
| • Reakcja immunologiczna na szczepionkę | |
| • Miejscowe | Reakcja w miejscu iniekcji |
| • Reakcje wieloukładowe (uogólnione) | Gorączka nadwrażliwość IgE-zależna nadwrażliwość IgE-niezależna reakcja kompleksów immunologicznych |
| • Reakcja swoista dla narządu (o podłożu autoimmunologicznym lub taka, której mechanizm jest nieokreślony) | Ośrodkowy układ nerwowy (zespół Guillaina-Barrego) |
| • Reakcje jako skutek replikacji czynnika drobnoustrojowego związanego ze szczepionką | Związana ze szczepieniem choroba trzewna/neurotropowa |
| • Bezpośrednie toksyczne oddziaływanie składnika szczepionki lub produktu przemiany materii | Wada jakości produktu |
| A3. Reakcja związana z błędem immunizacji | |
| • Błąd w sposobie obchodzenia się ze szczepionką | Słabsza skuteczność w związku z zachowaniem łańcucha chłodniczego |
| • Błąd w zaleceniu szczepienia | Niewłaściwe zalecenie szczepionki zawierającej składniki, na które pacjent ma alergię |
| • Błąd w podaniu | Niewłaściwa technika sterylizacji skutkująca miejscową infekcją |
| A4. Reakcja związana z obawą dotyczącą szczepienia | Reakcje wazowagalne i hiperwentylacja |
| B. Niejasne | |
| B1. Stały związek czasowy, ale niewystarczające dowody na istnienie przyczynowości | Szczegóły tych przypadków powinny być odnotowane w krajowej lub międzynarodowej bazie danych. Z czasem, jeżeli zgłoszone zostaną podobne przypadki, zarejestrowane przypadki mogą posłużyć do rozpoznania sygnału, który może sugerować istnienie związku przyczynowego. |
| B2. Sprzeczne tendencje stałości i niestałości związku przyczynowego | |
| C. Niestały związek przyczynowy ze szczepieniem (przypadkowy) | |
| Widoczne objawy lub komplikacje podstawowej wrodzonej, dziedzicznej bądź nabytej choroby, która mogła zostać zdiagnozowana przed szczepieniem lub nie. | |
Niepożądane odczyny immunologiczne, w przypadku których stwierdzono związek przyczynowy ze szczepieniem, stanowią idealny cel badań dla dziedziny jaką jest adwersomika. W porównaniu ze znaczącym naciskiem, jaki kładzie się na immunogenność szczepionek, mniejszą uwagę poświęca się czynnikom wpływającym na immunologiczne niepożądane odczyny poszczepienne i na mechanizmy stojące za tymi odczynami. Zrozumienie i zapobieganie poważnym niepożądanym odczynom poszczepiennym jest decydujące dla poprawy zaufania publicznego do bezpieczeństwa szczepień oraz dla projektowania nowych bezpiecznych i skutecznych szczepionek.
Ile czasu poświęca się na uczenie lekarzy o szczepieniach? – dr Heidi Larson
W tym kontekście można wiele zaczerpnąć z dziedzin takich jak medycyna spersonalizowana i farmakogenomika, by uzyskać nowy paradygmat rozumienia i przewidywania niepożądanych odczynów poszczepiennych. Obserwacje te mogą z kolei pomóc w opracowywaniu nowych szczepionek, które nie będą wywoływać tych niepożądanych odczynów lub reakcje te będą występować z mniejszą częstotliwością.
Medycyna spersonalizowana, wakcynomika i adwersomika
Zasady „medycyny spersonalizowanej” dotyczą w równym stopniu „wakcynologii spersonalizowanej” – przez którą rozumiemy, że przy wyborze szczepionki do podania należy wziąć pod uwagę kluczowe cechy danego pacjenta. Możemy podać właściwy preparat we właściwej dawce właściwemu pacjentowi we właściwym czasie. Nie wszyscy reagują na szczepionki w ten sam sposób. Istnieje optymalne spersonalizowane podejście do szczepień obejmujące optymalne projektowanie szczepionki, sposób podania, adjuwant, dawkę i schemat dawkowania (w przypadku szczepionek, które wymagają wielu dawek) dla jednej osoby lub grupy osób. Apelujemy o zastosowanie „wakcynomiki”, która pomoże nam zrozumieć czynniki genetyczne i niegenetyczne mające wpływ na odpowiedź immunologiczną na antygen w szczepionkach na poziomie układowym [18-24]. Podobnie domagamy się rozwoju „adwersomiki” – zastosowania immunogenomiki i biologii systemów, by zrozumieć genetyczne i niegenetyczne siły napędowe niepożądanych reakcji poszczepiennych na poziomie molekularnym [18,25,26].
Dziedzina jaką jest farmakogenomika udowadnia, że wstępne badania nad poznaniem genomów mogą prowadzić do opracowania zatwierdzonych biomarkerów, które można wykorzystywać do przewidywania ryzyka wystąpienia niepożądanych reakcji na leki. Eleganckim przykładem jest związek między ludzkim antygenem leukocytarnym (ang. human leukocyte antigen, HLA) HLA*B57:01 i potencjalnie śmiertelną idiosynkratyczną nadwrażliwością na lek przeciwko wirusowi HIV abacavir. Przed zastosowaniem testów genetycznych, reakcje w postaci nadwrażliwości występowały u 5-8% pacjentów w ciągu pierwszych sześciu tygodni od rozpoczęcia terapii lekiem abacavir[27]. Wkrótce po zatwierdzeniu tego leku w Stanach Zjednoczonych, opublikowano [28,29], powtórzono i potwierdzono w licznych kohortach pacjentów [30,31] informację o związku między nadwrażliwością na lek abacavir a HLA-B*57:01. Dalsze badania wykazały, że ścisły mechanizm, za pomocą którego abacavir przyłącza się tworząc wiązania niekowalencyjne do dolnej granicy rowka wiążącego peptydy HLA-B*57:01 i zmienia wygląd peptyd własnych prezentował się układowi odpornościowemu oraz aktywnym limfocytom T CD8+, co przynosi skutek w postaci uwolnienia cytokin zapalnych powodujących kliniczną reakcję w postaci nadwrażliwości[32-35].
Owa swoistość wyjaśnia 100-procentową wartość predykcyjną ujemną testów genetycznych HLA-B*57:01 w kierunku nadwrażliwości na abacavir[31], która skutkuje jego stosowaniem na szeroką skalę i wprowadzeniem do wytycznych leczenia HIV w Stanach Zjednoczonych[36,37]. Inne przykłady reakcji objawiających się nadwrażliwością na określone leki i konkretne związki HLA obejmują allopurynol (HLA-B*58:01) i karmamazepinę (HLA-B*15:02)[38]. Dziedzina farmakogenomiki dynamicznie się rozwija poprzez dalsze zastosowania wariacji genetycznych wykraczających poza reakcje idiosynkratyczne na leki i obejmujących wpływ na farmakokinetykę, farmakodynamikę i wady molekularne związane z patogenezą konkretnych nowotworów, przeciwko którym opracowano określone ukierunkowane metody leczenia. W chwili obecnej nie istnieją żadne tego rodzaju eleganckie przykłady wyjaśnień ani mechanizmów niepożądanych reakcji na szczepienie o podłożu immunologicznym, co podkreśla potrzebę przeprowadzenia dodatkowych badań w tej dziedzinie.
Adwersomika – aktualny stan badań w tej dziedzinie
Dziedzina adwersomiki szczepień, zgodnie z naszym opisem[39], stanowi tak naprawdę rozszerzenie farmakogenomiki. Jednak w porównaniu z dziedziną farmakogenomiki (która bada leki), dziedzina adwersomiki szczepień jest w powijakach. W chwili obecnej technologie te nie są wykorzystywane klinicznie. Pierwszym krokiem, który przyczyniłby się do rozwoju tej dziedziny nauki jest zastosowanie metod badawczych adwersomiki w celu zrozumienia mechanizmów stojących za odczynami niepożądanymi, które mają związek przyczynowy ze szczepieniem. Sugerujemy, że w badaniach nad szczepieniami można i należy stosować tę samą metodologię, co w badaniach nad lekami. Dokładne mechanizmy reakcji niepożądanych związanych ze szczepieniami nie są dobrze rozumiane.
Niespecyficzne skutki szczepień cz.1 – dr Suzanne Humphries
Niespecyficzne skutki szczepień cz.2 – dr Suzanne Humphries
Zrozumienie udziału poziomu molekularnego/genetycznego/proteomicznego (tj. adwersomiki), a konkretnie tego w jaki sposób genetyka (genomika i transkryptomika) wpływają na rozwój niepożądanych reakcji poszczepiennych, może pomóc w opracowywaniu nowszych i bezpieczniejszych kandydatów na szczepionki[25,39]. Tabela 2 przedstawia ogólny przegląd informacji z dziedziny adwersomiki, które zostały do tej pory opublikowane.
Tabela 2. Badania niepożądanych odczynów poszczepiennych wykorzystujące genetykę lub komponenty biologii systemów
| Rodzaj szczepionki | Odczyn niepożądany | N*/L* | Rodzaj badania/Metody | Związki z odczynami niepożądanymi | Źródło |
| Szczepienia dzieci | |||||
| DtaP, MMR, Hib | Drgawki związane ze szczepieniem, diagnoza epilepsji po szczepieniu dzieci | 23 | Retrospektywne
Sekwencjonowanie DNA pacjentów, u których wystąpiły odczyny |
U 65% przypadków przyczyny drgawek miały podłoże genetyczne lub strukturalne | Verbeek NE. Pediatrics 2014[40] |
| DTP, IPV, Hib | Drgawki związane ze szczepieniem, diagnoza epilepsji po szczepieniu dzieci | 14 | Retrospektywne
Sekwencjonowanie DNA pacjentów, u których wystąpiły odczyny |
U 100% przypadków przyczyny drgawek miały podłoże genetyczne lub strukturalne | Berkovic SF. Lancet Neurol 2006[41] |
| Szczepienia przeciwko ospie | |||||
| Szczepionka przeciw ospie firmy Aventis Pasteur | Gorączka, uogólniona wysypka, powiększenie węzłów chłonnych | 16;24 | Kliniczno-kontrolne
Genotypowanie polimorfizmów pojedynczego nukleotydu (ang. Single Nucleotide Polymorphism, SNP) |
Geny MTHFR i IRF1 | Reif DM. J
Infect Dis 2008[44] |
| Dryvax | Gorączka, „zespół ostrego zakażenia wirusem krowianki” | 94 | Kliniczno-kontrolne
Genotypowanie polimorfizmów pojedynczego nukleotydu (ang. Single Nucleotide Polymorphism, SNP) |
haplotypy genów IL1 i IL18 wiążą się z gorączką i zmianami odporności humoralnej | Stanley SL, Jr.
J Infect Dis 2007[53] |
| Szczepionka przeciwko żółtej febrze | |||||
| YF-17D | Choroba trzewna | 1 | Deskryptywno-teoretyczne studium przypadku
Biologia systemów |
Uporczywa wiremia, zdecydowanie wywoływanie odpowiedzi komórek T i B oraz polimorfizmy receptora chemokiny CCR5(delta 32) i genów jego ligandu RANTES (403G/A) | Pulendran B. J
Infect Dis 2008[58] |
| YF-17D | Choroba trzewna i neurotropowa | 6 | Deskryptywna seria przypadków; kliniczno-kontrolne
Profilowanie cytokin |
RANTES, IL-6, IL-8, MIG (monokina indukowana przez IFN-ɣ), GRO (onkogen związany ze wzrostem), MCP-1 (białko chemotaktyczne monocytów), TGF-ß (transformujący czynnik wzrostu) i TNF- ß (czynnik martwicy nowotworów) | Bae HG. J
Infect Dis 2008[60] |
| Związki genetyczne z zespołem Guillaina-Barrégo (niespecyficzne dla szczepienia) | |||||
| – | Zespół Guillaina-Barrégo (ang. Guillain-Barré Syndrome, GBS) | 14
0 |
Kliniczno-kontrolne genotypowanie TNF-α | allele TNF-α 308 G/A i 857 C/T | Prasad KN.
Hum Immunol 2010[65] |
| – | GBS | 12
0 |
Kliniczno-kontrolne genotypowanie TLR4 | Mutacje Asp299Gly i Thr399Ile genu TLR4 | Nyati KK. J
Neuroimmunol 2010[66] |
| GBS | 9 | Kliniczno-kontrolne genotypowanie FcRL3 | Gen (FcRL3-3-169C, intron 3A genu FcRL3-6 i ekson 15A genu FcRL3-8) | Sang D. J
Neuroimmunol 2012[67] |
|
| GBS | 26
3 |
Kliniczno-kontrolne genotypowanie SNP | Gen MMP9 (metaloproteinaza macierzy 9) (C-1562T) | Geleigns K.J
Neuroimmunol |
|
N oznacza liczbę zbadanych przypadków niepożądanych odczynów poszczepiennych
DtaP-szczepionka przeciwko błonicy-tężcowi-krztuścowi (acelularna)
MMR-szczepionka przeciwko odrze, śwince i różyczce
Hib-szczepionka przeciwko Haemophilus influenza typu B
DTP-szczepionka przeciwko błonicy-tężcowi-krztuścowi
IPV-inaktywowana szczepionka przeciwko polio
MTHFR-enzym reduktaza 5,10-metylenotetrahydrofolianowa
IRF1-czynnik regulacyjny interferonu-1
Ocena przyczynowości rzekomych niepożądanych odczynów poszczepiennych – szczepienia dzieci a zaburzenia drgawkowe
Jedną z ważnych nauk, jakie można wyciągnąć z wprowadzenia genomiki do badań niepożądanych odczynów poszczepiennych (ang. adverse events, AEs) jest to, że nie wszystkie AEs są w rzeczywistości związane ze szczepieniem. Badanie przeprowadzone niedawno przez Verbeeka i współpracowników wykazało, że w większości przypadków wady genetyczne lub strukturalne stanowią zasadniczą przyczynę wystąpienia epilepsji w następstwie rutynowego szczepienia dzieci[40]. Wspomniani naukowcy przeanalizowali dane dotyczące 990 dzieci, które doświadczyły napadów drgawkowych po zaszczepieniu (cztery dawki szczepionki DtaP, jedna dawka szczepionek MMR i Heamophilus influenza typu B) w ciągu dwóch pierwszych lat życia. Spośród 1.022 potencjalnych napadów drgawek epileptycznych u tych 990 dzieci, 68% i 32% wystąpiło po zaszczepieniu kolejną szczepionką inaktywowaną i żywą szczepionką atenuowaną[40]. W następstwie sekwencjonowania DNA u 14 (61%) spośród 23 dzieci z epilepsją i tych, u których wystąpiły napady drgawkowe związane ze szczepieniem, u 15 (65%) dzieci rozpoznano ukryte przyczyny genetyczne lub strukturalne. Jedenaścioro dzieci miało zespół Dravet związany z mutacją genu SCN1A (kanału sodowego, bramkowanego napięciem, typ 1, podjednostka alfa).
Stwierdzono, że „te ukryte przyczyny nie ograniczały się do zespołu Dravet związanego z SCN1A, ale rozciągały się na inne determinowane genetycznie rodzaje drgawek gorączkowych” i że „należy rozważyć wczesne przeprowadzenie testów genetycznych u wszystkich dzieci, u których pojawiła się epilepsja związana ze szczepieniem”[40]. W innym badaniu oceniono 14 pacjentów z napadami drgawkowymi lub zaburzeniami drgawkowymi przypuszczalnie związanymi ze szczepieniem, u których pierwsze drgawki wystąpiły w ciągu 72 godzin od szczepienia po podaniu trójwartościowej szczepionki przeciwko błonicy-krztuścowi-tężcowi lub pięciowartościowej szczepionki przeciw błonicy-krztuścowi-tężcowi-polio(inaktywowana)-Haemophilus influenzae typu B. Wspomniani pacjenci zostali poddani badaniom genetycznym, które przyniosły diagnozę zespołów padaczkowych we wszystkich 14 przypadkach[41]. Powyższe badania służą jako przykład, że testy genetyczne pod kątem przyczyn AEs przypuszczalnie związanych ze szczepieniem mogą być ważne przy ustalaniu czy odczyn niepożądany był przypadkowy czy rzeczywiście związany z przyjęciem szczepionki. Dociekania takie są istotne dla oceny bezpieczeństwa szczepionek, a także dla podtrzymania wiary społeczeństwa w ich nieszkodliwość.
Adwersomika a szczepionka przeciwko ospie
Ospa pozostaje kwestią w kontekście bioterroryzmu. Pomimo zwalczenia tej choroby w 1980 roku, szczepionkę przeciwko ospie zawierającą wirus krowianki nadal podaje się niektórym przedstawicielom służb pierwszego reagowania, pracownikom laboratoryjnym, pracownikom służby zdrowia oraz personelowi wojskowemu, przy czym AEs wywołane przez wirus krowianki w dalszym ciągu występują. W 2003 roku Ministerstwo Zdrowia i Pomocy Humanitarnej Stanów Zjednoczonych zastosowało program szczepień przeciwko ospie prawdziwej, który obejmował wszechstronny system monitorowania bezpieczeństwa wśród pracowników służby zdrowia (ang. health care workers, HCWs) i przedstawicieli służb pierwszego reagowania. Podano ponad 38.000 dawek szczepionki i zostało zgłoszonych 822 AEs; 100 spośród tych AEs uznano za poważne[42]. Wśród AEs znalazły się: zapalenie mięśnia sercowego i/lub zapalenie osierdzia w 21 przypadkach, choroba niedokrwienna serca w 10 przypadkach, krowianka uogólniona w dwóch przypadkach oraz jeden przypadek poszczepiennego zapalenia mózgu[42,43]. Szczepionka przeciwko ospie jest przeciwwskazana u osób z egzemą i złuszczającymi chorobami skóry ze względu na ryzyko wystąpienia wyprysku krowiankowego, w którym to przypadku wirus szerzy się i powoduje rozległą wysypkę pęcherzykowo-krostkową wraz z chorobą ogólnoustrojową. Centra Kontroli i Prewencji Chorób (ang. Centers for Disease Control and Prevention, CDC) rekomendują, aby osoby z podstawową chorobą serca i trzema lub czterema czynnikami ryzyka kardiologicznego nie szczepiły się. Istotne jest, aby pojąć zasadnicze mechanizmy omawianych poszczepiennych AEs, tak by można je było lepiej zrozumieć i być może przewidzieć, jak również po to, aby duże grupy nie musiały być wyłączane ze szczepień, gdyby nastąpiło wydarzenie, wskutek którego masowe szczepienie stałoby się koniecznością.
Co więcej, gdyby mechanizmy te zostały wyjaśnione, zdobyta wiedza mogłaby umożliwić opracowanie i zastosowanie nowych szczepionek – byłby to postęp, który mógłby skutkować całkowitym uniknięciem tych odczynów. Kilka niedawno przeprowadzonych badań, które zrecenzowano poniżej, odnosi się do powiązania między polimorfizmami genów a predyspozycją do AEs po zaszczepieniu przeciwko ospie. Pierwszy przykład to badanie dotyczące miejscowych i ogólnoustrojowych AEs (tj. gorączki, uogólnionych wykwitów skórnych i powiększenia węzłów chłonnych) w następstwie szczepienia przeciwko ospie[44]. Reif i in. przeprowadzili dwa badania zdrowych dorosłych uprzednio nieszczepionych wirusem krowianki (odpowiednio n=85 i n=46 osób), którzy otrzymali szczepionkę przeciwko ospie firmy Aventis Pasteur (ang. Aventis Pasteur smallpox vaccine, APSV) i zostali poddani ocenie w określonych punktach czasowych (dni 3-5, 6-8, 9-11, 12-15 i 26-30) po zaszczepieniu.
W pierwszym badaniu, którym objęto 85 osób, 16 miało ogólnoustrojowe AEs; w drugim badaniu, którym objęto 46 osób, 24 miały ogólnoustrojowe AEs. U wszystkich osób przeprowadzono genotypowanie 1.442 SNPs, które pochodziły z 386 genów kandydujących. Badacze znaleźli specyficzne SNPs/haplotypy w genach MTHFR (enzym reduktaza 5,10-metylenotetrahydrofolianowa, niesynonimiczne rs1801133, p<0.01) i IRF1 (czynnik regulacyjny interferonu-1, rs9282763 i synonimiczne rs839, p=0.03), które były istotnie związane z AEs w obu badaniach[44].
W prosty sposób o metylacji – Czym jest metylacja?
Kwas foliowy i glifosat – synergiczna toksyczność – dr Stephanie Seneff
Warianty genetyczne genu MTHFR były poprzednio związane z niepożądanymi reakcjami na inne leki biologiczne stosowane do leczenia farmakologicznego[45,46]. Zgodnie z tym, co napisali autorzy, produkty białkowe genów MTHFR oraz IRF1 mogą odgrywać ważną rolę w metabolizmie homocysteiny, jak również mogą pełnić role w regulowaniu funkcji śródbłonka i aktywowaniu transkrypcji odpowiednio interferonów typu I (α i ß) i typu II (ɣ). Zgłaszane są przypadki zapalenia mięśnia sercowego i zapalenia osierdzia z jednoczesnym zajęciem mięśnia sercowego po zaszczepieniu przeciwko ospie. W celu poznania mechanizmów stojących za tymi niepożądanymi odczynami poszczepiennymi, przeprowadzane są badania szczepionki przeciwko ospie, w tym analizy dotyczące predyspozycji genetycznych do wystąpienia AEs po szczepieniu przeciwko tej chorobie[47-52]. Wirus ospy prawdziwej, czynnik wywołujący ospę, nie powoduje bezpośrednio komplikacji krążeniowych, ale szczepionka zawierająca wirus krowianki (Dryvax, ACAM2000) związana jest z nieprawidłowościami elektrokardiogramu (EKG) i anomaliami enzymów sercowych oraz sporadycznie z objawami związanymi z zapaleniem mięśnia sercowego i zapaleniem osierdzia z jednoczesnym zajęciem mięśnia sercowego[42,48,49]. Nie jest jasne czy to drugie schorzenie związane z krowianką wywoływane jest przez bezpośrednie uszkodzenie spodowane wirusem, wtórne do odpowiedzi odpornościowej, genetykę gospodarza czy też kombinację tych i innych czynników w badanych populacjach. Konieczne jest lepsze zrozumienie czynników genetycznych i immunologicznych dotyczących zapalenia osierdzia z jednoczesnym zajęciem mięśnia sercowego związanego z krowianką i takie badania są obecnie prowadzone w naszym laboratorium.
Ocenia się podłoże genetyczne do wystąpienia gorączki (definiowanej jako temperatura >37.7ºC) po podaniu szczepionki (Dryvax) przeciwko ospie [53]. Zbadano łącznie 357 SNPs w 19 genach odpornościowych każdej z 346 zdrowych osób po zaszczepieniu żywą szczepionką zawierającą wirus krowianki. Badanie to wykazało, że określone haplotypy genów IL1 i IL2 związane są z pojawieniem się gorączki i różnicami odporności humoralnej po szczepieniu przeciwko ospie. Dokładne mechanizmy nie są znane, ale w modelu myszy zapalenia osierdzia z jednoczesnym zajęciem mieśnia sercowego wywołanym przez wirus coxsackie, podwyższone poziomy cytokin IL-1 i IL-18 związane są z zapaleniem mięśnia sercowego, zaś powstrzymanie działania IL-1 (z wykorzystaniem antagonisty receptora IL-1) zwiększyło zarówno stan zapalny, jak i śmiertelność[53,54]. Dodatkowo w badaniu tym zidentyfikowano haplotyp genu IL-4, który był wysoce znaczący dla jego związku ze zmniejszonym prawdopodobieństwem wystąpienia gorączki po zaszczepieniu osób dotąd nieszczepionych preparatem zawierającym wirus krowianki.
Wspomniany haplotyp IL4 obejmował SNP rs2243250, który jest związany ze zwiększonym wydzielaniem ważnych cytokin regulatorowych Th2, IL-4, co do których wiadomo, że hamują produkcję IFN-ɣ i odpowiedź Th1[55,56]. W badaniu obejmującym 580 zdrowych osób rasy kaukaskiej (19-40 lat), po zaszczepieniu jedną dawką szczepionki Dryvax, zmienność genetyczna genów IL1R, IL18 oraz IL18R1 związana była z wytwarzaniem IL-1ß specyficznym dla krowianki[57]. Uważamy, że istnieje potrzeba przeprowadzenia badań funkcjonalnych wariantów genetycznych, aby uzyskać wiedzę na temat mechanizmów, za pomocą których te SNPs/haplotypy przyczyniają się do odporności jaką zapewnia szczepionka przeciwko ospie i do AEs związanych ze szczepieniem. Potencjalny udział IL1, IL18, IL4 i innych genów w AEs związanych z podaniem innych szczepionek (np. MMR, MMRV, żółta febra, wirusowe zapalenie wątroby typu B, grypa, wąglik itd.) budzi duże zainteresowanie i także powinien być głębiej zbadany.
Adwersomika a szczepionka przeciwko żółtej febrze
Żywa szczepionka atenuowana przeciko żółtej febrze 17D (YF-17D) jest dobrze tolerowaną szczepionką, z którą wiążą się bardzo nieliczne przypadki AEs. Istnieje jednakże rzadkie, ale poważne ryzyko ciężkiej choroby przypominającej żółtą febrę spowodowanej przez szczep wirusa zawarty w szczepionce. Choroba trzewna wywołana przez szczepionkę przeciwko żółtej febrze 17D to poważny poszczepienny AE charakteryzujący się niewydolnością wielonarządową, która z kolei odznacza się wysokim wskaźnikiem śmiertelności[58,59]. Sugeruje się, że choroba trzewna związana ze szczepieniem przeciwko żółtej febrze wiąże się z uporczywą wiremią, zdecydowanym wywoływaniem odpowiedzi komórek T i B oraz polimorfizmami receptora chemokiny CCR5 (delta 32) i genów jego ligandu RANTES (403G/A)[58]. Ponadto Bae i in. zauważyli, że cytokiny i chemokiny w surowicy krwi takie jak RANTES, IL-6, IL-8, MIG (monokina indukowana przez IFN-ɣ), GRO (onkogen związany ze wzrostem), MCP-1 (białko chemotaktyczne monocytów), TGF-ß (transformujący czynnik wzrostu) i TNF-ß (czynnik martwicy nowotworów) mogą być uważane za zastępcze punkty końcowe dla osób, u których istnieje prawdopodobieństwo wystąpienia poważnych AEs związanych ze szczepieniem przeciwko żółtej febrze takich jak związana ze szczepieniem choroba neurotropowa i choroba trzewna[60]. Istnieje możliwość, że zwiększona i/lub zmniejszona produkcja tych markerów biologicznych spowodowana polimorfizmami w tych genach mogła upośledzić odpowiedź immunologiczną na szczepionkę przeciwko żółtej febrze. Z drugiej strony Martins i in. zbadali 50 osób zaszczepionych preparatem 17DD YF i poinformowali, że zwiększona częstotliwość występowania krążących komórek CD4+HLA-DR+ (i CD8+CD69+) 7. dnia po szczepieniu oraz limfocytów CD8+HLA-DR+ w 30. dniu po szczepieniu może stanowić wiarygodny marker odpowiedzi immunologicznej wolnej od AEs po zaszczepieniu szczepionką przeciwko żółtej febrze[61]. Badania te zapewniają wstępny wgląd w AEs wywołane szczepieniem przeciw żółtej febrze; musimy jednak przebyć długą drogę zanim zrozumiemy mechanizmy kierujące tymi AEs i będziemy w stanie je przewidzieć.
Adwersomika a zespół Guillaina-Barrégo związany ze szczepieniem przeciwko grypie
Mimo że wykazano, iż ryzyko wystąpienia zespołu Guillaina-Barrégo (GBS) w następstwie szczepienia przeciwko grypie jest niższe niż po przebyciu grypy[62], w społeczeństwie nadal istnieje obawa, że szczepienie może prowadzić do pojawienia się tej choroby neurologicznej. Odpowiedź immunologiczna na antygeny bakteryjne, które wchodzą w reakcje krzyżowe z epitopami neuronalnymi mogą zapoczątkować chorobę zapalną – GBS – w której czynniki genetyczne gospodarza są w stanie wpłynąć na podatność na chorobę. W latach 1976-1977 zaistniało podwyższone ryzyko zachorowań na GBS w następstwie szczepienia przeciwko świńskiej grypie, przy czym szacowane ryzyko nadmierne wystąpienia GBS po zaszczepieniu dorosłych wynosiło zaledwie poniżej 1 przypadku na 100.000 szczepień, zaś względna zapadalność (ang. relative incidence, RI) wynosiła 7.6 (przedział ufności 95%, 6.7-8.6)[63,64]. Dokładna przyczyna tego związku nie jest znana. Niedawno rozpoznano oddziaływanie polimorfizmów genetycznych na ryzyko wystąpienia GBS dla kilku genów: TNF-α (czynnik martwicy nowotworów-alfa) (polimorfizmy 308 G/A i 857 C/T), TLR4 (receptor toll-podobny 4) (Asp299Gly i Thr399Ile), FcRL3 (białko 3 podobne do receptora Fc) (FcRL3-3-169C, intron 3A genu FcRL3-6 i ekson 15A genu FcRL3-8) oraz MMP9 (metaloproteinaza macierzy 9) (C-1562T)[65-68]. Jednakże w badaniach tych analizowano populacje z GBS bez sprawdzenia potencjalnych wzbudzających przyczyn takich jak niedawno przebyte infekcje czy przyjęcie innych szczepionek. Trudno jest ustalić czy polimorfizmy te umożliwiłyby przewidzenie przypadków GBS, które mogłyby być skutkiem działania antygenów reagujących krzyżowo z różnych infekcji lub szczepionek. Polimorfizmy te należy zbadać w powiązaniu z przypadkami GBS, które wystąpiły po zaszczepieniu.
Narkolepsja
W następstwie pandemii grypy A/H1N1 w latach 2009-10 i szeroko zakrojonych kampanii szczepień preparatem Pandemrix przeciwko grypie A/H1N1 zawierającą adiuwant AS03 w Europie, Szwecji i Finlandii, zgłoszono wzrost zachorowalności na narkolepsję[69-71]. Narkolepsja uważana jest za chorobę autoimmunologiczną powodowaną przez utratę neuronów podwzgórza produkujących hipokretynę[72]. Ustalono, że ma silny związek z allelem genu HLA-DQB*06:02 we wszystkich grupach etnicznych. Stosując rygorystyczne kryteria diagnostyki, 98% pacjentów z narkolepsją i katapleksją posiada allel tego genu[73,74]. Istotne jest, aby zwrócić uwagę, że w innym badaniu kliniczno-kontrolnym narkolepsji, po zaszczepieniu szczepionką przeciwko grypie A/H1N1 zawierającą adiuwant AS03, allel HLA-DQB*06:02 wykryto w 100% przypadków narkolepsji (47/47), ale także u 35% (20/57) pacjentów kontrolnych[75]. Obecność tego allelu może być niezbędna, ale nie wystarczająca, aby spowodować niepożądany odczyn poszczepienny. Allel genu HLA-DQB1*06:02 jest obecny u 13-28% populacji rasy kaukaskiej; jednak ryzyko wystąpienia narkolepsji u dzieci zaszczepionych szczepionką Pandemrix noszących ten allel wynosi zaledwie 1 na 1.600[76]. Stawia się hipotezę, że szczepionka przeciwko grypie A/H1N1 zawierająca adiuwant AS03 skutkowała mimikrą molekularną do autoantygenów neuronalnych. Jedno z badań, które dostarczało dalszego poparcia dla tej hipotezy zostało później wycofane ze względu na brak możliwości replikowania danych[77]. Pozostają pytania dotyczącego tego dlaczego, jak się wydaje, jedna szczepionka przeciwko A/H1N1 zawierająca adiuwant AS03 (Pandemrix) prowadziła do wzrostu liczby przypadków narkolepsji, podczas gdy inna szczepionka przeciw A/H1N1 zawierająca adiuwant AS03 (Arepanrix), która została opracowana przy zastosowaniu nieco innego protokołu inaktywacji nie prowadziła[78]. Dalsze prace badawcze wykazały, że liczba przeciwciał przeciwko nukleoproteinom (NP) pochodzącym ze szczepionki Pandemrix zwiększyła się u pacjentów z narkolepsją, zaś allel ryzyka DQB1*06:02 mogący powodować narkolepsję wydawał się regulować odpowiedź immunologiczną na NP[75]. Autorzy tego badania postawili hipotezę, że różnice w antygenach H1N1 w szczepionkach Arepanrix i Pandemrix mogły tłumaczyć różnice ryzyka wystąpienia narkolepsji przypisywanej szczepieniu pomiędzy tymi preparatami i domagali się badań przesiewowych populacji w celu wykrycia określonej choroby pod kątem epitopów zależnych od DQB1*06:02 wywodzących się z NP[75].
Konflikt interesów. WHO i „konspiracje” związane z grypą pandemiczną – Deborah Cohen i Philip Carter
Transkrypt filmu ZAUFAJ WHO [Trust WHO]
Zrozumienie działania genów HLA-DQB1
Dalsze korzyści dziedzinie adwersomiki przyniosłoby zrozumienie udziału genów HLA w odpowiedzi immunologicznej wywołanej przez szczepienie, w tym AEs. Dla przykładu przypuszcza się, że główne AEs związane ze szczepionką rekombinowaną przeciwko wirusowemu zapaleniu wątroby typu B związane są z allelami/haplotypami HLA klasy II, łańcuch beta DRB1 (*01:01, *03:01, *04:01, *13:01, *15:01) oraz wzajemnym oddziaływaniem HLA klasy I A2[79]. Autorzy spekulują, że obecność określonego allelu HLA może skutkować aktywacją komórek cytotoksycznych CD8+ T przez HLA-A2 prezentujące antygeny powierzchniowe wirusowego zapalenia wątroby typu B (ang. HLA-A2 presented hepatitis B surface antigens, HbsAg) powodując wytwarzanie wysokich poziomów IFN-ɣ, TNF oraz zwiększenie liczby przypadków AEs poszczepiennych. W rzeczywistości kilka alleli/haplotypów HLA klasy II DRB1 związanych jest z brakiem odpowiedzi na szczepionkę przeciwko wirusowemu zapaleniu wątroby typu B[80,81].
Udowodniono również, że polimorfizmy HLA wiążą się z brakiem odpowiedzi i ze słabą odpowiedzią na szczepionki przeciwko odrze, śwince, różyczce i wąglikowi[82-87]. Sugeruje się, że allele HLA klasy I i klasy II związane z podatnością mogą prowadzić do wystąpienia AEs poszczepiennych w następstwie przyjęcia szczepionki przeciw wirusowemu zapaleniu wątroby typu B[79].
Zastosowanie wiedzy o zależności genotyp-fenotyp jest kluczowe dla opracowywania modeli predyspozycji genetycznych do niepożądanych odczynów poszczepiennych. Lin i in. stworzyli Ontologię Genetycznych Czynników Podatności (ang. Ontology of Genetic Susceptibility Factors, OGSF), która może dostarczyć model podatności genetycznej na AEs związane ze szczepieniem[88]. OGSF wykorzystuje badania i względy genetyczne dla różnego rodzaju czynników podatności genetycznej takich jak allele HLA, SNPs, geny i haplotypy genów i może być przydatna przy identyfikacji rzeczywistych czynników decydujących, które przyczyniają się do podatności na poszczepienne AEs.
Wyzwania badawcze w dziedzinie adwersomiki
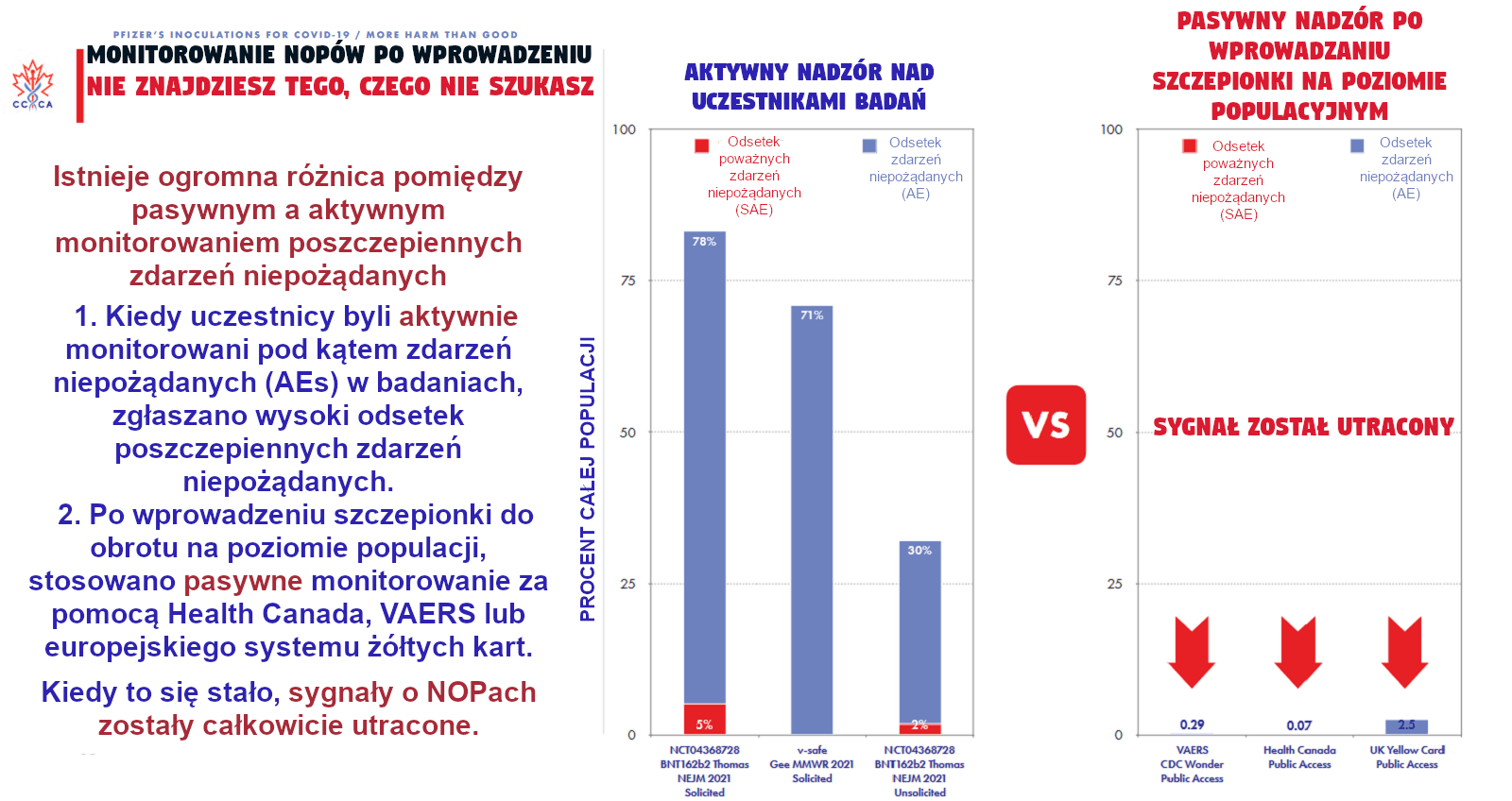
Badania w dziedzinie adwersomiki wiążą się z licznymi wyzwaniami. Po pierwsze, tak jak opisano w powyższych przykładach, wiele poszczepiennych AEs występuje bardzo rzadko. Ta niska częstotliwość sprawia, że trudno je rozpoznać i zbadać. Inaczej niż w przypadku nadwrażliwości na abacavir, która pojawiała się u 5-8% osób leczonych tym lekiem, wiele odczynów występuje w skali kilku przypadków na populację liczącą 100.000 osób (np. GBS), a niektóre pojawiają się z jeszcze niższą częstotliwością (np. choroba neurotropowa lub choroba trzewna związana ze szczepieniem przeciwko żółtej febrze). Po drugie, niejednokrotnie trudno jest udowodnić przyczynowość niepożądanego odczynu poszczepiennego. Niektóre schorzenia i objawy przypisywane szczepieniom są przypadkowe, a nie przyczynowe. Zgłaszane objawy, które nie są związane ze szczepieniem (jak w przypadku uwarunkowanej genetycznie epilepsji) mogą powodować pomyłki w analizach. Trudności, jakich nastręcza ustalenie przyczynowości sprawiają, że ciężko jest rozpoznać które wyniki faktycznie należy zbadać. Po trzecie, w niektórych krajach (na przykład w Stanach Zjednoczonych), system zgłaszania niepożądanych AEs jest pasywny. W USA niepożądane odczyny poszczepienne zgłaszane są do Systemu Zgłaszania Niepożądanych Odczynów Poszczepiennych (ang. Vaccine Adverse Event Reporting System, VAERS), który jest sponsorowanym przez CDC i FDA (ang. Food and Drug Administration, FDA) systemem monitoringu niepożądanych odczynów poszczepiennych po wprowadzeniu szczepionki na rynek.
Wiele niepożądanych odczynów poszczepiennych może nigdy nie zostać zgłoszonych, co ogranicza naszą zdolność zidentyfikowania i zbadania tych zdarzeń. Niektóre inne kraje posiadają aktywne systemy obserwacji niepożądanych odczynów poszczepiennych. Po czwarte, nie istnieje sprawnie działający system, za pomocą którego moglibyśmy uzyskać próbki od osób z udowodnionymi poszczepiennymi AEs. Powstały biobanki dla różnych stanów chorobowych, jednak takie magazyny nie istnieją obecnie dla poszczepiennych AEs.
Adwersomika a projektowanie szczepionek
Rozpoznajemy ograniczenia i wyzwania, przed którymi stoją badania w dziedzinie adwersomiki. W tym momencie jest to raczkująca dziedzina. Obecnie przeprowadzanie genotypowania u pacjenta, a następnie dobieranie konkretnej szczepionki w oparciu o te wyniki genomiczne nie jest praktyczne ani opłacalne. Co więcej, w niektórych przypadkach, tak jak pokazuje przykład narkolepsji i preparatu Pandemrix, częstotliwość występowania alleli związanych z niepożądanym odczynem poszczepiennym może być bardzo wysoka w populacji, ale tylko niewielki procent osób z tym typem HLA może doświadczyć niepożądanego odczynu poszczepiennego. Nie jesteśmy zwolennikami poddawania populacji badaniom na obecność konkretnych typów HLA, a następnie wstrzymywania szczepień tych osób w tym momencie. Szczepienia są istotne dla poszczególnych osób, ale również dla „stada”. Chociaż dostrzegamy, że medycyna spersonalizowana może nam pomóc zrozumieć i przewidywać kto jest narażony na ryzyko wystąpienia niepożądanych odczynów poszczepiennych, sugerujemy zastosowanie przy opracowywaniu szczepionek, które są bezpieczniejsze dla większej populacji i takich, które zwiększą „odporność stadną”. Bardziej skuteczne i opłacalne byłoby wykorzystanie badań w dziedzinie adwersomiki do wyjaśnienia mechanizmów podtrzymujących poszczepienne AEs i zastosowanie tej wiedzy do opracowania lub „dekompilowania” nowych szczepionek, które minimalizują lub unikają tych odczynów. Początkowe obserwacje z badań w dziedzinie adwersomiki, które zrecenzowaliśmy, sugerują, że u osób z określonym typem HLA niepożądane odczyny poszczepienne mogą występować ze zwiększoną częstotliwością. Zgodnie z tym, co sugeruje się w przypadku preparatu Pandemrix i narkolepsji, w szczepionkach mogą występować określone epitopy, które wiążą konkretne cząsteczki HLA i wyzwalają bardziej żywiołową odpowiedź zapalną skutkującą większą liczbą miejscowych i ogólnoustrojowych reakcji niepożądanych bądź rozpoznają „siebie”, co skutkuje idiosynkratycznymi reakcjami niepożądanymi.
Określone epitopy w szczepionkach mogą zniekształcić odpowiedź immunologiczną w taki sposób, że staje się ona szkodliwa zamiast pomocna. Podczas gdy w dziedzinach biologii strukturalnej i w badaniach dotyczących szczepionek w oparciu o peptydy następuje postęp, spodziewamy się, że wybrane zostaną nie tylko przypadkowe peptydy, które indukują optymalną immunogenność dla wszystkich typów HLA, ale także te, które nie rozpoznają „siebie” i przynoszą skutek w postaci niepożądanych odczynów poszczepiennych o podłożu immunologicznym. W przypadku narkolepsji i szczepionki Pandemrix, jeśli zidentyfikowane zostaną określone epitopy zależne od DQB1*0:02 wywodzące się z NP i ustalone zostanie, że są one związane z narkolepsją, wówczas, w przyszłości, racjonalny model mógłby skutkować produkcją szczepionek, w których epitopy te w ogóle by nie występowały.
Badania w dziedzinie adwersomiki wykraczają poza spersonalizowaną wakcynologię czy zrozumienie reakcji niepożądanych jedynie w niektórych grupach zaszczepionych osób. Rozważmy przykład szczepienia przeciwko zakażeniu wirusem RSV. W latach 60-tych stwierdzono, że szczepionka kandydująca przeciw RSV inaktywowana formaldehydem nasila zakażenie RSV u dzieci, które przeszły infekcję dzikim typem wirusa RSV po zaszczepieniu wspomnianą szczepionką kandydującą przeciwko RSV[89]. Późniejsze badania na modelach zwierzęcych sugerują, że infekcja nasilona przez zaszczepienie mogła być związana z wytwarzaniem przeciwciał o niskiej awidności[90] i z nierówną odpowiedzią TH2[91,92]. Badania tych niepożądanych skutków szczepień leżą u podstaw modelu opartego o strukturę nowych kandydujących szczepionek przeciwko RSV[93,94].
Niektóre znane niepożądane reakcje poszczepienne nie zostały ujęte w Tabeli 2. Rozważmy na przykład związek między szczepionką przeciwko rotawirusom Rotashield a wgłobieniem. Gdyby mechanizm kierujący tym związkiem został wyjaśniony lub gdyby można było przewidzieć kto jest narażony na ryzyko wystąpienia wgłobienia, historia szczepionek przeciw rotawirusom mogłaby inaczej się potoczyć. Być może mogłoby dojść do opracowania nowych preparatów, które w ogóle nie wywoływałyby tych niepożądanych odczynów[95]; mechanizmy te jednak nie zostały wyjaśnione. Opracowuje się nowe szczepionki i chociaż częstotliwość występowania wgłobienia jest niższa niż w przypadku szczepionki Rotashield, a korzyści wynikające ze szczepienia daleko przewyższają bardzo niskie ryzyko wgłobienia mogącego wystąpić po zaszczepieniu, obawy przed wgłobieniem po przyjęciu szczepionki przeciwko rotawirusom nadal istnieją[96-98].
Paul Offit i szczepionka przeciw rotawirusom – przypadki śmierci zgłoszone do VAERS
Rola płci w niepożądanych odczynach poszczepiennych
Niepożądane reakcje poszczepienne są zgłaszane z większą częstotliwością dla pacjentek w przypadku szczepionek przeciwko grypie[99-101], odrze-śwince-różyczce (MMR)[102-105], żółtej febrze[106] i wąglikowi[107]. Kobiety wykazują również wyższą immunogenność wielu szczepionek[108], w tym przeciwko grypie [99-101], odrze [109], śwince [84], różyczce [110], wirusowemu zapaleniu wątroby typu A[111,112], wirusowemu zapaleniu wątroby typu B[112,113] i ospie[114,115]. Mechanizmy kierujące bardziej dynamiczną odpowiedzią immunologiczną obserwowaną u pacjentek zasługują na dalsze zbadanie[26] i mogą dostarczyć wskazówek zarówno w związku z większą częstotliwością poszczepiennych AEs, jak i ze zwiększoną immunogennością szczepionek u tej płci. Sugeruje się, że różnice w reakcji na szczepionki w zależności od płci nie zależą wyłącznie od hormonów płciowych, jako że różnice te obserwuje się na wszystkich etapach życia – przed osiągnięciem zdolności reprodukcyjnej, w jej trakcie i po jej ustaniu[26,108]. Wpływ różnic genetycznych na obie płcie i rola, jaką różnice te pełnią w odmiennych odpowiedziach immunologicznych na szczepionki nie zostały w pełni wyjaśnione i dają podstawy do dalszych dociekań. Możliwe jest również, że kobiety reagują silniej na niektóre preparaty i potrzebują mniejszych dawek niż mężczyźni. Adekwatnym przykładem klinicznego badania obserwacyjnego z zastosowaniem rozmaitych metod, które dostarcza pożywki do dalszych analiz jest przeprowadzone przez CDC kliniczne badanie na ludziach szczepionki przeciwko wąglikowi adsorbowanej (ang. anthrax vaccine adsorbed, AVA)[107]. Analiza danych z tego badania wykazała, że wśród kobiet i uczestników rasy kaukaskiej wystąpił wyższy odsetek AEs spodowanych szczepionką AVA, jak również wyższa immunogenność szczepionki (tj. miana antygenów nieochronnych IgG)[92].
Rola wieku w niepożądanych odczynach poszczepiennych
Dysponujemy ograniczonymi danymi w zakresie bezpieczeństwa szczepionek i AEs w starzejącej się populacji, jako że w tej grupie wiekowej obserwuje się oznaki immunosenescencji[101,116,117]. Podczas przeglądu danych z bazy VAERS z lat 2003-2013 nie wykryto żadnych niepokojących kwestii związanych ze szczepionką MMR stosowaną u dorosłych w wieku 19 lat i starszych[118]. Jednakże możliwe jest, że w przeciwieństwie do innych szczepionek, preparat 17D przeciwko żółtej febrze jest częściej związany z AEs o podłożu trzewnym u starszych osób[58]. Współczynnik ogólnoustrojowych AEs związanych ze szczepionką przeciw żółtej febrze u osób w wieku 65 lat lub starszych był 2.5 raza wyższy niż współczynnik AEs występujących u osób młodszych (25-44 lata)[119]. Jeżeli chodzi o szczepionkę przeciwko grypie, objawy ogólnoustrojowe u starszych osób (≥ 65 lat) występowały częściej po zaszczepieniu wysokodawkową (ang. high-dose, HD) szczepionką trójwartościową inaktywowaną przeciwko grypie (180 mcg antygenu HA) w porównaniu ze standardową dawką 45 mcg[120]. Możliwe jest, że profile adwersomiczne zmieniają się z wiekiem.
Rozwój adjuwantów
W niektórych grupach panują szczególne obawy w związku z preparatami zawierającymi adjuwant i ich zdolnością wywoływania niepożądanych reakcji poszczepiennych. Utrzymuje się, że adjuwanty w szczepionkach powodują lub pogarszają rozmaite autoimmunologiczne choroby zapalne. USA pozostają w tyle za wieloma innymi krajami jeśli chodzi o zatwierdzanie różnorodnych szczepionek z adjuwantem. Ponieważ coraz więcej takich preparatów wchodzi na rynek na całym świecie, należy zwrócić szczególną uwagę na to czy są one związane z niepożądanymi odczynami poszczepiennymi. Jeżeli obserwuje się niepożądane odczyny poszczepienne, konieczne jest wówczas przeprowadzenie dalszych badań, aby ustalić czy niepożądany odczyn związany jest z adjuwantem, antygenami w szczepionce czy też kombinacją adjuwantu i antygenów.
Współpraca międzynarodowa
Aby w dziedzinie adwersomiki mógł nastąpić postęp, konieczne jest nawiązanie międzynarodowych stosunków partnerskich pomiędzy klinicystami, urzędnikami publicznej opieki zdrowotnej oraz naukowcami prowadzącymi badania kliniczne, translacyjne i podstawowe. Z myślą o pokonaniu niektórych bieżących wyzwań w tej dziedzinie, proponujemy stworzenie jednoczącego zaplecza służącego monitorowaniu poszczepiennych AEs, zabieganiu o próbki biologiczne od pacjentów, którzy doświadczają tych AEs oraz zachowaniu „biobanku” tych próbek do badań. W USA działają liczne agencje badające i monitorujące poszczepienne AEs oraz bezpieczeństwo szczepionek, takie jak CDC, Jednostka do spraw Analizy Szczepionek w Ministerstwie Obrony (ang. Department of Defense, DOD), Ośrodek do spraw Ocen Biologicznych i Badań (ang. Center for Biologics Evaluation and Research, CBER) należący do FDA, Agencja Wojskowa do spraw Szczepień (ang. Military Vaccine Agency, MILVAX) należąca do DOD oraz indywidualni producenci[25]. Sugerujemy stworzenie szerszego, złożonego z kilku części i bardziej spójnego zaplecza. Nadzór nad tą inicjatywą musi być skoordynowany i należy ponadto zbudować infrastrukturę dla tej inicjatywy, lecz nie można na tym poprzestać.
Zgodnie z tym, o czym codziennie nam się przypomina, zwłaszcza w odniesieniu do transmisji infekcji pomiędzy krajami i kontynentami, żyjemy w społeczeństwie globalnym. Aby ustalić współczynniki, związki, przyczynowość i mechanizmy kierujące poszczepiennymi AEs, w szczególności występującymi rzadko, potrzebne są starania międzynarodowych zespołów nadzorujących, klinicznych i naukowych, które pracowałyby wspólnie dla wyjaśnienia tych odczynów. The Brighton Network[121] i Global Vaccine Safety Initiative w ramach WHO[122] są przykładem zespołowych sieci międzynarodowych koncentrujących się na badaniach bezpieczeństwa szczepionek. Takie międzynarodowe sieci zespołowe mogłyby służyć jako platformy do badań w dziedzinie adwersomiki. Dzięki połączeniu zasięgu badań klinicznych, translacyjnych i podstawowych na całym świecie w celu osiągnięcia postępu w dziedzinie adwersomiki, uzyskamy nową wiedzę, która może pomóc zidentyfikować indywidualne czynniki ryzyka, zwiększyć nasze zrozumienie mechanizmów immunologicznych oraz zdefiniować biomarkery ryzyka i odporności, co z kolei może przyjść przy projektowaniu nowych szczepionek, testów diagnostycznych i metod terapeutycznych chroniących ludzi przed chorobami zakaźnymi.
Komentarz ekspertów i wytyczne na najbliższe pięć lat
Przyszłe kierunki badań w dziedzinie adwersomiki obejmują zrozumienie roli biologicznej płci żeńskiej w poszczepiennych AEs, jako że u kobiet AEs po szczepieniu występują niejednokrotnie z większą częstotliwością, ocenę wieku oraz immunosenescencji jako czynników ryzyka wystąpienia poszczepiennych AEs, dokładne przyjrzenie się roli, jaką odgrywają adjuwanty oraz ustanowienie międzynarodowej współpracy i stworzenie biobanków służących wspomnianym badaniom.
Ponadto, nadzieją, jaką daje adwersomiki jest umożliwienie zrozumienia mechanizmów kierujących niepożądanymi odczynami poszczepiennymi w celu poprawy bezpieczeństwa szczepień i spersonalizowania naszego podejścia – oferowania właściwego preparatu we właściwej dawce we właściwym czasie właściwej osobie. Podejście takie zapewnia zarówno bezpieczeństwo, jak i korzyści ekonomiczne. Takie mechanicystyczne informacje mogą również dawać podstawy do podejmowania prób służących odkrywaniu nowych szczepionek.
Aby adwersomika przestała być raczkującą dziedziną, w ciągu najbliższych pięciu lat naukowcy z dziedziny badań translacyjnych będą musieli współpracować; trzeba będzie rozpoznać i dokładnie zbadać poszczepienne AEs wykazujące związek przyczynowy z aktualnie licencjonowanymi preparatami; konieczne będzie stworzenie międzynarodowych biobanków z próbkami od osób z AEs związanymi ze szczepieniem oraz będzie trzeba przeprowadzić badania immunogenetyczne i z zakresu biologii systemów, w których wykorzystane zostaną te próbki. Technologie stosowane w dziedzinie omiki nadal będą wykorzystywane i rozwijane. Podobnie będzie się musiało stać z naszym sposobem myślenia i metodami badawczymi, jeżeli naszą aspiracją jest racjonalne opracowywanie szczepionek o większej immunogenności i skuteczności przy jednoczesnym minimalizowaniu odczynów niepożądanych.
Kluczowe zagadnienia
- Adwersomika oznacza zastosowanie podejść z dziedziny immunogenomiki i z zakresu biologii systemów w celu zrozumienia genetycznych i niegenetycznych sił napędowych niepożądanych reakcji poszczepiennych na poziomie molekularnym.
- Zrozumienie i zapobieganie poważnym niepożądanym reakcjom poszczepiennym jest decydujące dla wzmocnienia zaufania publicznego do bezpieczeństwa szczepień i umożliwienia opracowywania nowych bezpiecznych i skutecznych szczepionek.
- Immunogenność szczepionek i niepożądane odczyny poszczepienne zgłaszane są z większą częstotliwością dla kobiet niż mężczyzn w przypadku licznych preparatów: spostrzeżenie to daje podstawy do dalszej oceny.
- Dla rozwoju dziedziny adwersomiki konieczne są jest nawiązanie międzynarodowych stosunków partnerskich pomiędzy klinicystami, urzędnikami publicznej opieki zdrowotnej, epidemiologami oraz naukowcami prowadzącymi badania kliniczne, translacyjne i podstawowe.
- W celu prowadzenia dalszych badań w dziedzinie adwersomiki konieczne jest stworzenie międzynarodowego biobanku z próbkami od pacjentów doświadczających niepożądanych odczynów poszczepiennych.
Bibliografia:
1. Centers of Disease Control and Prevention. Ten great public health achievements–United States, 1900–1999. MMWR Morb.Mortal.Wkly Rep. 1999;48(12):241–243. [PubMed] [Google Scholar]
2. Poland GA, Jacobson RM. The age-old struggle against the antivaccinationists. N.Engl.J Med. 2011;364(2):97–99. [PubMed] [Google Scholar]
3. Tafuri S, Gallone MS, Cappelli MG, Martinelli D, Prato R, Germinario C. Addressing the anti-vaccination movement and the role of HCWs. Vaccine. 2014;32(38):4860–4865. [PubMed] [Google Scholar]
4. Poland GA, Jacobson RM. The clinician’s guide to the anti-vaccinationists’ galaxy. Human Immunology. 2012;73(8):859–866. [PubMed] [Google Scholar]
5. Poland GA, Jacobson RM, Ovsyannikova IG. Trends affecting the future of vaccine development and delivery: The role of demographics, regulatory science, the anti-vaccine and consumer culture and vaccinomics. Vaccine. 2009;27(25–26 Special Issue SI):3240–3244. [PMC free article] [PubMed] [Google Scholar]
6. Larson HJ, Jarrett C, Eckersberger E, Smith DM, Paterson P. Understanding vaccine hesitancy around vaccines and vaccination from a global perspective: a systematic review of published literature, 2007–2012. Vaccine. 2014;32(19):2150–2159. [PubMed] [Google Scholar]
7. Dube E, Gagnon D, Nickels E, Jeram S, Schuster M. Mapping vaccine hesitancy-Country-specific characteristics of a global phenomenon. Vaccine. 2014;32(49):6649–6654. [PMC free article] [PubMed] [Google Scholar]
8. Larson HJ, Smith DM, Paterson P, et al. Measuring vaccine confidence: analysis of data obtained by a media surveillance system used to analyse public concerns about vaccines. The Lancet. Infect Dis. 2013;13(7):606–613. [PubMed] [Google Scholar]
9. Ropeik D. How society should respond to the risk of vaccine rejection. Hum Vaccin Immunother. 2013;9(8):1815–1818. [PMC free article] [PubMed] [Google Scholar]
10. Salmon DA, Moulton LH, Omer SB, deHart MP, Stokley S, Halsey NA. Factors associated with refusal of childhood vaccines among parents of school-aged children: a case-control study. Arch Pediat Adolesc Med. 2005;159(5):470–476. [PubMed] [Google Scholar]
11. Amanna I, Slifka MK. Public fear of vaccination: separating fact from fiction. Viral Immunol. 2005;18(2):307–315. [PubMed] [Google Scholar]
12. Salmon DA, Sotir MJ, Pan WK, et al. Parental vaccine refusal in Wisconsin: a case-control study. WMJ. 2009;108(1):17–23. [PMC free article] [PubMed] [Google Scholar]
13. Poland GA, Jacobson RM. Understanding those who do not understand: a brief review of the anti-vaccine movement. Vaccine. 2001;19:2440–2445. [PubMed] [Google Scholar]
14. Ruggeberg JU, Gold MS, Bayas JM, et al. Anaphylaxis: case definition and guidelines for data collection, analysis, and presentation of immunization safety data. Vaccine. 2007;25(31):5675–5684. [PubMed] [Google Scholar]
15. Atkinson W, Wolfe C, Hamborsky J, editors. Centers for Disease Control and Prevention. Epidemiology and Prevention of Vaccine-Preventable Diseases. Washington, D.C.: Public Health Foundation; 2012. [Google Scholar]
16. World Health Organization. [Date accessed, February 4, 2015];Causality Assessment of an Adverse Event Following Immunization (AEFI) 2013 http://www.who.int/vaccine_safety/publications/gvs_aefi/en/
17. Tozzi AE, Asturias EJ, Balakrishnan MR, Halsey NA, Law B, Zuber PL. Assessment of causality of individual adverse events following immunization (AEFI): a WHO tool for global use. Vaccine. 2013;31(44):5041–5046. [PubMed] [Google Scholar]
18. Poland GA, Kennedy RB, McKinney BA, et al. Vaccinomics, adversomics, and the immune response network theory: Individualized vaccinology in the 21st century. Semin Immunol. 2013;25(2):89–103. [PMC free article] [PubMed] [Google Scholar] ** This article provides a review on the applications of vaccinomics and its application to studying vaccine adverse events (adversomics).
19. Haralambieva IH, Poland GA. Vaccinomics, predictive vaccinology and the future of vaccine development. Future Microbiol. 2010;5:1757–1760. [PubMed] [Google Scholar]
20. Poland GA, Ovsyannikova IG, Kennedy RB, Haralambieva IH, Jacobson RM. Vaccinomics and a new paradigm for the development of preventive vaccines against viral infections. Omics. 2011;15(9):625–636. [PMC free article] [PubMed] [Google Scholar]
21. Poland GA, Oberg AL. Vaccinomics and bioinformatics: accelerants for the next golden age of vaccinology. Vaccine. 2010;28(20):3509–3510. [PMC free article] [PubMed] [Google Scholar]
22. Poland GA, Ovsyannikova IG, Jacobson RM. Application of pharmacogenomics to vaccines. Pharmacogenomics. 2009;10(5):837–852. [PMC free article] [PubMed] [Google Scholar]
23. Poland GA. Pharmacology, vaccinomics, and the second golden age of vaccinology. Clin Pharmacol Ther. 2007;82(6):623–626. [PubMed] [Google Scholar] ** This paper summarizes the new vaccinomics approach for vaccine development.
24. Poland GA, Ovsyannikova IG, Jacobson RM, Smith DI. Heterogeneity in vaccine immune response: the role of immunogenetics and the emerging field of vaccinomics. Clin Pharmacol Ther. 2007;82(6):653–664. [PubMed] [Google Scholar]
25. Poland GA. Vaccidents and adversomics. Vaccine. 2010;28(40):6549–6550. [PubMed] [Google Scholar] ** This article provides a rationale for the development of the adversomics field.
26. Klein SL, Poland GA. Personalized vaccinology: one size and dose might not fit both sexes. Vaccine. 2013;31(23):2599–2600. [PubMed] [Google Scholar]
27. Hetherington S, McGuirk S, Powell G, et al. Hypersensitivity reactions during therapy with the nucleoside reverse transcriptase inhibitor abacavir. Clin Ther. 2001;23(10):1603–1614. [PubMed] [Google Scholar]
28. Mallal S, Nolan D, Witt C, et al. Association between presence of HLA-B*5701, HLA-DR7, and HLA-DQ3 and hypersensitivity to HIV-1 reverse-transcriptase inhibitor abacavir. Lancet. 2002;359(9308):727–732. [PubMed] [Google Scholar]
29. Hetherington S, Hughes AR, Mosteller M, et al. Genetic variations in HLA-B region and hypersensitivity reactions to abacavir. Lancet. 2002;359:1121–1122. [PubMed] [Google Scholar]
30. Rauch A, Nolan D, Martin A, McKinnon E, Almeida C, Mallal S. Prospective genetic screening decreases the incidence of abacavir hypersensitivity reactions in the Western Australian HIV cohort study. Clin Infect Dis. 2006;43(1):99–102. [PubMed] [Google Scholar]
31. Mallal S, Phillips E, Carosi G, et al. HLA-B*5701 screening for hypersensitivity to abacavir. N Engl J Med. 2008;358(6):568–579. [PubMed] [Google Scholar]
32. Ostrov DA, Grant BJ, Pompeu YA, et al. Drug hypersensitivity caused by alteration of the MHC-presented self-peptide repertoire. Proc Natl Acad Sci USA. 2012;109(25):9959–9964. [PMC free article] [PubMed] [Google Scholar]
33. Illing PT, Vivian JP, Dudek NL, et al. Immune self-reactivity triggered by drug-modified HLA-peptide repertoire. Nature. 2012;486(7404):554–558. [PubMed] [Google Scholar]
34. Martin AM, Nolan D, Gaudieri S, et al. Predisposition to abacavir hypersensitivity conferred by HLA-B*5701 and a haplotypic Hsp70-Hom variant. Proc Natl Acad Sci USA. 2004;101(12):4180–4185. [PMC free article] [PubMed] [Google Scholar]
35. Almeida CA, Martin AM, Nolan D, et al. Cytokine profiling in abacavir hypersensitivity patients. Antivir Ther. 2008;13(2):281–288. [PubMed] [Google Scholar]
36. Panel on Antiretroviral Guidelines for Adults and Adolescnets. Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents. [Date accessed, December 4, 2014];Department of Health and Human Services. http://aidsinfo.nih.gov/contentfiles/lvguidelines/AdultandAdolescentGL.pdf.
37. Gunthard HF, Aberg JA, Eron JJ, et al. Antiretroviral treatment of adult HIV infection: 2014 recommendations of the International Antiviral Society-USA Panel. JAMA. 2014;312(4):410–425. [PubMed] [Google Scholar]
38. Chessman D, Kostenko L, Lethborg T, et al. Human leukocyte antigen class I-restricted activation of CD8+ T cells provides the immunogenetic basis of a systemic drug hypersensitivity. Immunity. 2008;28(6):822–832. [PubMed] [Google Scholar]
39. Poland GA, Ovsyannikova IG, Jacobson RM. Adversomics: the emerging field of vaccine adverse event immunogenetics. Pediatr Infect Dis J. 2009;28(5):431–432. [PMC free article] [PubMed] [Google Scholar] * Important editorial commentary regarding the genetic predisposition for adverse events after vaccination.
40. Verbeek NE, Jansen FE, Vermeer-de Bondt PE, et al. Etiologies for seizures around the time of vaccination. Pediatrics. 2014;134(4):658–666. [PubMed] [Google Scholar] * This study demonstrates that genetic and structural defects may trigger epileptic seizures after vaccination.
41. Berkovic SF, Harkin L, McMahon JM, et al. De-novo mutations of the sodium channel gene SCN1A in alleged vaccine encephalopathy: a retrospective study. Lancet Neurol. 2006;5(6):488–492. [PubMed] [Google Scholar]
42. Casey CG, Iskander JK, Roper MH, et al. Adverse events associated with smallpox vaccination in the United States, January-October 2003. JAMA. 2005;294(21):2734–2743. [PubMed] [Google Scholar]
43. Poland GA, Neff JM. Smallpox vaccine: problems and prospects. Immunol Allergy Clin North Am. 2003;23(4):731–743. [PubMed] [Google Scholar]
44. Reif DM, McKinney BA, Motsinger AA, et al. Genetic basis for adverse events after smallpox vaccination. J Infect Dis. 2008;198(1):16–22. [PMC free article] [PubMed] [Google Scholar] ** This replication study identifies SNPs in the MTHFR and IRF1 genes that are associated with systemic adverse events after smallpox vaccine.
45. Urano W, Taniguchi A, Yamanaka H, et al. Polymorphisms in the methylenetetrahydrofolate reductase gene were associated with both the efficacy and the toxicity of methotrexate used for the treatment of rheumatoid arthritis, as evidenced by single locus and haplotype analyses. Pharmacogenetics. 2002;12(3):183–190. [PubMed] [Google Scholar]
46. El-Khodary NM, El-Haggar SM, Eid MA, Ebeid EN. Study of the pharmacokinetic and pharmacogenetic contribution to the toxicity of high-dose methotrexate in children with acute lymphoblastic leukemia. Med Oncol. 2012;29(3):2053–2062. [PubMed] [Google Scholar]
47. Poland GA, Grabenstein JD, Neff JM. The US smallpox vaccination program: a review of a large modern era smallpox vaccination implementation program. Vaccine. 2005;23(17–18):2078–2081. [PubMed] [Google Scholar]
48. Halsell JS, Riddle JR, Atwood JE, et al. Myopericarditis following smallpox vaccination among vaccinia-naive US military personnel. Jama. 2003;289:3283–3289. [PubMed] [Google Scholar]
49. Wilson CB, Marcuse EK. Vaccine safety–vaccine benefits: science and the public’s perception. Nat Rev Immunol. 2001;1(2):160–165. [PubMed] [Google Scholar]
50. Ovsyannikova IG, Kennedy RB, O’Byrne M, Jacobson RM, Pankratz VS, Poland GA. Genome-wide association study of antibody response to smallpox vaccine. Vaccine. 2012;30(28):4182–4189. [PMC free article] [PubMed] [Google Scholar]
51. Kennedy RB, Ovsyannikova IG, Pankratz VS, et al. Genome-wide genetic associations with IFNgamma response to smallpox vaccine. Hum Gen. 2012;131(9):1433–1451. [PMC free article] [PubMed] [Google Scholar]
52. Ovsyannikova IG, Pankrantz VS, Salk HM, Kennedy RB, Poland GA. HLA alleles associated with the adaptive immune response to smallpox vaccine: a replication study. Hum Gen. 2014;133(9):1083–1092. [PMC free article] [PubMed] [Google Scholar] * This paper demonstrates a basis for the genetic contribution to smallpox vaccine response.
53. Stanley SL, Jr, Frey SE, Taillon-Miller P, et al. The immunogenetics of smallpox vaccination. J Infect Dis. 2007;196(2):212–219. [PubMed] [Google Scholar] * This study demonstrates that fever after smallpox vaccination is associated with IL1, IL4, and IL18 gene polymorphisms.
54. Lim BK, Choe SC, Shin JO, et al. Local expression of interleukin-1 receptor antagonist by plasmid DNA improves mortality and decreases myocardial inflammation in experimental coxsackieviral myocarditis. Circulation. 2002;105(11):1278–1281. [PubMed] [Google Scholar]
55. Nakashima H, Miyake K, Inoue Y, et al. Association between IL-4 genotype and IL-4 production in the Japanese population. Genes Immun. 2002;3(2):107–109. [PubMed] [Google Scholar]
56. Nelms K, Keegan AD, Zamorano J, Ryan JJ, Paul WE. The IL-4 receptor: signaling mechanisms and biologic functions. Annu Rev Immunol. 1999;17:701–738. [PubMed] [Google Scholar]
57. Ovsyannikova IG, Haralambieva IH, Kennedy RB, et al. Impact of cytokine and cytokine receptor gene polymorphisms on cellular immunity after smallpox vaccination. Gene. 2012;510:59–65. [PMC free article] [PubMed] [Google Scholar]
58. Pulendran B, Miller J, Querec TD, et al. Case of yellow fever vaccine–associated viscerotropic disease with prolonged viremia, robust adaptive immune responses, and polymorphisms in CCR5 and RANTES genes. J Infect Dis. 2008;198(4):500–507. [PMC free article] [PubMed] [Google Scholar]
59. Kitchener S. Viscerotropic and neurotropic disease following vaccination with the 17D yellow fever vaccine, ARILVAX. Vaccine. 2004;22(17–18):2103–2105. [PubMed] [Google Scholar]
60. Bae HG, Domingo C, Tenorio A, et al. Immune response during adverse events after 17D–derived yellow fever vaccination in Europe. J Infect Dis. 2008;197(11):1577–1584. [PubMed] [Google Scholar]
61. Martins MA, Silva ML, Marciano AP, et al. Activation/modulation of adaptive immunity emerges simultaneously after 17DD yellow fever first-time vaccination: is this the key to prevent severe adverse reactions following immunization? Clin Exper Immunol. 2007;148(1):90–100. [PMC free article] [PubMed] [Google Scholar]
62. Kwong JC, Vasa PP, Campitelli MA, et al. Risk of Guillain-Barre syndrome after seasonal influenza vaccination and influenza health-care encounters: a self-controlled study. Lancet Infect Dis. 2013;13(9):769–776. [PubMed] [Google Scholar]
63. Schonberger LB, Bregman DJ, Sullivan-Bolyai JZ, et al. Guillain-Barre syndrome following vaccination in the National Influenza Immunization Program, United States, 1976–1977. Am J Epidemiol. 1979;110(2):105–123. [PubMed] [Google Scholar]
64. Haber P, DeStefano F, Angulo FJ, et al. Guillain-Barre syndrome following influenza vaccination. JAMA. 2004;292(20):2478–2481. [PubMed] [Google Scholar]
65. Prasad KN, Nyati KK, Verma A, Rizwan A, Paliwal VK. Tumor necrosis factor-alpha polymorphisms and expression in Guillain-Barre syndrome. Hum Immunol. 2010;71(9):905–910. [PubMed] [Google Scholar]
66. Nyati KK, Prasad KN, Verma A, et al. Association of TLR4 Asp299Gly and Thr399Ile polymorphisms with Guillain-Barre syndrome in Northern Indian population. J Neuroimmunol. 2010;218(1–2):116–119. [PubMed] [Google Scholar]
67. Sang D, Chen Q, Liu X, et al. Fc receptor like 3 in Chinese patients of Han nationality with Guillain-Barre syndrome. J Neuroimmunol. 2012;246(1–2):65–68. [PubMed] [Google Scholar]
68. Geleijns K, Emonts M, Laman JD, et al. Genetic polymorphisms of macrophage-mediators in Guillain-Barre syndrome. J Neuroimmunol. 2007;190(1–2):127–130. [PubMed] [Google Scholar]
69. Nohynek H, Jokinen J, Partinen M, et al. AS03 adjuvanted AH1N1 vaccine associated with an abrupt increase in the incidence of childhood narcolepsy in Finland. PLos ONE. 2012;7(3):33536. [PMC free article] [PubMed] [Google Scholar]
70. Partinen M, Saarenpaa-Heikkila O, Ilveskoski I, et al. Increased incidence and clinical picture of childhood narcolepsy following the 2009 H1N1 pandemic vaccination campaign in Finland. PLos ONE. 2012;7(3):33723. [PMC free article] [PubMed] [Google Scholar]
71. Szakacs A, Darin N, Hallbook T. Increased childhood incidence of narcolepsy in western Sweden after H1N1 influenza vaccination. Neurology. 2013;80(14):1315–1321. [PubMed] [Google Scholar]
72. Fontana A, Gast H, Reith W, Recher M, Birchler T, Bassetti CL. Narcolepsy: autoimmunity, effector T cell activation due to infection, or T cell independent, major histocompatibility complex class II induced neuronal loss? Brain. 2010;133(Pt 5):1300–1311. [PubMed] [Google Scholar]
73. Dauvilliers Y, Arnulf I, Mignot E. Narcolepsy with cataplexy. Lancet. 2007;369(9560):499–511. [PubMed] [Google Scholar]
74. Hor H, Kutalik Z, Dauvilliers Y, et al. Genome-wide association study identifies new HLA class II haplotypes strongly protective against narcolepsy. Nat Genetics. 2010;42(9):786–789. [PubMed] [Google Scholar]
75. Vaarala O, Vuorela A, Partinen M, et al. Antigenic Differences between AS03 Adjuvanted Influenza A (H1N1) Pandemic Vaccines: Implications for Pandemrix-Associated Narcolepsy Risk. PLos ONE. 2014;9(12):114361. [PMC free article] [PubMed] [Google Scholar]
76. Julkunen I, Partinen M. Neuroimmunology: Disease mechanisms in narcolepsy remain elusive. Nat Rev Neurol. 2014;10(11):616–617. [PubMed] [Google Scholar]
77. Underwood EImmunology. Key narcolepsy-influenza vaccine findings retracted. Science. 2014;345(6196):498. [PubMed] [Google Scholar]
78. Ahmed SS, Schur PH, MacDonald NE, Steinman L. Narcolepsy, 2009 A(H1N1) pandemic influenza, and pandemic influenza vaccinations: what is known and unknown about the neurological disorder, the role for autoimmunity, and vaccine adjuvants. J Autoimmun. 2014;50:1–11. [PubMed] [Google Scholar]
79. Miller JD, Whitehair LH. Concurrent HLA-related response factors mediate recombinant hepatitis B vaccine major adverse events. Autoimmunity. 2005;38(2):181–194. [PubMed] [Google Scholar]
80. Hohler T, Meyer CU, Notghi A, et al. The influence of major histocompatibility complex class II genes and T-cell Vbeta repertoire on response to immunization with HBsAg. Hum Immunol. 1998;59(4):212–218. [PubMed] [Google Scholar]
81. Pan L, Zhang L, Zhang W, et al. A genome-wide association study identifies polymorphisms in the HLA-DR region associated with non-response to hepatitis B vaccination in Chinese Han populations. Hum Mol Genet. 2014;23(8):2210–9. [PubMed] [Google Scholar]
82. Poland GA, Ovsyannikova IG, Jacobson RM, et al. Identification of an association between HLA class II alleles and low antibody levels after measles immunization. Vaccine. 2001;20(3–4):430–438. [PubMed] [Google Scholar]
83. St Sauver JL, Ovsyannikova IG, Jacobson RM, et al. Associations between human leukocyte antigen homozygosity and antibody levels to measles vaccine. J Infect Dis. 2002;185(11):1545–1549. [PubMed] [Google Scholar]
84. Ovsyannikova IG, Jacobson RM, Dhiman N, Vierkant RA, Pankratz VS, Poland GA. Human leukocyte antigen and cytokine receptor gene polymorphisms associated with heterogeneous immune responses to mumps viral vaccine. Pediatrics. 2008;121(5):e1091–e1099. [PMC free article] [PubMed] [Google Scholar]
85. Ovsyannikova IG, Jacobson RM, Vierkant RA, O’Byrne MM, Poland GA. Replication of rubella vaccine population genetic studies: validation of HLA genotype and humoral response associations. Vaccine. 2009;27(49):6926–6931. [PMC free article] [PubMed] [Google Scholar]
86. Pajewski NM, Parker SD, Poland GA, et al. The role of HLA-DR-DQ haplotypes in variable antibody responses to anthrax vaccine adsorbed. Genes Immun. 2011;12(6):457–465. [PMC free article] [PubMed] [Google Scholar]
87. Ovsyannikova IG, Pankratz VS, Vierkant RA, et al. Human leukocyte antigens and cellular immune responses to anthrax vaccine adsorbed. Infect Immun. 2013;81(7):2584–2591. [PMC free article] [PubMed] [Google Scholar]
88. Lin Y, He Y. The ontology of genetic susceptibility factors (OGSF) and its application in modeling genetic susceptibility to vaccine adverse events. J Biomed Semantics. 2014;5:19. [PMC free article] [PubMed] [Google Scholar]
89. Kim HW, Canchola JG, Brandt CD, et al. Respiratory syncytial virus disease in infants despite prior administration of antigenic inactivated vaccine. Am J Epidemiol. 1969;89(4):422–434. [PubMed] [Google Scholar]
90. Delgado MF, Coviello S, Monsalvo AC, et al. Lack of antibody affinity maturation due to poor Toll-like receptor stimulation leads to enhanced respiratory syncytial virus disease. Nat Med. 2009;15(1):34–41. [PMC free article] [PubMed] [Google Scholar]
91. Graham BS. Biological challenges and technological opportunities for respiratory syncytial virus vaccine development. Immunol Rev. 2011;239(1):149–166. [PMC free article] [PubMed] [Google Scholar]
92. Graham BS, Henderson GS, Tang YW, Lu X, Neuzil KM, Colley DG. Priming immunization determines T helper cytokine mRNA expression patterns in lungs of mice challenged with respiratory syncytial virus. J Immunol. 1993;151:2032–2040. [PubMed] [Google Scholar]
93. McLellan JS, Correia BE, Chen M, et al. Design and characterization of epitope-scaffold immunogens that present the motavizumab epitope from respiratory syncytial virus. J Mol Biol. 2011;409(5):853–866. [PMC free article] [PubMed] [Google Scholar]
94. Correia BE, Bates JT, Loomis RJ, et al. Proof of principle for epitope-focused vaccine design. Nature. 2014;507(7491):201–206. [PMC free article] [PubMed] [Google Scholar]
95. Cale CM, Klein NJ. The link between rotavirus vaccination and intussusception: implications for vaccine strategies. Gut. 2002;50(1):11–12. [PMC free article] [PubMed] [Google Scholar]
96. Haber P, Patel M, Pan Y, et al. Intussusception after rotavirus vaccines reported to US VAERS, 2006–2012. Pediatrics. 2013;131(6):1042–1049. [PubMed] [Google Scholar]
97. Carlin JB, Macartney KK, Lee KJ, et al. Intussusception risk and disease prevention associated with rotavirus vaccines in Australia’s National Immunization Program. Clin Infect Dis. 2013;7(10):1427–1434. [PubMed] [Google Scholar]
98. Weintraub ES, Baggs J, Duffy J, et al. Risk of intussusception after monovalent rotavirus vaccination. N Engl J Med. 2014;70(6):513–519. [PubMed] [Google Scholar]
99. Klein SL, Pekosz A. Sex-based biology and the rational design of influenza vaccination strategies. J Infect Dis. 2014;09(Suppl 3):114–119. [PMC free article] [PubMed] [Google Scholar]
100. Beyer WE, Palache AM, Kerstens R, Masurel N. Gender differences in local and systemic reactions to inactivated influenza vaccine, established by a meta-analysis of fourteen independent studies. Eur J Clin Microbiol Infect Dis. 1996;15(1):65–70. [PubMed] [Google Scholar]
101. Engler RJ, Nelson MR, Klote MM, et al. Half- vs full-dose trivalent inactivated influenza vaccine (2004–2005): age, dose, and sex effects on immune responses. Arch Intern Med. 2008;168(22):2405–2414. [PubMed] [Google Scholar]
102. Weber SK, Schlagenhauf P. Childhood vaccination associated adverse events by sex: a literature review. Travel Med Infect Dis. 2014;12(5):459–480. [PubMed] [Google Scholar]
103. Shohat T, Manfred SG, Orly N, et al. Gender differences in the reactogenicity of measles-mumps-rubella vaccine. Isr Med Assoc J. 2000;2:192–195. [PubMed] [Google Scholar]
104. Benjamin CM, Chew GC, Silman AJ. Joint and limb symptoms in children after immunisation with measles, mumps, and rubella vaccine. Brit Med J. 1992;304(6834):1075–1078. [PMC free article] [PubMed] [Google Scholar]
105. Khalil MK, Al-Mazrou YY, Al-Ghamdi YS, Tumsah S, Al-Jeffri M, Meshkhas A. Effect of gender on reporting of MMR adverse events in Saudi Arabia. East Mediterr Health J. 2003;9(1–2):152–158. [PubMed] [Google Scholar]
106. Lindsey NP, Schroeder BA, Miller ER, et al. Adverse event reports following yellow fever vaccination. Vaccine. 2008;26(48):6077–6082. [PubMed] [Google Scholar]
107. Pondo T, Rose CE, Jr, Martin SW, et al. Evaluation of sex, race, body mass index and pre-vaccination serum progesterone levels and post-vaccination serum anti-anthrax protective immunoglobulin G on injection site adverse events following anthrax vaccine adsorbed (AVA) in the CDC AVA human clinical trial. Vaccine. 2014;2(28):3548–3554. [PMC free article] [PubMed] [Google Scholar]
108. Klein SL, Jedlicka A, Pekosz A. The Xs and Y of immune responses to viral vaccines. Lancet Infect Dis. 2010;10(5):338–349. [PMC free article] [PubMed] [Google Scholar] ** This is a review that outlines the dfferences in vaccine immunogenicity and adverse events between the sexes.
109. Umlauf BJ, Haralambieva IH, Ovsyannikova IG, et al. Associations between demographic variables and multiple measles-specific innate and cell-mediated immune responses after measles vaccination. Viral Immunol. 2012;25(1):29–36. [PMC free article] [PubMed] [Google Scholar]
110. Ovsyannikova IG, Jacobson RM, Vierkant RA, Jacobsen SJ, Pankratz VS, Poland GA. The contribution of HLA class I antigens in immune status following two doses of rubella vaccination. Hum Immunol. 2004;65:1506–1515. [PubMed] [Google Scholar]
111. Chen XQ, Bulbul M, de Gast GC, van Loon AM, Nalin DR, van Hattum J. Immunogenicity of two versus three injections of inactivated hepatitis A vaccine in adults. J Hepatol. 1997;26(2):260–264. [PubMed] [Google Scholar]
112. Van der Wielen M, Van Damme P, Chlibek R, Smetana J, von Sonnenburg F. Hepatitis A/B vaccination of adults over 40 years old: comparison of three vaccine regimens and effect of influencing factors. Vaccine. 2006;4(26):5509–5515. [PubMed] [Google Scholar]
113. Bock HL, Kruppenbacher J, Sanger R, Hobel W, Clemens R, Jilg W. Immunogenicity of a recombinant hepatitis B vaccine in adults. Arch Intern Med. 1996;156(19):2226–2231. [PubMed] [Google Scholar]
114. Haralambieva IH, Ovsyannikova IG, Kennedy RB, Larrabee BR, Shane Pankratz V, Poland GA. Race and sex-based differences in cytokine immune responses to smallpox vaccine in healthy individuals. Hum Immunol. 2013;74(10):1263–1266. [PMC free article] [PubMed] [Google Scholar]
115. Kennedy RB, Ovsyannikova IG, Pankratz VS, et al. Gender effects on humoral immune responses to smallpox vaccine. Vaccine. 2009;27(25–26):3319–3323. [PMC free article] [PubMed] [Google Scholar]
116. Doria G, Frasca D. Genetic factors in immunity and aging. Vaccine. 2000;18(16):1591–1595. [PubMed] [Google Scholar]
117. Gardner EM, Gonzalez EW, Nogusa S, Murasko DM. Age-related changes in the immune response to influenza vaccination in a racially diverse, healthy elderly population. Vaccine. 2006;24(10):1609–1614. [PubMed] [Google Scholar]
118. Sukumaran L, Mcneil MM, Lewis P, Moro P, Shimabukuro T. Adverse events following measles, mumps, and rubella (MMR) vaccine in adults reported to the Vaccine Adverse Events Reporting System, 2003–2013. San Diego, CA: ID Week meeting; 2014. Abstract 1077. [PMC free article] [PubMed] [Google Scholar]
119. Martin M, Weld LH, Tsai TF, et al. Advanced age a risk factor for illness temporally associated with yellow fever vaccination. Emerg Infect Dis. 2001;7(6):945–951. [PMC free article] [PubMed] [Google Scholar]
120. Falsey AR, Treanor JJ, Tornieporth N, Capellan J, Gorse GJ. Randomized, double-blind controlled phase 3 trial comparing the immunogenicity of high-dose and standard-dose influenza vaccine in adults 65 years of age and older. RJ Infect Dis. 2009;200(2):172–180. [PubMed] [Google Scholar]
121. Brighton Collaboration. [Date accessed, February 4, 2015];Immunize Safely. 2015 https://brightoncollaboration.org/public.
122. World Health Organization. [Date accessed, February 4, 2015];Global Vaccine Safety Initiative. 2015 http://www.who.int/vaccine_safety/en/