Dr Jacob Puliyel: ocena związku przyczynowo skutkowego dla Niepożądanych Odczynów Poszczepiennych [NOP-ów]. Skorygowana ocena związku przyczynowo-skutkowego między szczepieniami a zdarzeniami niepożądanymi dokonana przez Światową Organizację Zdrowia (WHO) – analiza krytyczna
Źródło: F1000Res. 2018; 7: 243; Revised World Health Organization (WHO)’s causality assessment of adverse events following immunization—a critique

Aby uzyskać pełniejszy obraz tej patologicznej układanki polecamy zapoznać się jeszcze z tymi dwoma materiałami. Pierwszy omawia kwestię tego z jakich badań zwolnione są szczepionki, a w drugim podane są przykłady tego jak krótki jest lub może być okres obserwacji klienta, któremu podano szczepionkę w trakcie trwania tzw. badań klinicznych bezpieczeństwa.
Wytyczne Dotyczące Przedklinicznych Badań Farmakologicznych i Toksykologicznych Szczepionek – EMA
Czy na pewno szczepionki to najlepiej przebadane produkty firm farmaceutycznych? Sprawdźmy.
Streszczenie
Światowa Organizacja Zdrowia (ang. World Health Organisation, WHO) skorygowała niedawno wytyczne w zakresie klasyfikacji Niepożądanych Odczynów Poszczepiennych / poszczepiennych zdarzeń niepożądanych (ang. adverse event following immunization, AEFI). Jedynie reakcje, które uznano już wcześniej w badaniach epidemiologicznych za skutek szczepienia sklasyfikowane zostały jako reakcje na podanie szczepionki. Zgonów zaobserwowanych w czasie nadzoru po wprowadzeniu szczepionki do obrotu nie uznaje się za „mające logiczny związek przyczynowy ze szczepieniem”, o ile nie nastąpił statystycznie istotny wzrost liczby zgonów zarejestrowanych w małych badaniach fazy 3, które je poprzedziły. Oczywiście szczepionki, co do których stwierdzono, że powodują znaczący wzrost liczby zgonów na etapie badań kontrolnych prawdopodobnie nie zostałyby zarejestrowane. Po zarejestrowaniu, zgony i wszelkie inne poważne reakcje niepożądane oznaczane są jako „zdarzenia przypadkowe” lub jako „nieklasyfikowalne”, a ich związku ze szczepieniem się nie uznaje. Wynikający z tego paradoks jest ewidentny.
Podobnie zmianie uległa definicja związku przyczynowego. Używa się jej obecnie tylko wówczas, gdy „w proces nie ingeruje żaden inny czynnik”. Z tego powodu, jeśli u dziecka z podstawową, wrodzoną chorobą serca (inny czynnik) wystąpi gorączka i dekompensacja układu krążenia w następstwie szczepienia, niewydolność serca nie zostanie uznana za związaną przyczynowo ze szczepieniem. Światowy Komitet ds. Bezpieczeństwa Szczepień udokumentował wiele zgonów dzieci z istniejącą uprzednio chorobą serca po zaszczepieniu ich szczepionką pięcioskładnikową. WHO zaleca obecnie środki ostrożności w związku ze szczepieniem dzieci z tej grupy. Dzięki temu ryzyko zgonu maleje. Stosowanie nowej definicji związku przyczynowego oznacza nieuznawanie tej zależności i narażanie życia dzieci na niebezpieczeństwo. W świetle powyższego należy pilnie przeprowadzić rewaluację i korektę instrukcji poszczepiennych zdarzeń niepożądanych [AEFI]. Uznaje się, że zgłaszanie niepożądanych odczynów poszczepiennych [NOP] służy bezpieczeństwu szczepionek. Należy położyć nacisk na bezpieczeństwo dzieci, nie zaś szczepionek.
Szczepionki są bardzo bezpieczne – dr Soumya Swaminathan, WHO
Myślenie pojęciowe, a myślenie stereotypowe – Andrzej Wronka, Kazimierz Ajdukiewicz, Józef Kossecki
O tworzeniu pojęć klasowych oraz teoriach adekwatnych, kulawych i skaczących – Leon Petrażycki
Ocena związku przyczynowo skutkowego dla Niepożądanych Odczynów Poszczepiennych [NOP-ów]
Wstęp
Jednym z pierwszych krajów, które wprowadziły szczepionkę pięcioskładnikową (połączona szczepionka przeciwko błonicy, tężcowi, krztuścowi, haemophilus influenzae i wirusowemu zapaleniu wątroby typu B) była Sri Lanka[1]. Pięcioskładnikowa szczepionka Quinvaxem (Crucell) została wprowadzona w Sri Lance 1 stycznia 2008 roku. 29 kwietnia tego samego roku rząd wycofał tę szczepionkę po wystąpieniu pięciu zgonów. Zespół ekspertów Światowej Organizacji Zdrowia (WHO) zbadał Niepożądane Odczyny Poszczepienne (AEFI) i podał, że jest „mało prawdopodobne”, aby zgony te miały związek ze szczepieniem. Pełen raport nie był powszechnie dostępny zanim nie przedstawiono go w Sądzie Najwyższym w Delhi[2]. Wynikało z niego jasno, że nie istnieje alternatywne wyjaśnienie trzech zgonów. Tym samym powinny one zostać sklasyfikowane jako „prawdopodobnie” związane ze szczepieniem przy użyciu stosowanych przez WHO kryteriów Brighton klasyfikacji NOP (patrz tabela 1). Wspomniani eksperci usunęli kategorie „prawdopodobny” i „możliwy” z klasyfikacji NOP, którą zastosowali do oceny, a następnie zgłosili, że jest „mało prawdopodobne”, aby zgony te miały związek ze szczepieniem. Sposób, w jaki zmieniono klasyfikację Brighton, aby umożliwić dokonanie tej wprowadzającej w błąd klasyfikacji zgonów w Sri Lance, został podany do wiadomości w Indian Journal of Medical Research i w British Medical Journal[3,4].
4 maja 2013 roku Ministerstwo Zdrowia Wietnamu zawiesiło stosowanie Quinvaxem (Crucell) po tym, jak szczepionka spowodowała 12 zgonów[5]. Eksperci WHO przeprowadzili dochodzenie w sprawie zgonów w Wietnamie. Tym razem poinformowali, że „Quinvax została zatwierdzona uprzednio przez WHO…, ze szczepionką tą nigdy nie wiązał się żaden śmiertelny poszczepienny przypadek zdarzenia niepożądanego” 5. Mowa o tej samej odmianie szczepionki pięcioskładnikowej, którą stosowano w Sri Lance, gdzie eksperci WHO udokumentowali uprzednio zgony na skutek Niepożądanych Odczynów Poszczepiennych. Wydaje się, że w następstwie dochodzenia w Sri Lance i przeprowadzonego na krótko przed dochodzeniem w Wietnamie, metodologia stosowana w klasyfikacji NOP została skorygowana. Stosując skorygowaną ocenę związku przyczynowo-skutkowego między szczepieniem i NOP, Niepożądane Odczyny Poszczepienne ze Sri Lanki można by sklasyfikować jako „nie NOP”. Sprawozdanie WHO skłoniło zarówno Sri Lankę, jak i Wietnam do ponownego wprowadzenia tej pięcioskładnikowej szczepionki. Nowy mechanizm umożliwiający klasyfikację NOP jako „nie NOP” zostanie jeszcze omówiony.
Tabela 1. Niepożądane Odczyny Poszczepienne (NOP) według klasyfikacji WHO: kryteria Brighton dotyczące oceny związku przyczynowo-skutkowego
| Termin określający związek przyczynowo-skutkowy | Kryteria oceny |
| Bardzo prawdopodobne/Pewne | Zdarzenie kliniczne powiązane wiarygodnym związkiem czasowym z podaniem szczepionki, którego nie da się wyjaśnić chorobą współistniejącą ani innymi lekami lub substancjami chemicznymi. |
| Prawdopodobne | Zdarzenie kliniczne powiązane racjonalnym związkiem czasowym z podaniem szczepionki; jest mało prawdopodobne, aby można je było przypisać chorobie współistniejącej bądź działaniu innych leków lub substancji chemicznych. |
| Możliwe | Zdarzenie kliniczne powiązane racjonalnym związkiem czasowym z podaniem szczepionki, ale takie, które można również wyjaśnić chorobą współistniejącą lub działaniem innych leków bądź substancji chemicznych. |
| Mało prawdopodobne | Zdarzenie kliniczne, którego związek czasowy z podaniem szczepionki czyni związek przyczynowo-skutkowy mało wiarygodnym, ale które można przekonująco wyjaśnić chorobą podstawową lub działaniem innych leków czy substancji chemicznych. |
| Niezwiązane | Zdarzenie kliniczne z niekompatybilnym związkiem czasowym, które można wyjaśnić chorobą współistniejącą lub działaniem innych leków bądź substancji chemicznych. |
| Nieklasyfikowalne | Zdarzenie kliniczne, w związku z którym informacje są niewystarczające, by umożliwić ocenę i rozpoznanie przyczyny |
Źródło: WHO, Adverse Events Following Immunization (AEFI): Causality Assessment, 2005
Część A
Tło historyczne oceny związku przyczynowo-skutkowego: od Hume’a do Brighton
Ewolucja logiki oceny związku przyczynowo-skutkowego jest fascynująca. Zmagali się z tą kwestią wybitni filozofowie, naukowcy, luminarze prawa i statystycy; wiele też na ten temat napisano. Niemożliwe jest przedstawienie całości zagadnienia w tym opisie, chyba że ryzykując nadmierne uproszczenie. Jako że interesuje nas głównie przypisanie przyczynowości domniemanym reakcjom na leki, jedynie niektóre aspekty tej dyskusji mają znaczenie dla niniejszego omówienia.
Zdefiniowanie przyczyny i skutku (X jest przyczyną Y) nie było łatwe. Według Hume’a[6], najważniejsze cechy przyczynowości to pierwszeństwo w czasie (X musi poprzedzać Y), bezpośredni kontakt oraz regularność zależności między przyczynami a ich skutkami. Możliwe jest jednak zakłócenie przez czynnik trzeci.
Wiadomo, że konsumpcja lodów rośnie wraz z gwałtownym wzrostem liczby przypadków poparzeń słonecznych. Można z tego wyciągnąć błędny wniosek, że spożywanie lodów potencjalnie powoduje oparzenia słoneczne. Trzecim czynnikiem jest w tym przypadku wysoka temperatura. Zarówno konsumpcja lodów, jak i oparzenia słoneczne kojarzą się ze słonecznymi dniami. Hume uniknął problemu zakłócenia zastrzegając, że X może zostać uznane za przyczynę Y tylko wówczas, jeśli X jest wystarczające do wystąpienia Y. To stwierdzenie jest jednak błędne. Pocierając zapałką o pudełko można zapalić ogień tylko wówczas, jeżeli w powietrzu jest tlen. Samo potarcie o draskę nie wystarczy. Alternatywną tezą mogły by być, że X jest przyczyną Y wtedy i tylko wtedy, kiedy X jest niezbędne do wystąpienia Y[7].
John Mackie zasugerował, że w naturze może istnieć wiele powodów (przyczyn) tego samego skutku[8]. Tym samym X może nie być niezbędne do wystąpienia Y, ale jednocześnie X może być wystarczające do wystąpienia Y. Budynek może stanąć w płomieniach na skutek iskry ze zwarcia w instalacji elektrycznej (X) lub w wyniku podpalenia (Z). Wobec tego ani (X) ani (Z) nie są konieczne do wystąpienia Y, ale zarówno (X), jak i (Z) są wystarczającymi przyczynami wystąpienia Y. Pytanie zatem brzmi czy Y wystąpiłoby, gdyby nie czynnik X. Znamy to jako test „gdyby nie”. W systemie prawnym uznaje się, że tam, gdzie wiele przyczyn występuje jednocześnie, test „gdyby nie” jest niemożliwy do przeprowadzenia, pojawia się natomiast pytanie dotyczące przyczynowości: czy domniemana przyczyna w znaczący sposób doprowadziła do skutku?[9]. Dyskutowano o tym w trakcie sprawy Grahama Dickie przeciwko Flexcon Glenrothes Limited [2009] ScotSC 143 (4 września 2009). Peter M. Willcock i James M. Lepp szczegółowo omawiają powyższe kwestie w swoim artykule p.t. „Przyczynowość w przypadkach zaniedbania lekarskiego”.
W biologii istnieje dalszy probabilistyczny element przyczynowości. Gdyby mężczyźni tego samego wzrostu i kobiety tego samego wzrostu mieli dzieci, wszystkie te dzieci nie byłyby tego samego wzrostu. Dla tej samej grupy zaobserwowanych czynników przyczynowych istnieje rozkład prawdopodobieństwa możliwego wzrostu[7].
Aby ocenić przyczynowość, Bradford Hill[10] opisał 9 zasad przewodnich potwierdzających związek przyczynowy:
1) Siła – skala skutku;
2) Jednolitość – powtarzalność umożliwiająca dokonywanie tych samych obserwacji przez różne osoby w różnych miejscach;
3) Specyfika – brak alternatywnego wyjaśnienia;
4) Tymczasowość, z uwzględnieniem, że przyczyna zawsze poprzedza skutek;
5) Gradient biologiczny dowodzący istnienia zależności między nasileniem występowania czynnika ryzyka i jego skutkiem;
6) Wiarygodność biologiczna – choć tę zasadę może ograniczać stan aktualnej wiedzy;
7) Spójność między epidemiologią a ustaleniami laboratoryjnymi;
8) Dowody eksperymentalne; i
9) Analogia – badanie skutku tych samych czynników. Względy te stosują się również do rzekomych reakcji poszczepiennych.
Niepożądane reakcje na leki
Niepożądane reakcje na leki (ang. adverse drug reactions, ADRs) mogą wystąpić po przyjęciu jakiegokolwiek leku. Niezbędna jest dokładna ocena, aby odróżnić zdarzenia związane przyczynowo z danym lekiem od wydarzeń przypadkowych. Ocena przyczynowości ma kluczowe znaczenie, ponieważ zdarzenia mógł spowodować lekarz i można ich było uniknąć. Zazwyczaj niewiele osób reaguje negatywnie na leki dostępne na rynku, a większości nic nie jest. Przypisanie przyczynowości takim sporadycznym incydentom jest szczególnie skomplikowane. Dochodzenia dotyczące niepożądanych reakcje na leki [ADRs] umieszczają związek przyczynowy na skali prawdopodobieństwa. System oceny przyczynowości stworzony przez Międzynarodowy Ośrodek Monitorowania Niepożądanych Działań Leków przy WHO funkcjonuje jako skala Ośrodka Monitorowania w Uppsali (ang. World Health Organization – Uppsala Monitoring Centre, WHO-UMC). Jest ona powszechnie stosowana, jako że uwzględnia prostą metodologię (patrz tabela 2). W zgodzie z postulatami Hume’a, pierwszym krokiem jest potwierdzenie precedencji i bliskiego kontaktu.
Zdarzenie niepożądane musi wystąpić w następstwie podania podejrzanego leku oraz w racjonalnych ramach czasowych. Związek między zdarzeniami, w przypadku których ze względu na czas wystąpienia zdarzenia niepożądanego względem przyjęcia leku zależność jest mało wiarygodna klasyfikowany jest jako „mało prawdopodobny”. Zdarzenia występujące w racjonalnym czasie, dla których nie istnieje alternatywne wyjaśnienie (takie, których nie można przypisać chorobie ani działaniu innych leków) klasyfikowane są jako „prawdopodobnie/potencjalnie” związane z danym lekiem. Reakcja na lek klasyfikowana jest jako „możliwa” w sytuacjach, kiedy występuje rozsądny związek czasowy, ale istnieją także alternatywne wyjaśnienia. Stosując aforyzm, lek uznawany jest za wystarczający, ale nie konieczny dla wystąpienia skutku.
Tabela 2. Kategorie przyczynowości według WHO-UMC
| Termin określający związek przyczynowo-skutkowy | Kryteria oceny |
| Pewna | · Nieprawidłowość zdarzenia lub badania laboratoryjnego przy wiarygodnym związku czasowym między zdarzeniem a przyjęciem leku
· Nie można go wyjaśnić chorobą ani działaniem innych leków · Prawdopodobne wystąpienie reakcji na wycofanie leku (farmakologicznej, patologicznej) · Zdarzenie niewątpliwe pod względem farmakologicznym lub fenomenologicznym (tj. rzeczywiste i konkretne schorzenie lub rozpoznane zjawisko farmakologiczne) · Zadowalające ponowne zastosowanie leku, o ile jest ono konieczne |
| Prawdopodobna/Potencjalna | · Nieprawidłowość zdarzenia lub badania laboratoryjnego przy wiarygodnym związku czasowym między zdarzeniem a przyjęciem leku
· Mało prawdopodobne, aby można je było przypisać chorobie lub działaniu innych leków · Reakcja na wycofanie leku klinicznie racjonalna · Ponowne zastosowanie leku niewymagane |
| Możliwa | · Nieprawidłowość zdarzenia lub badania laboratoryjnego przy wiarygodnym związku czasowym między zdarzeniem a przyjęciem leku
· Można je również wyjaśnić chorobą i działaniem innych leków · Brak informacji lub niejednoznaczna informacja na temat wycofania leku |
| Mało prawdopodobna | · Nieprawidłowość zdarzenia lub badania laboratoryjnego, jednak ze względu na związek czasowy między przyjęciem leku a reakcją, zależność jest mało prawdopodobna (ale nie niemożliwa)
· Można je wiarygodnie wyjaśnić chorobą i działaniem innych leków |
| Warunkowa/Nieklasyfikowalna | · Nieprawidłowość zdarzenia lub badania laboratoryjnego
· Potrzeba więcej danych do prawidłowej oceny lub · Dodatkowe dane w trakcie badania |
| Niemożliwa do oceny/Nieklasyfikowalna | · Raport wskazujący na wystąpienie reakcji niepożądanej
· Niemożliwa do oceny ze względu na niewystarczające bądź sprzeczne informacje · Dane niemożliwe do uzupełnienia lub weryfikacji |
Źródło Ośrodek Monitorowania w Uppsali. Zastosowanie systemu WHO-UMC do ustandaryzowanej oceny przyczynowości przypadku. Reprodukowano za zgodą ośrodka monitorowania w Uppsali. The use of the WHO-UMC system for standardised case causality assessment
Aby sklasyfikować reakcję jako „bardzo prawdopodobną/pewną”, musi być ona rzeczywistym i konkretnym schorzeniem lub rozpoznanym zjawiskiem farmakologicznym, a także musi istnieć dowód na wystąpienie reakcji związanej z wysokością dawki bądź musi nastąpić wznowienie objawów przy ponownym zastosowaniu leku. Jeżeli niepożądaną reakcją na lek jest zgon, ponowne zastosowanie leku jest niemożliwe. Zazwyczaj trudno mieć pewność co do przyczynowości śmiertelnych przypadków niepożądanych reakcji na leki ADR i reakcję klasyfikuje się często jako „prawdopodobną/potencjalną” lub „możliwą”.
O różnicy między reakcją „pewną” a „prawdopodobną/potencjalną” decydują po prostu akceptowalne wymagania dowodowe. Aby reakcja została uznana za „pewną”, wymagany jest niepodważalny dowód o wysokich standardach (zafałszowanie teorii przez jeden nieprawidłowy wynik). Pojedyncze, dobrze udokumentowane i spontaniczne ponowne zastosowanie leku stanowi silny dowód regularności (mimo że tylko u jednego pacjenta). Dla kategorii „bardzo prawdopodobna”, normą dowodu jest dowód ponad wszelką wątpliwość. „Rachunek prawdopodobieństwa” to zakres dowodów wymagany do sklasyfikowania reakcji jako „prawdopodobna” lub „możliwa” i jest to też standard dowodu, który odnosi się do medycyny oraz nadzoru nad bezpieczeństwem farmakoterapii. Przy tym zakresie dowodów (prawda prima facie) należy zastosować zasadę ostrożności. Zostanie ona opisana poniżej.
Zdarzenia niepożądane w następstwie szczepienia
Szczepionki to leki stosowane jako zapobiegawcze, które podaje się całym kohortom zdrowych ludzi. Jako że są oni całkowicie zdrowi, należy zdecydowanie spodziewać się, że szczepienie spowoduje kilka niepożądanych skutków. Istnieje jednak niska tolerancja na poważne zdarzenia niepożądane i zgony. Poszczepienne zdarzenie niepożądane (NOP) należy monitorować dokładniej niż inne leki. Wiarygodny system oceny i monitorowania bezpieczeństwa szczepionek jest konieczny dla pomyślnego wdrażania programów szczepień. WHO opracowała klasyfikację „Poszczepienne zdarzenia niepożądane (AEFI): ocena przyczynowości”, znaną również jako klasyfikacja Brighton. Jest ona bardzo zbliżona do opracowanych przez WHO-UMC kategorii przyczynowości dla niepożądanych reakcji na leki [ADR]. Do niedawna stanowiła ona kryterium stosowane przez ekspertów z WHO podczas zgłaszania Niepożądanych Odczynów Poszczepiennych (patrz tabela 1).
Jednym z mierników wrażliwości i reaktywności kategorii przyczynowości opracowanych przez WHO-UMC (stosowanych wcześniej niż klasyfikacja Brighton) jest skwapliwość, z jaką w 1999 roku wycofano szczepionkę RotaShield przeciwko rotawirusom po zgłoszeniu 12 przypadków spowodowanego przez nią wgłobienia. U około 1 na 2000 dzieci w wieku poniżej 2 miesięcy wgłobienie występuje z innych przyczyn. W oparciu o wyniki badania, Centra Kontroli Chorób (CDC) oszacowały, że wśród wszystkich 10.000 niemowląt zaszczepionych szczepionką RotaShield wystąpią dwa lub więcej dodatkowe przypadki wgłobienia. Po zaszczepieniu około 100.000 niemowląt, szczepionka została wycofana[11]. W 2013 roku zrezygnowano z klasyfikacji Brighton i zastąpiono ją skorygowaną klasyfikacją Niepożądanych Odczynów Poszczepiennych. Tok rozumowania, który doprowadził do odejścia od klasyfikacji Brighton nie został wyraźnie określony w skorygowanych instrukcjach dotyczących NOPów [12].
Część B
Odejście od klasyfikacji Brighton: skorygowana ocena przyczynowości
Rada ds. Międzynarodowych Organizacji Nauk Medycznych (ang. The Council for International Organizations of Medical Sciences, CIOMS) / WHO: Raport z nadzoru nad bezpieczeństwem farmakoterapii.
W październiku 2010 roku, po serii spotkań, 40 ekspertów (z których 19 reprezentowało branżę z ewentualnymi konfliktami interesów) udzieliło pomocy przy redagowaniu kategorii klasyfikacji Niepożądanych Odczynów Poszczepiennych. Ogłoszono, że dokument zatytułowany „Definicje i zastosowanie warunków nadzoru nad bezpieczeństwem farmakoterapii” „zapewnia narzędzia pozwalające na większą doskonałość w wykrywaniu sygnałów i prowadzeniu śledztwa dotyczącego niepożądanych zdarzeń poszczepiennych” [13].
Na stronie 170 wspomnianego 193-stronicowego dokumentu, pod nagłówkiem „Uwagi do wytycznych”, napisane jest drobnym drukiem:
„Jeżeli istnieją wystarczające dowody, że odczyn nie spełnia definicji przypadku, należy go odrzucić i zgłosić jako ‘nie NOP’. Dowód uznaje się za wystarczający, jeśli spełnione są kryteria wykluczenia lub dochodzenie ujawnia negatywne ustalenia dotyczące niezbędnego kryterium (warunek konieczny) diagnozy. Odczyn taki należy odrzucić i zgłosić jako ‘nie NOP’”.[13]
Opracowane przez CIOMS/WHO narzędzie „pozwalające na większą doskonałość w wykrywaniu sygnałów” działa na zasadzie przymykania oka na NOP – klasyfikując NOP jako „nie NOP”. Nie tylko zaprzecza się istnieniu związku przyczynowego między NOP a szczepieniami, ale także stwarza się wrażenie, że NOP nigdy nie wystąpiło. Wykrywanie sygnałów przestaje być możliwe po usunięciu NOP z systemu na skutek oznaczenia ich jako „nie NOP”. Relacja przedstawiona powyżej we Wstępie, kiedy WHO ogłosiła w maju 2013 roku, że żaden przypadek śmiertelnego NOP nigdy nie łączył się z podaniem szczepionki pięcioskładnikowej[5], wskazuje, że zgony w wyniku NOP w Sri Lance[2] zostały poddane ponownej klasyfikacji z wykorzystaniem narzędzia CIOMS/WHO i uznane za „nie NOP”.
Pod uwagę bierze się wyłącznie reakcje spełniające definicję przypadku reakcji uprzednio związanych ze szczepionką. Zgodnie z raportem CIOMS/WHO (strona 11) definicję przypadku można zaadoptować z literatury wzorcowej lub mogą ją opracować sami sprawozdawcy.
Definicja przypadku pozwala na korzystanie z wcześniejszych badań epidemiologicznych i ułatwia dalszą analizę w celu potwierdzenia związku przyczynowego. Wykluczenie przyczynowości w odniesieniu do pojedynczego odczynu nie może jednakże zależeć od tego czy odczyn ten spełnia istniejącą wcześniej definicję przypadku. Pejoratywne użycie terminu „odrzucić” (w zdaniu: „Odczyn taki należy odrzucić i sklasyfikować jako ‘nie NOP’”) sugeruje postawę defensywną. Wskazano uprzednio, że raporty dotyczące NOP powinno się oceniać pod kątem przyczynowości i klasyfikować: nie należy ich „odrzucać”[14].
Skorygowane instrukcje dotyczące NOP opracowane przez WHO
W marcu 2013 roku opublikowano opracowane przez WHO, skorygowane „Instrukcje dla użytkownika dotyczące NOP” wraz z nowym algorytmem[12]. Autorzy instrukcji przyznają, że zaadaptowali definicje i koncepcje z raportu CIOMS/WHO. Nowy algorytm dla Niepożądanych Odczynów Poszczepiennych zreprodukowano na ilustracji 1.
Ilustracja 1.
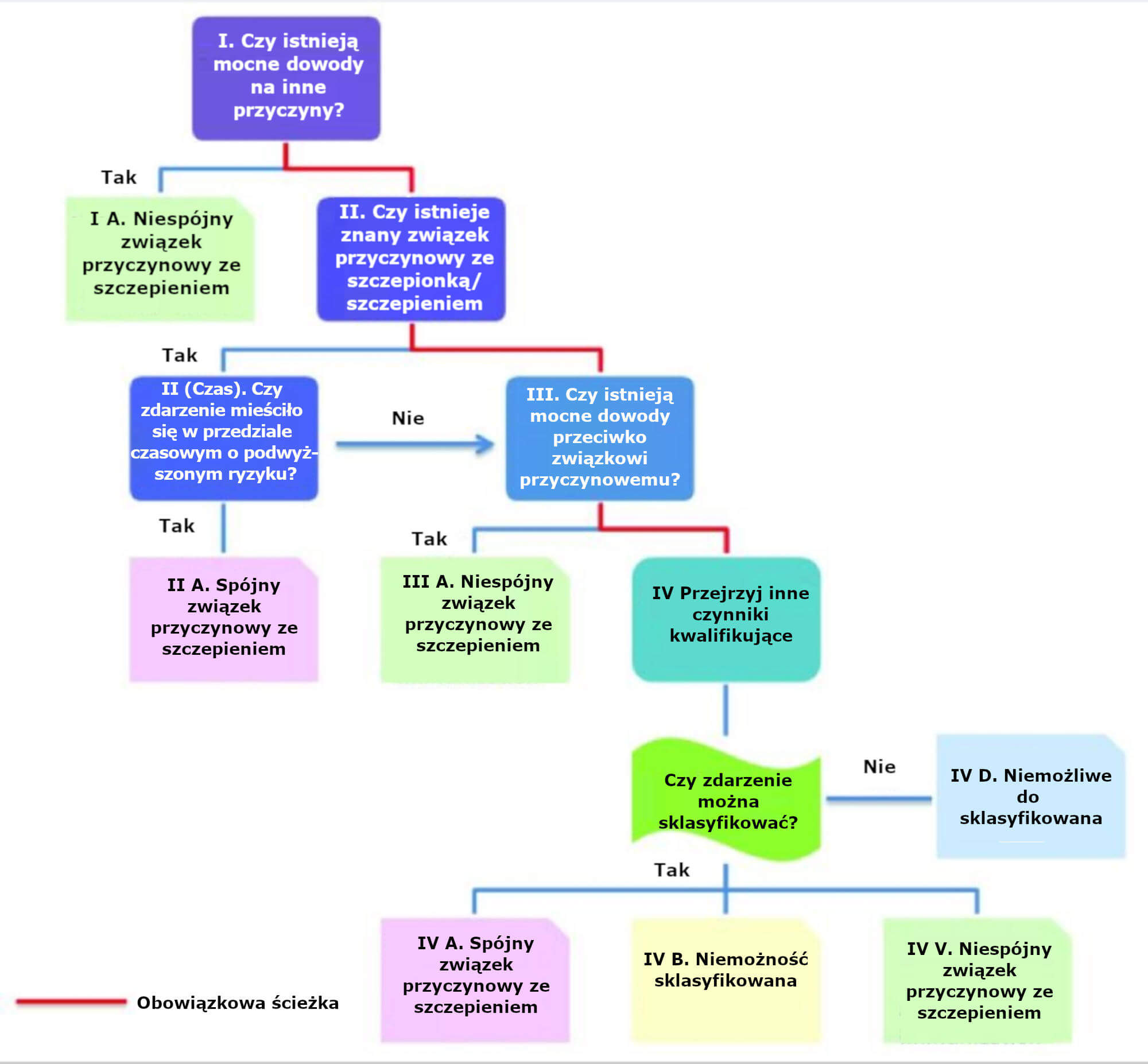
Schemat blokowy przedstawiający nowy algorytm dotyczący skorygowanej klasyfikacji NOP.
Skorygowana klasyfikacja NOP: nowe kategorie przyczynowości
Ocenie przyczynowości pod kątem niepożądanych odczynów poszczepiennych [NOP] podlegają wyłącznie odczyny, które wystąpiły w następstwie podania szczepionki. Ten pierwszy krok przypomina postulat Hume’a dotyczący procedencji i bliskiego kontaktu. W nowym projekcie, przyczynowość została podzielona na cztery kategorie: „spójny związek przyczynowy ze szczepieniem”, „nieoznaczony”, „niespójny związek przyczynowy ze szczepieniem” oraz „nieklasyfikowalny”.
Spójny [logiczny] związek przyczynowy ze szczepieniem
Jest to najwyższy poziom związku przyczynowego według nowej klasyfikacji, w mniejszym stopniu rozstrzygający niż „bardzo prawdopodobny/pewny” w dawnym projekcie. Nie wymaga niepodważalnego dowodu ani nawet dowodu ponad wszelką wątpliwość. Nie bada się nawet rachunku prawdopodobieństwa. W nowym programie niepożądany odczyn może zostać sklasyfikowany jednocześnie jako mający „spójny związek przyczynowy ze szczepieniem” oraz „niespójny związek przyczynowy ze szczepieniem”. Na stronie 36 skorygowanych instrukcji dotyczących NOP[12] znajduje się opis przypadku ostrego porażenia wiotkiego u dziecka po zaszczepieniu doustną szczepionką przeciw polio, przy czym miesiąc przed wystąpieniem porażenia dziecko gorączkowało. Badanie bakteriologiczne kału wykazało obecność szczepu wirusa polio. Przypadek ten został sklasyfikowany jako mający „spójny związek przyczynowy ze szczepieniem”, gdyż jest to znana reakcja na szczepionkę przeciwko polio, zaś porażenie wystąpiło w oknie czasowym zwiększonego ryzyka. Odczyn sklasyfikowano również jako mający „niespójny związek przyczynowy ze szczepieniem”, ponieważ gorączka, która pojawiła się miesiąc przed porażeniem, nie została w pełni zbadana. Taka niejednoznaczność, dopuszczająca jednocześnie diametralnie przeciwne wnioski, jest cechą charakterystyczną nowego projektu.
W skorygowanych instrukcjach dotyczących Niepożądanych Odczynów Poszczepiennych sugeruje się, że przed udzieleniem odpowiedzi na pytanie „czy szczepionka podana konkretnej osobie spowodowała konkretny zgłoszony odczyn?” (pytanie „czy tak się stało?”), należy odpowiedzieć na inne pytanie: „czy dana szczepionka może spowodować konkretne zdarzenie niepożądane?” (czy może?) Wywnioskować z tego można, że tylko, gdy istnieje dowód na poziomie populacji, że dana szczepionka może powodować zdarzenie niepożądane, reakcja klasyfikowana jest jako mająca „spójny związek przyczynowy ze szczepieniem”.
Powyższy wniosek jest błędny z dwóch powodów. Z jednej strony zaprzecza istnieniu wszelkich nowych powiązań zaobserwowanych w badaniach fazy IV. Z drugiej, jeśli jest to znana niepożądana reakcja, uznaje się związek przyczynowy nawet wówczas, gdy odczyny mogły wystąpić na skutek zbiegu okoliczności. Z faktu, że wgłobienie uznano za zdarzenie niepożądane po zaszczepieniu przeciwko rotawirusom, nie wynika, że wszystkie przypadki wgłobienia w krytycznym okresie podwyższonej podatności z całą pewnością spowodowała szczepionka. Szczątkowa niepewność na tym najwyższym poziomie związku przyczynowego pozbawia go wartości, jaką przedstawia dla problemu Niepożądanych Odczynów Poszczepiennych [NOP] powodowanych przez szczepionki.
Niespójny związek przyczynowy ze szczepieniem
W dolnej części nowej hierarchii klasyfikacji przyczynowości znajduje się kategoria „niespójny związek przyczynowy ze szczepieniem”. W grupie tej mogą znaleźć się reakcje, dla których nie ma alternatywnego wyjaśnienia (i które uprzednio zostałyby sklasyfikowane w kategorii „prawdopodobny”). Reakcje te mogłyby znaleźć się w grupie „niespójny związek przyczynowy ze szczepieniem” tylko dlatego, że taki związek nie został udokumentowany we wcześniejszych badaniach epidemiologicznych. W tej samej grupie umieszczane są reakcje, których związek ze szczepieniami zostałby uznany za „mało prawdopodobny” oraz te, których związek sklasyfikowano by jako „niezwiązany”. Zastosowanie tej samej kategorii „niespójny związek przyczynowy ze szczepieniem” dla tak szerokiego spektrum sytuacji klinicznych jedynie zaciemnia obraz tych problemów. W skorygowanym projekcie termin ten stosuje się dla wskazania, że żadna zależność między NOP a szczepieniem nie istnieje. Niezależnie od częstotliwości występowania reakcji skategoryzowanej jako mająca „niespójny związek przyczynowy ze szczepieniem”, nie bada się jej jako nowego sygnału istnienia związku przyczynowego.
Niespójny związek ze szczepieniem
Klasyfikacja w grupie odczynów mających „nieoznaczony” związek ze szczepieniem zarezerwowana jest dla tych reakcji, które mogły być wywołane przez szczepienie, ale dla których nie udokumentowano wcześniej związku przyczynowego. Przewiduje się, że informacje dotyczące Niepożądanych Odczynów Poszczepiennych sklasyfikowane jako mające nieoznaczony związek ze szczepieniem będą sumowane i analizowane w celu określenia czy NOP jest nowym sygnałem istnienia nierozpoznanego odczynu. Jednak projekt jest tak tendencyjny, że dosłownie żadne Niepożądane Odczyny Poszczepienne nie trafiają do tej grupy. Sposób, w jaki się to dzieje zostanie omówiony w dalszej części niniejszej analizy.
Nieklasyfikowalny związek ze szczepieniem
W grupie reakcji mających „nieklasyfikowalny” związek ze szczepieniem umieszczane są zdarzenia kliniczne, w przypadku których niewystarczające informacje uniemożliwiają ocenę oraz rozpoznanie przyczyny.
Skorygowana klasyfikacja NOP: nowy algorytm
Tak jak ostateczne kategorie związku przyczynowego pokrywają się, są niejasne i nie dość zróżnicowane, algorytm stosowany do ustalania przyczynowości nie wydaje się logiczny ani dobrze przemyślany.
Algorytm ten przedstawiono na ilustracji 1.
Algorytm dotyczący oceny przyczynowości
Należy kolejno odpowiedzieć na pytania z czterech grup:
1. Czy istnieje silny dowód na istnienie innych przyczyn?
2. Czy istnieje rozpoznany związek przyczynowy ze szczepionką lub szczepieniem, a jeśli tak, czy odczyn wystąpił w oknie czasowym podwyższonego ryzyka?
3. Jeżeli nie istnieje rozpoznany związek przyczynowy lub jeśli odczyn nie wystąpił w oknie czasowym podwyższonego ryzyka: czy istnieje silny dowód zaprzeczający istnieniu związku przyczynowego?
4. Jeżeli nie istnieje silny dowód zaprzeczający istnieniu związku przyczynowego, następnym krokiem jest zbadanie innych czynników kwalifikujących do klasyfikacji:
a) Czy odczyn mógł wystąpić niezależnie od szczepienia (wskaźnik występowania w populacji)?
b) Czy odczyn mógł być objawem innej choroby?
c) Czy w przeszłości na skutek podania dawki podobnej szczepionki wystąpił porównywalny odczyn?
d) Czy przed wystąpieniem odczynu pacjent był narażony na potencjalny czynnik ryzyka lub toksynę?
e) Czy przed wystąpieniem odczynu pacjent cierpiał na ostre schorzenie?
f) Czy w przeszłości odczyn występował niezależnie od szczepienia?
g) Czy pacjent przyjmował jakiekolwiek leki przed zaszczepieniem?
h) Czy należy uwzględnić wiarygodność biologiczną?
Krok 1
Pierwszym krokiem skorygowanego algorytmu jest poszukiwanie mocnych dowodów na istnienie innych przyczyn. Jeżeli istnieje alternatywne wyjaśnienie, NOP klasyfikowane jest jako mające „niespójny związek przyczynowy ze szczepieniem”. John Mackie zauważył, że w naturze liczne powody (przyczyny) mogą wywoływać ten sam skutek, a jeżeli występują jednocześnie dwie przyczyny, każda z nich może być czynnikiem sprawczym[8]. Należy zwrócić uwagę, że zgodnie z klasyfikacją niepożądanych reakcji na leki [ADR] stworzoną przez WHO-UMC i dawną klasyfikacją NOP opracowaną przez WHO/Brighton, nawet jeśli dostępne jest alternatywne wyjaśnienie, związek przyczynowy z lekiem lub szczepionką nadal uznaje się jako „możliwy”. Co więcej, te dwie przyczyny mogą funkcjonować synergistycznie. Jako przykład może posłużyć sytuacja, w której czynniki genetyczne oraz inne czynniki indywidualnej podatności sprawiają, że dana osoba jest podatna na NOP[15,16]. Według nowego algorytmu, jeśli istnieje alternatywne wytłumaczenie pojawienia się NOP lub jeśli w grę wchodzi inny czynnik, związek przyczynowy ze szczepionką nie zostaje uznany[12,14].
Krok 2
Na tym etapie wykorzystuje się raport CIOMS / WHO dotyczący sprawowania nadzoru nad bezpieczeństwem farmakoterapii[13]. Opracowane zostały definicje przypadku niektórych reakcji związanych konkretnie z NOP. W sytuacjach, gdy dla konkretnego NOP nie są dostępne ścisłe definicje przypadku i kryteria, zezwala się na improwizację z wykorzystaniem definicji przypadku zaadoptowanych z „wzorcowej literatury medycznej bądź wytycznych ogólnokrajowych lub mogą być przyjęte lokalnie przez recenzentów” (strona 11 raportu CIOMS / WHO). Niepożądane Odczyny Poszczepienne spełniające definicje przypadku i te, które występują w oknie czasowym podwyższonego ryzyka klasyfikowane są jako mające „spójny związek przyczynowy ze szczepieniem”.
Dla każdego zdarzenia niepożądanego możliwe do przyjęcia jest inne okno czasowe. Pacjenci z zespołem makrofagowego zapalenia mięśniowo-powięziowego to zwykle osoby w średnim wieku z rozlanymi bólami mięśniowo-stawowymi, zespołem przewlekłego zmęczenia oraz z wyraźnymi deficytami poznawczymi, objawami zmęczenia lub depresji na skutek długotrwałego utrzymywania się wodorotlenku glinu w makrofagach w miejscu iniekcji[17]. Jednakże obserwacja Niepożądanych Odczynów Poszczepiennych rzadko obejmuje tak długi okres.
Krok 3
Teoretycznie wobec reakcji, co do których nie wiadomo czy mają związek przyczynowy lub w stosunku do tych, które nie wystąpiły w oknie czasowym podwyższonego ryzyka można zastosować procedurę Kroku 3. Na tym etapie bada się czy istnieje mocny dowód zaprzeczający wystąpieniu związku przyczynowego. Udowodnienie, że związek taki nie istnieje w oczywisty sposób nastręcza trudności, jako że niemożliwe jest stwierdzenie, iż w żadnych okolicznościach nieprawidłowy wynik nie może wystąpić. Przykład podany w instrukcjach dotyczy szczepionki MMR i autyzmu.
Podaje się do wiadomości, że Światowy Komitet Doradczy ds. Bezpieczeństwa Szczepień (ang. Global Advisory Committee on Vaccine Safety, GACVS) oraz Rada ds. Międzynarodowych Organizacji Nauk Medycznych (komitet IOM) doszły do wniosku, że nie istnieje żaden dowód na występowanie związku przyczynowego między szczepionką MMR a zaburzeniami ze spektrum autyzmu. Zgodnie z nowym algorytmem NOP tego rodzaju należy klasyfikować jako mające „niespójny związek przyczynowy ze szczepieniem”. Po opublikowaniu instrukcji dla użytkownika dotyczących NOP, konkluzję w związku ze szczepionką MMR i autyzmem ponownie zakwestionowano (patrz Ramka 3). Owe zmienne dowody poddają w wątpliwość przydatność wdrażania tego kroku w algorytmie NOP.
Ramka 3. Szczepionka MMR a ryzyko autyzmu u dzieci afroamerykańskich.
W 2004 roku CDC opublikowały badanie dowodzące, że nie istnieje żaden związek między ryzykiem późniejszej diagnozy autyzmu u zaszczepionych dzieci a wiekiem, w którym dziecko otrzymało szczepionkę MMR a. Jednak świadectwo jednego z autorów badania, który stał się demaskatorem, dra W. W. Thompsona, ujawniły, że zagrożenie autyzmem wśród dzieci afroamerykańskich zaszczepionych przed ukończeniem drugiego roku życia było o 340% wyższe niż u dzieci zaszczepionych w starszym wieku. Dane te celowo usunięto z analizy, aby wyniki zgadzały się z ogłoszoną konkluzją CDC. CNN nadała relację wspomnianego demaskatora CDC b i Thompson otrzymał od rządu Obamy immunitet demaskatora. c
Oświadczenie dr Williama W. Thompsona
Oświadczenie dr Andrew Zimmermana – [szczepionki mogą powodować autyzm]
Krok 4
Założywszy, że nie istnieje żaden „mocny dowód zaprzeczający wystąpieniu związku przyczynowego”, reakcje, co do których nie wiadomo czy mają związek przyczynowy ze szczepionką, można przenieść do Kroku 4. To w tym miejscu reakcje można sklasyfikować jako mające nieokreślony związek ze szczepieniem, co pozwala na uznanie ich w przyszłości za nowy sygnał.
Na tym etapie pojawia się pytanie czy odczyn jest klasyfikowalny, to znaczy czy zostały przeprowadzone wszystkie testy konieczne, by można go było sklasyfikować zgodnie z definicjami przyjętymi przez CIOMS / WHO. Definicje te są przywoływane już po raz drugi w trakcie oceny NOP.
Jeżeli niektóre analizy nie zostały wykonane lub są niedostępne, Niepożądane Odczyny poszczepienne oznacza się jako mające „nieklasyfikowalny” związek ze szczepieniem (bądź klasyfikuje się jako mające „niespójny związek przyczynowy ze szczepieniem”, tak jak sklasyfikowane zostało porażenie wiotkie po zaszczepieniu szczepionką OPV, ponieważ analizy podczas choroby miesiąc przed wystąpieniem porażenia nie były dostępne – przykład ten znajduje się w Załączniku 3 na stronie 36 instrukcji dotyczących NOP[12]).
Jeśli zostałyby przeprowadzone wszystkie wymagane analizy i zdarzenia niepożądane spełniałyby kryteria definicji przypadku, na etapie Kroku 2 sklasyfikowano by je jako mające „spójny związek przyczynowy ze szczepieniem” i nie doszłyby do Kroku 4.
Trzecia możliwość dopuszcza, że przeprowadzone zostały wszystkie analizy, tak że niepożądany odczyn jest klasyfikowalny, jednakże nie spełnia definicji przypadku. Stosuje się tu następujący postulat CIOMS / WHO: „jeżeli istnieje wystarczający dowód, że odczyn nie spełnia definicji przypadku, należy go odrzucić i zgłosić jako ‘nie NOP’”. (Patrz Definicje i Zastosowanie Terminów w zakresie sprawowania nadzoru nad bezpieczeństwem szczepionek opracowane przez CIOMS / WHO strona 170[13]). Postulat ten eliminuje jakąkolwiek możliwość, że NOP, który nie został rozpoznany jako mający związek przyczynowy ze szczepieniem we wcześniejszych badaniach epidemiologicznych zostanie włączony do grupy odczynów mających „nieokreślony” związek przyczynowy ze szczepieniem i uznany za nowy sygnał. Tym samym wydaje się, że na etapie kroku 4 możliwe są wyłącznie dwie opcje: – reakcja klasyfikowana jest albo jako „nieklasyfikowalna” albo też umieszcza się ją w kategorii reakcji mających „niespójny związek przyczynowy ze szczepieniem”. Kategoryzacja odczynu poszczepiennego jako mającego „nieokreślony” lub „spójny związek przyczynowy ze szczepieniem” jest pod względem logicznym niemożliwa biorąc pod uwagę wspomniane powyżej zastrzeżenia.
Przedsięwzięcie na tym się nie kończy. Na etapie Kroku 4 analizuje się także inne czynniki kwalifikujące. Zaleca się ponownie indagowanie w związku z alternatywnymi wyjaśnieniami, a konkretnie dotyczące ogólnego wskaźnika występowania w populacji, innych schorzeń, narażenia na potencjalny czynnik ryzyka lub toksynę, ostrej choroby oraz innych leków.
Wiele spośród tych „innych czynników kwalifikujących”, jak wcześniejsza choroba czy równoczesne przyjmowanie leków wyeliminowano by przypuszczalnie na etapie Kroku 1 podczas poszukiwań dowodów na istnienie innych przyczyn. Dociekania te powtarzają się na etapie Kroku 4 całkiem niepotrzebnie. Ramka 4 przedstawia w jaki sposób – pomimo dowodów epidemiologicznych (badanie TOKEN) wskazujących, że szczepionka pięcioskładnikowa może powodować nagłą, niespodziewaną śmierć – liczne przypadki zgonów (omówione we wstępie) nie zostały uznane za skutek szczepienia, a w raporcie ekspertów z WHO zaprzecza się, że zgony te były kiedykolwiek zgłaszane jako Niepożądane Odczyny Poszczepienne. Ocena przyczynowości 132 poważnych przypadków NOP umieszczona na stronie internetowej Ministerstwa Zdrowia i Opieki nad Rodziną Indii ukazuje skutki stosowania tej nowej klasyfikacji. Zmarły 54 niemowlęta, a przeżyło 78. Ocena przyczynowości wykazała, że 50% spośród tych, które przeżyły, miało reakcje na szczepienie, jednak ani jeden zgon nie został sklasyfikowany jako mający związek ze szczepieniem. Niemal wszystkie wspomniane zgony (96%) sklasyfikowano po prostu jako nieklasyfikowalne lub przypadkowe, przypuszczalnie dlatego, że zgon nie został wcześniej uznany za zdarzenie niepożądane spowodowane przez tę konkretną szczepionkę[18]. Dzieci przyjęte do szpitala po zaszczepieniu z opornymi na leczenie drgawkami mogły być sklasyfikowane jako mające reakcję związaną ze szczepieniem, ale jeśli zmarły, przypadki te klasyfikowano jako „zgony przypadkowe”.
Ramka 4. Nagły, niespodziewany zgon (ang. sudden unexpected death, SUD) po zaszczepieniu szczepionką pięcioskładnikową a badanie TOKEN.
W odniesieniu do NOP grupa przypadków zdefiniowana jest jako jeden lub więcej przypadków tego samego zdarzenia niepożądanego związanych ze sobą czasowo lub miejscowo bądź związanych z podaną szczepionką a. Szczepionka pięcioskładnikowa spowodowała liczne zgony w Azji, ale nie uznano jej jeszcze za nowy sygnał b, c, d, e, f
Po dokonaniu korekty algorytmu NOP, zgony klasyfikowane są obecnie jako „nie NOP” na podstawie argumentu, że nie były one zgłaszane jako NOP w badaniach epidemiologicznych dotyczących konkretnej szczepionki. Jednakże badanie TOKEN zaprzecza temu twierdzeniu g.
Badanie TOKEN zostało przeprowadzone specjalnie po to, aby ocenić ewentualny związek przyczynowy między szczepieniem a niewyjaśnionym nagłym nieoczekiwanym zgonem (SUD) dzieci w wieku od 2 do 24 miesiąca życia. Von Kries ustalił wcześniej statystycznie znacząco zwiększony znormalizowany wskaźnik śmiertelności (ang. standardized mortality ratio, SMR) w ciągu dwóch dni po zaszczepieniu jedną (Hexavac®) z dwóch zarejestrowanych szczepionek sześcioskładnikowych, zaś badanie TOKEN przeprowadzono, by potwierdzić lub zaprzeczyć istnieniu tego związku g. Badanie to sponsorowały i wspierały Paul-Ehrlich-Institute (PEI) oraz Ministerstwo Zdrowia Niemiec (Bundesministerium für Gesundheit). W celu ustalenia związku czasowego między szczepieniem a nagły i niespodziewanym zgonem [SUD] zbadano serię przypadków z autokontrolą (ang. self-controlled case series, SCCS). Do wzięcia udziału w badaniu zaproszono rodziców dzieci zmarłych na SUD. Uczestniczyło w nim 37,6% uprawnionych rodziców. Naukowcy ustalili dwukrotnie większe prawdopodobieństwo, że rodzice wezmą udział w badaniu, jeśli ich dziecko zmarło w ciągu tygodnia po zaszczepieniu. Aby zrównoważyć ten brak obiektywizmu zastosowali metodę odwróconego ważenia prawdopodobieństwa. Autorzy zauważają, że metoda ta pomogła zniwelować błąd selekcji dotyczący niemowląt poniżej 9 miesiąca życia, ale mimo to wciąż jest prawdopodobne, że wyniki zawyżają ryzyko SUD u starszych dzieci.
Metoda ważenia zastosowana dla SCCS, ryzyko względne (ang. relative risk, RR) wystąpienia SUD po zaszczepieniu szczepionką pięcioskładnikową (w pierwszym i drugim roku życia) oraz analiza okresu ryzyka 0-3 dni po zaszczepieniu w porównaniu z okresem kontrolnym 4-28/183 dni wykazały RR o wartości 8.11 (p= 0.006, 95% CI=1.81-36.24; Tabela 41 w Raporcie z badania TOKEN). Metoda ważenia zastosowana dla SCCS, ryzyko względne wystąpienia SUD po zaszczepieniu szczepionką sześcio- lub pięcioskładnikową (w pierwszym i drugim roku życia) oraz analiza okresu ryzyka 0-3 dni w porównaniu z okresem kontrolnym 4-28/183 dni wykazały RR o wartości 2.19 (p= 0.031, 95% CI=1.08-4.45; Tabela 36 w Raporcie z badania TOKEN).
Z powyższych danych jasno wynika, że istnieją racjonalne dowody w badaniach epidemiologicznych, iż SUD może wystąpić jako NOP po zastosowaniu szczepionki pięcioskładnikowej, zaś zgony, do których dochodzi w następstwie użycia tej szczepionki nie powinny być a priori klasyfikowane jako „nie NOP”.
Inne przemyślne zmiany w definicjach terminów
Ponowne zdefiniowanie „związku przyczynowego”
Termin związek przyczynowy oznacza obecnie „związek przyczynowo-skutkowy pomiędzy czynnikiem sprawczym a chorobą, przy czym żaden czynnik nie może ingerować w ciąg procesów”. Jest to znaczący krok wstecz pod względem bezpieczeństwa pacjentów. Dla przykładu dawny program uznawał, że u osoby w starszym wieku z przewlekłą niewydolnością serca mogą się pojawić objawy dekompensacji układu krążenia po zaszczepieniu przeciwko grypie ze względu na podwyższenie temperatury spowodowane szczepionką lub stres wywołany reakcją miejscową w miejscu szczepienia. A zatem w tym konkretnym przypadku uznaje się, że szczepienie przyczyniło się do niewydolności serca 19.
Według nowego programu skutek ten nie zostałby uznany za związany przyczynowo ze szczepieniem. Nie postawiono by pytania czy zgon nastąpiłby w tym czasie, gdyby nie działanie szczepionki. Nie zwracając na to uwagi wiele starszych osób niepotrzebnie naraża swoje życie przyjmując tę szczepionkę. Jeżeli zgłasza się zgon niemowlęcia w następstwie szczepienia, a dziecko było niedożywione lub pod innym względem w złym stanie, nie oznacza to, że oceniając przyczynowość należy stwierdzić, że nie istnieje związek przyczynowo-skutkowy miedzy szczepieniem a zgonem.
W zakresie tej definicji nie mieszczą się oddziałujące na siebie związki przyczynowe[14,15]. Światowy Komitet Doradczy ds. Bezpieczeństwa Szczepień udokumentował liczne zgony dzieci z istniejącymi wcześniej chorobami serca po zaszczepieniu szczepionką pięcioskładnikową. WHO zaleca obecnie zachowanie środków ostrożności przy szczepieniu takich dzieci, dzięki czemu zmniejszyło się ryzyko zgonu[1]. Nowa definicja związku przyczynowego nie uznaje tej zależności, a jej stosowanie naraża na niebezpieczeństwo życie dzieci.
Według Colleta i współpracowników, możliwe jest, że u niektórych odpowiedź immunogenna na szczepionki jest silniejsza w porównaniu z ogółem populacji i z tego powodu ważne jest zrozumienie określonych genetycznie predyspozycji do pojawienia się NOP[19]. Jednakże względów tych nie bierze się pod uwagę w nowym programie oceny przyczynowości opracowanym przez CIOMS / WHO. Nie uwzględnia się także działania szczepionki prowadzącego do encefalopatii u pacjentów podatnych za sprawą czynników genetycznych[15]. Berkovic wykorzystał badania genetyczne do rozpoznania mutacji de novo w genie SCN1A w kanale sodowym u pacjentów z encefalopatią rzekomo wywołaną przez szczepienie[16]. Nie jest to rozsądne, że we wszystkich tego rodzaju przypadkach ignoruje się udział szczepienia w przyśpieszaniu encefalopatii.
Szkoda, że po tych wszystkich latach autorzy dają wiarę błędnemu przekonaniu Hume’a, że o przyczynowości można mówić tylko wówczas, gdy X jest samo w sobie wystarczające dla wystąpienia Y. Fakt, że szczepienie mogło „w znaczący sposób przyczynić się” do zdarzeń niepożądanych jest pomijany.
Wiarygodność biologiczna
Wiarygodność biologiczna to jedna z „zasad przewodnich” Bradforda Hilla potwierdzających istnienie związku przyczynowego [10]. Ogranicza ją jednak stan aktualnej wiedzy i jako takiej nie należy jej stosować do zaprzeczania istnieniu tego związku. Dla przykładu obecnie uważa się, że szczepionka o wysokim mianie przeciwko odrze wiąże się z nadmierną śmiertelnością wśród dziewczynek[20]. Związku tego jak na razie nie uznaje się z uwagi na brak wiarygodnego pod względem biologicznym wyjaśnienia. Eksperci WHO uznają obecnie, że szczepionki wykazują niespecyficzne działanie, które reguluje w górę i w dół zarówno odporność wrodzoną, jak i nabytą, co może wpływać na to czy dziecko przeżyje[21].
Niespecyficzne skutki szczepień cz.1 – dr Suzanne Humphries
Niespecyficzne skutki szczepień cz.2 – dr Suzanne Humphries
Jak działają szczepionki? W dużej mierze nie mamy pojęcia. – Dr Peter Aaby
Zależność między występowaniem wgłobienia a szczepionką przeciw rotawirusom uznawano także w czasie, gdy wiarygodne pod względem biologicznym wyjaśnienie nie było dostępne[11] (patrz Ramka 5). Szczepionka może zatem wykazywać zarówno niespecyficzne, korzystne działanie, jak i wywierać niespodziewany, szkodliwy wpływ, którego nie należy lekceważyć jedynie z tego powodu, że gotowe wytłumaczenie jego pojawienia się nie jest dostępne w czasie, w którym zauważono go po raz pierwszy.
Ramka 5. Testy szczepionki przeciwko rotawirusom w Indiach
Wstępna kwalifikacja szczepionki Rotavac bez danych dotyczących bezpieczeństwa
Szczepionkę RotaShield wycofano, jako że spowodowała 1 dodatkowy przypadek wgłobienia na 10.000 zaszczepionych nią dzieci[11].
Jednak nowa szczepionka przeciw rotawirusom, Rotavac (Bharat Biotec) została zarejestrowana po przeprowadzeniu testów w 3 ośrodkach, gdzie zaszczepiono nią całkowitą liczbę 4500 dzieci (próba zbyt mała, by wykazać rzadki odczyn występujący u 1 na 10.000 dzieci) a, b. Pomimo małej próby wydaje się, że przypadki wgłobienia po zaszczepieniu tą szczepionką c były bardzo powszechne w jednym z ośrodków (Vellore), znacznie częstsze niż w grupie kontrolnej. Lekarze przeprowadzający testy odmówili dostarczenia tych posegregowanych danych pomimo wielokrotnych próśb d. Rząd obiecał monitorować bezpieczeństwo szczepionki w okresie nadzoru po wprowadzeniu na rynek. Jednakże uczestnikom tego testu nie wyjaśniono ryzyka zaobserwowanego w badaniu klinicznym z randomizacją (ang. randomized controlled trial, RCT), zaś nadzór sprawowano przez ograniczony czas trwania okna serologicznego wynoszący kilka tygodniu po zaszczepieniu, podczas gdy niepożądane odczyny zaobserwowane w RCT wystąpiły poza tym okresem. Prawdopodobne jest, że ze względu na brak chirurgów dziecięcych oraz radiologów, w odosobnionych obszarach tego kraju, gdzie stosuje się wspomnianą szczepionkę, zgony z powodu wgłobienia są błędnie klasyfikowane jako spowodowane dyzenterią.
Jeszcze niedawno, zanim udostępniono dane dotyczące nadzoru po wprowadzeniu na rynek, WHO zakwalifikowała wstępnie omawianą szczepionkę do użytku międzynarodowego e.
Opublikowane zostały wyniki testów klinicznych innej szczepionki przeciwko rotawirusom, która redukuje biegunkę rotawirusową, ale nie zmniejsza ogólnej częstości występowania biegunki f oraz innej szczepionki, która zwiększa ogólną liczbę przypadków biegunki g zamiast ją zmniejszać.
Nowa definicja wiarygodności biologicznej
W skorygowanych instrukcjach dotyczących NOP zmieniono także znaczenie samego terminu wiarygodność biologiczna. Instrukcje te określają, że na wiarygodność biologiczną można się powoływać tylko wówczas, gdy ustalenia laboratoryjne, symptomy lub objawy są podobne bądź takie same jak naturalna historia lub patofizjologia infekcji albo antygenu. Inne wiarygodne pod względem biologicznym wyjaśnienia (wykazanie istnienia mechanizmu i możliwość dojścia od przyczyny do skutku)[7] nie kwalifikują się. Brady opisał następujące cztery podejścia do określenia przyczynowości: ustalenie regularności wywodzącej się od Hume’a, zbadanie innych hipotez, manipulacja eksperymentalna oraz analiza mechanizmów i możliwości[7]. Nowe instrukcje uwzględniają jedynie podejście eksperymentalne do wykluczenia innych zasadnych podejść, co w efekcie może prowadzić do niewykrycia przyczynowości w wielu przypadkach i do szkodliwych skutków.
Zespół przewlekłego zmęczenia a testy szczepionki HPV
Na podstawie powyższych rozważań można założyć, że zdarzenia niepożądane zgłoszone w oryginalnych badaniach klinicznych z randomizacją przeprowadzonych przed zarejestrowaniem szczepionki, sklasyfikowane będą jako zdarzenia niepożądane, co do których wiadomo, że mają związek z tą szczepionką.
SLATE: Co pominięto w badaniach klinicznych nad Gardasilem – Frederik Joelring
Czasopismo Slate przeanalizowało testy z randomizacją szczepionek przeciwko wirusowi brodawczaka ludzkiego (ang. human papillomavirus, HPV) i ustaliło, że dane o potencjalnych skutkach ubocznych zbierano tylko przez dwa tygodnie podczas trwającego rok badania. Po 2 tygodniach poszczególni naukowcy przeprowadzający te testy zdecydowali, wedle własnego uznania, czy zgłaszać problemy medyczne jako zdarzenia niepożądane. Niejednokrotnie oznaczali nowe problemy jako „nową historię medyczną”. Bólowe zapalenie mózgu i rdzenia kręgowego, znane również jako zespół przewlekłego zmęczenia (ang. chronic fatigue syndrome, CFS) to stan charakteryzujący się długotrwałym zmęczeniem, które ogranicza zdolność chorego do wykonywania zwykłych, codziennych czynności. Uczestnicy testów szczepionki HPV zgłosili Slate’owi, że wspomnianych, działających na nich destrukcyjnie objawów nie odnotowano nawet jako zdarzeń niepożądanych.
Jako że CFS nie został odnotowany jako zdarzenie niepożądane, producenci mogli utrzymywać, że choroba ta nie jest „znanym zdarzeniem niepożądanym powodowanym przez szczepienie” i tym samym wykluczać każdy zgłoszony później przypadek.
Testy szczepionki przeciw rotawirusom
Ramka 5 ukazuje jak to się stało, że do publicznej wiadomości nie podano zdarzeń niepożądanych, zarejestrowanych w badaniu klinicznym z randomizacją (RCT) i przesłanych do organu regulacyjnego w celu zatwierdzenia szczepionki i zarejestrowania jej. Jest to niezgodne z decyzją Europejskiego Trybunału Sprawiedliwości nakazującą upublicznianie raportów z badań klinicznych.
Inne problemy związane z rejestrowaniem i zgłaszaniem NOP
Ramka 6 przedstawia w jaki sposób okresowe raporty o bezpieczeństwie (ang. Periodic Safety Update Report, PSUR) 15 i 16 dotyczące szczepionki Infanrix Hexa oraz ustalenia zawarte w tych raportach zostały poddane kontroli publicznej na mocy decyzji sądu we Włoszech. Ramka 7 opisuje jak to się stało, że uwzględniając zasady Wolnego Przepływu Informacji otrzymano PSUR 19, zaś zgony zgłoszone w PSUR 16 zostały usunięte z PSUR 19, gdy było oczywiste, że liczba tych zgonów przewyższała liczbę, jaka mogła być skutkiem przypadku[22].
Transkrypt filmu pt. Ustawa z 1986 roku
W 1986 roku prezydent Stanów Zjednoczonych Ronald Reagan podpisał Narodowy Program Rekompensat dla Poszkodowanych na Skutek Stosowania Szczepionek (ang. the National Childhood Vaccine Injury Act, NCVIA) (42 U.S.C. §§ 300aa-1 do 300aa-34), na mocy którego utworzony został system oparty wyłącznie na powstaniu szkody oraz odrzucający konieczność dokumentowania winy sprawcy i jego odpowiedzialności cywilnej (system no-fault), mający służyć rekompensacie szkód powstałych w wyniku szczepień. Dokument ten utrudnił zaskarżanie do sądu producentów szczepionek. Ustanowił także system zgłaszania zdarzeń niepożądanych na skutek stosowania szczepionek VAERS (ang. Vaccine Adverse Event Reporting System) nakazujący informowanie o zdarzeniach niepożądanych. Ramka 8 przedstawia zmiany, które uniemożliwiają pacjentom pociągnięcie producentów do odpowiedzialności za szkody spowodowane przez ich produkt. Tabela 9 uwidacznia, że dane dotyczące Niepożądanych Odczynów Poszczepiennych nie są już łatwo dostępne. Podczas gdy z jednej strony nowa klasyfikacja wyklucza Niepożądany Odczyn Poszczepiennych jako „nie NOP”, dane na temat bezpieczeństwa podlegają manipulacjom, a dostęp do nich jest blokowany.
Ramka 6. Okresowe raporty o bezpieczeństwie: szczepionka niezdatna do powszechnego stosowania?
Sędzia Sądu Najwyższego we Włoszech, Nicola Di Leo, upubliczniła „poufne” Raporty o Bezpieczeństwie (PSUR) 15 i 16 dotyczące szczepionki Infanrix hexa (GlaxoSmithKline Biological) i są one obecnie dostępne w Internecie a.
Strony 246-9 dokumentują analizę liczby „nagłych zgonów” po przyjęciu szczepionki, mającą ustalić czy przewyższa ona liczbę przypadków śmiertelnych, jakiej można się spodziewać na skutek dodatkowego, naturalnego występowania nagłych zgonów. Wskaźnik występowania dodatkowych, nagłych zgonów wyniósł 0.454/1000 w pierwszym roku i 0.062/1000 żywych urodzeń w drugim roku. Nie bierze się pod uwagę ewidentnie niskiego wskaźnika zgłaszania Niepożądanych Odczynów Poszczepiennych.
W USA rejestruje się mniej niż 1% NOPów – Harvard Pilgrim Health Care
Liczba nagłych zgonów, której można się spodziewać na skutek przypadku między 1. a 20. dniem, została podana w Tabeli 36 na stronie 24. Denominator zastosowany do zbadania liczby zgonów w następstwie szczepienia to liczba rozdystrybuowanych dawek szczepionki, nie zaś zaszczepionych dzieci. Denominator ten osłabia każdy potencjalny sygnał, ponieważ dostarcza się znacznie więcej dawek szczepionki niż faktycznie się podaje!
Idąc dalej, liczba faktycznie podanych dawek może być odpowiednia dla łagodniejszych reakcji, które mogą powracać po każdej dawce, ale nie jest właściwa w przypadku zgonu, który może się zdarzyć tylko raz. Załącznik 5A pokazuje, że zgłoszono jedynie 13 przypadków śmiertelnych. Więcej przypadków zgonów wystąpiło po pierwszej dawce niż po drugiej i trzeciej, przy czym po drugiej było ich więcej niż po trzeciej. Prawidłowość tę obserwuje się zazwyczaj w odniesieniu do Niepożądanych Odczynów Poszczepiennych związanych ze sobą przyczynowo. Odpowiednim denominatorem we wszystkich tych sytuacjach jest liczba zaszczepionych niemowląt.
Jednoczesna nagła śmierć łóżeczkowa niemowląt [bliźniaków] – SSIDS
Przewodnik rodzica: Co robić jeśli twoje dziecko umiera po szczepieniu – Norma Erickson i Catherine J FrompovichW pierwszych trzech dniach po szczepieniu nastąpiły 42 zgony, podczas gdy w kolejnych trzech już tylko 16. Fakt, że zgony nastąpiły w ciągu kilku dni po zaszczepieniu wskazuje, że mogą mieć związek z sytuacją zaszczepienia.
Dane dotyczące bezpieczeństwa pacjenta w żadnym wypadku nie powinny być traktowane jako tajemnica handlowa. Praktyka polegająca na zachowaniu poufności raportów o bezpieczeństwie umożliwia manipulacje danymi w komfortowym porozumieniu z organami regulującymi, z dala od nadzoru publicznego. Praktykę tę należy zreformować.
Odporność i bezkarność: korupcja w relacjach Państwo-Farmacja – dr Paddy Rawlinson
Ramka 7. Europejska Agencja Leków (ang. European Medicines Agency, EMA) i nieistniejący nadzór regulacyjny Europejskiej Agencji Leków: brak krytycznej oceny PSUR
Interesującą lekturę stanowi 19 poufny raport o bezpieczeństwie a (PSUR 19 (zgony do 22 października 2014 roku)), dotyczący szczepionki Infanrix hexa wyprodukowanej przez GlaxoSmithKline (GSK). Infanrix hexa zawiera wszystkie składniki szczepionki pięcioskładnikowej z wyjątkiem składnika pełnokomórkowego przeciwko krztuścowi, który zastąpiono składnikiem bezkomórkowym, a dodatkowo ma w swoim składzie możliwą do wstrzyknięcia szczepionkę przeciw polio. Łączna liczba zgonów zgłoszonych w raporcie 19 jest mniejsza niż w PSUR 16. Można zauważyć, że liczba zgonów dzieci w wieku powyżej roku była znacząco wyższa niż liczba zgonów, których można się było spodziewać na skutek przypadku, gdyby przywrócono zgony usunięte z PSUR 16 b.
Szkodliwa medycyna – Sprawa GlaxoSmithKline, 750 milionów dolarów kary
Wydaje się, że EMA akceptuje raporty PSUR przedłożone przez producentów bez poddawania ich krytycznej weryfikacji. Władze regulacyjne na całym świecie polegają w takich sytuacjach na należytej staranności ze strony EMA. Być może należałoby to powtórnie przeanalizować.
Ramka 8. Odpowiedzialność za produkt: ochrona pacjentów, nie patentów.
Pięcioskładnikowa szczepionka Hexavac (DTaP-IPV-HepB/Hib) została wycofana przez producentów bez podania przyczyny na skutek zgłoszenia przez Zinkę 5 przypadków nagłej śmierci łóżeczkowej w ciągu 48 godzin od podania szczepionki a. VonKries ustalił, że w drugim roku życia znormalizowany wskaźnik śmiertelności (SMR) dotyczący przypadków nagłej, niewyjaśnionej śmierci (SUD) w ciągu 1 dnia od zaszczepienia wyniósł 31,3 (95% CI 3,8-113,1), zaś w ciągu 2 dni po zaszczepieniu 23,5 (95% CI 4,8-68,6) b.
Podobnie szczepionkę RotaShield dobrowolnie wycofano z rynku po zgłoszeniu 12 przypadków wgłobienia. Ogólny wskaźnik występowania wgłobienia w populacji w tym wieku był pięciokrotnie wyższy niż ryzyko wgłobienia na skutek przyjęcia szczepionki. Nie istniało wiarygodne biologicznie wyjaśnienie umożliwiające dostrzeżenie zależności między przypadkami wgłobienia a szczepieniem. Pomimo to szczepionka została wycofana c.
Producenci wycofali tę szczepionkę dobrowolnie bez wskazania powodu. Nie jest jasne czy na ostrożność producentów wpłynęła perspektywa procesów sądowych w związku z odpowiedzialnością za produkt.
Po 1980 roku nastąpiły dwie istotne zmiany. Ich wprowadzenie znacznie zmniejszyło ryzyko polegające na pociągnięciu producentów do odpowiedzialności za wprowadzenie na rynek wadliwego produktu.
1. W latach 80-tych i 90-tych w wielu krajach wprowadzono mechanizm kompensacji no-fault d. Oznacza to, że dzieci, które doznały szkody na skutek szczepienia mają prawo do rekompensaty bez konieczności przedstawienia wyraźnych dowodów zaniedbania jako przyczyny tej szkody. Jednak oznacza to także, że producenci nie muszą przyznawać, że ich produkt posiada wady. Obecnie ryzyko pociągnięcia do odpowiedzialności za produkt zmniejszyło się w istotnym stopniu, jako że rządy zapewniają rekompensaty za wady produktu. Mogło to ośmielić producentów do bardziej swobodnego traktowania problemu bezpieczeństwa szczepionek.
2. Druga istotna zmiana nastąpiła w 2013 roku, kiedy całkowitej modernizacji poddano metodologię oceny Niepożądanych Odczynów Poszczepiennych. Już nie wystarczy wykazać istnienia związku czasowego Niepożądanego Odczynu Poszczepiennego występującego wielokrotnie. Zamieszczony poniżej schemat blokowy przedstawia wszystkie warunki, które muszą być spełnione zanim Niepożądany Odczyn Poszczepienny zostanie oznaczony jako mający „spójny związek przyczynowy ze szczepieniem”. To również mogło ośmielić producentów do traktowania niepożądanych reakcji z mniejszą rozwagą.
Ramka 9. Utrudniony dostęp do danych dotyczących Niepożądanych Odczynów Poszczepiennych
1. Polio i ostre porażenie wiotkie w Indiach
Podczas gdy w społeczeństwie świadomość zdarzeń niepożądanych rośnie, coraz trudniej jest uzyskać dostęp do danych na temat tych niepożądanych zdarzeń. Projekt The National Polio Surveillance przedstawiał comiesięczne dane dotyczące ostrego porażenia wiotkiego w Indiach. Analiza tych danych wykazała, że w 2011 roku wystąpiło 47.500 dodatkowych, nowych przypadków zachorowań na ostre porażenie wiotkie w tym roku, a więc znacznie powyżej standardowej liczby 2/100.000 niezwiązanych z polio przypadków AFP (ang. acute flaccid paralysis, ostre porażenie wiotkie), którą ogólnie przyjmuje się za normę. Wskaźnik zachorowań na AFP niezwiązane z polio był najlepiej skorelowany z łączną liczbą dawek przyjętych w ciągu poprzednich trzech lat a. Analizę powtórzono po 2 latach, gdy zmniejszeniu uległa liczba dawek podawanych dzieciom w wieku poniżej 5 lat. Wykazała ona, że wskaźnik zachorowań na AFP zaczął się zmniejszać b.
Jednakże dane te nie są już dostępne na stronie internetowej National Polio Surveillance Project/WHO.
2. Wydruk Analizy Danych dotyczących Szczepionek
Urząd Rejestracji Produktów Leczniczych i Wyrobów Medycznych (ang. Medicines and Healthcare Products Regulatory Agency, MHRA), będący agencją rządową Wielkiej Brytanii, zapewnia łatwo dostępne Wydruki Analizy Preparatów oraz interaktywne Oceny Profilu Bezpieczeństwa Preparatów (ang. Drug Analysis Profiles (iDAPs)) na powiadomienia na „żółtych kartkach” o zdarzeniach niepożądanych. Nie dotyczy to jednak szczepionek. O dane na ich temat należy wystąpić do Nadzoru nad Bezpieczeństwem Farmakoterapii MHRA.
Wiarygodność biologiczna: niepożądane odczyny na szczepionki wielowalentne
Analizując w systemie VAERS dane dotyczące zgonów po szczepieniu, Goldman i współpracownicy ustalili, że śmiertelność była wyższa wśród niemowląt, które otrzymały jednocześnie pięć do ośmiu szczepionek w porównaniu do dzieci, które otrzymały ich mniej [23]. W sprawie Boatmana przeciwko Sekretarzowi Zdrowia i Opieki Społecznej, 13-611 (Fed. CI 2017) dotyczącej 4-miesięcznego niemowlęcia, któremu podano 7 antygenów szczepionkowych tego samego dnia, sąd po wysłuchaniu opinii ekspertów uznał, że stymulowane przez szczepionki cytokiny prozapalne mogą działać jako neuromodulatory oraz powodować zahamowanie funkcjonowania w szpiku niemowlęcia serotoninergicznego systemu, na który składa się 5-hydroksytryptofan, a także osłabić prawidłową, wrażliwą na chemioterapię reakcję na nadmiar dwutlenku węgla, to zaś może prowadzić do zgonu wrażliwych niemowląt podczas snu. Duża liczba szczepionek wywołuje większe uwalnianie się cytokin. W ten sposób mogą być spełnione kryteria Hilla dotyczące zależności między nasileniem występowania czynnika ryzyka i jego skutkiem (w tym przypadku liczbą antygenów) [10].
Liczba szczepionek na raz, ograniczona do 5 we włoskiej armii
Stymulowane przez szczepionki cytokiny szkodzą nie tylko niemowlętom. W końcowym raporcie Komisji Parlamentu Włoskiego (Dok. XXII-bis N.23) z badań przypadków zgonów i poważnych uszczerbków na zdrowiu włoskiej załogi wysłanej na misje wojskowe za granicę znajduje się zalecenie, aby w celu uniknięcia zdarzeń niepożądanych, załodze wojskowej nie podawać jednocześnie więcej niż 5 pojedynczych dawek szczepionek jednoskładnikowych. Wszystko to wskazuje na potrzebę zachowania ostrożności przy jednoczesnym stosowaniu znacznej liczby szczepionek. Jak na ironię, mimo zakazu stosowania szczepionki Hexavac (zawierającej łącznie 6 antygenów) u zdrowych, dorosłych żołnierzy, w dalszym ciągu jest ona zarejestrowana do szczepienia niemowląt we Włoszech.
Skorygowana klasyfikacja NOP a zasady ostrożności
Z powyższych rozważań wynika wyraźnie, że skorygowany program oceny Niepożądanych Odczynów Poszczepiennych stworzony przez CIOMS / WHO został tak opracowany, aby odrzucić możliwość, że jakiekolwiek, zaobserwowane po raz pierwszy zdarzenie niepożądane może mieć związek przyczynowy ze szczepieniem. W instrukcjach dotyczących NOP znajduje się zapis:
„Na zarzuty, że szczepionki powodują zdarzenia niepożądane należy reagować szybko i skutecznie. Zaniedbania w tym względzie mogą osłabić zaufanie do szczepionki i ostatecznie przynieść dramatyczne skutki w postaci spadku liczby zaszczepionych osób…” [12]
Ilustracja 2 pokazuje w jaki sposób wszystkie przypadki NOP z wyjątkiem znanych jako niepożądane skutki szczepień klasyfikowane są jako niezwiązane przyczynowo.
Ilustracja 2. Czy odczyny wystąpiły po szczepieniu?
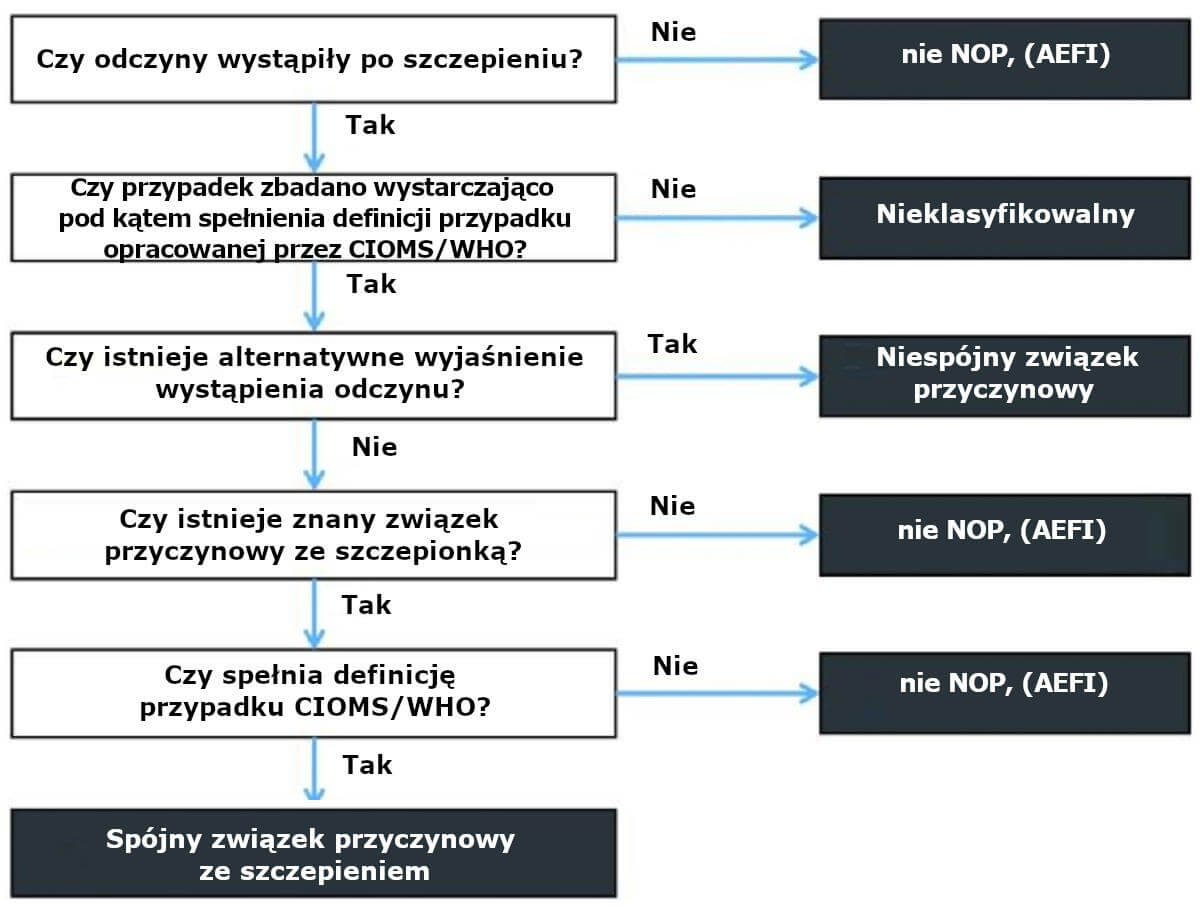
Droga do osiągnięcia statusu „spójny związek przyczynowy ze szczepieniem”.
Negowanie istnienia NOP stanowi ewidentne naruszenie „zasady ostrożności” (prawa Unii Europejskiej), która głosi, że „kiedy jakieś działanie może zagrażać środowisku lub zdrowiu ludzi, należy podjąć środki ostrożności, nawet jeśli naukowo nie ustalono do końca związku przyczynowo-skutkowego. Wzywa się społeczeństwo i rząd do tego, aby do czasu, kiedy zostanie przedstawiony pełny dowód naukowy, w sytuacjach, gdy można udowodnić ryzyko, podejmowały środki ostrożności”. Nowy program klasyfikacji NOP, który zezwala na bezpośrednie negowanie istnienia jakiegokolwiek nowego związku ze szczepieniem może także być sprzeczny z Artykułem 2 Europejskiej Konwencji Praw Człowieka (Art 2 ECHR) nakazującym, by rządy ustanowiły ramy prawne i środki ostrożności, których egzekwowanie, w największym racjonalnie możliwym do wykonania zakresie, będzie chronić życie.
Paradoksalnie utrzymuje się, że algorytm dotyczący Niepożądanych Odczynów Poszczepiennych służy bezpieczeństwu szczepień. Być może potrzeba nam planu służącemu bezpieczeństwu publicznemu, nie zaś szczepień.
Historię szczepionki pięcioskładnikowej przedstawiono na początku niniejszej analizy krytycznej i streszczono w Tabeli 10. Szczepionka ta jest stosowana przede wszystkim w krajach rozwijających się, gdzie nadzór nad NOP jest słaby, prasa jest mniej skłonna, by donosić o zdarzeniach niepożądanych, a regulacje dotyczące leków są mniej rygorystyczne. (W bogatszych krajach na Zachodzie, w Europie i w Stanach Zjednoczonych nie stosuje się szczepionki pełnokomórkowej przeciwko krztuścowi, a zatem szczepionka ta nie jest produkowana w tych krajach.) Relacje o odosobnionych przypadkach niewyjaśnionych zgonów nadal pojawiają się w prasie. Zgodnie z nową klasyfikacją NOP, w sytuacji, kiedy brak „dowodu epidemiologicznego” łączącego zgony ze szczepionką, zdarzenia te uchodziły za „przypadkowe” zgony z diagnozą SIDS. Jednakże obecnie istnieją dowody epidemiologiczne, które wiążą wspomniane zgony ze szczepionką.
Ramka 10. Szczepionka, która zmieniła definicję Niepożądanego Odczynu Poszczepiennego
Historia szczepionki pięcioskładnikowej
W 1949 roku wprowadzono a szczepionkę przeciwko błonicy, tężcowi i krztuścowi [DTP]. Pierwsze dwie z tych chorób niejednokrotnie kończyły się zgonem. Jednakże DTP powodowała niepożądane skutki neurologiczne, padaczkę, encefalopatię oraz spadki ciśnienia (ang. hypotensive episodes, HHE) b. Opracowano więc bezkomórkową szczepionkę DTaP, która na Zachodzie zastąpiła DTP.
Film Szczepionka DPT: Szczepionkowa Ruletka [kwiecień 1982]
Film Zabija czy Leczy: Szczepionka DTP – Zastrzyk w ciemno [1983]
Szczepionka przeciwko wirusowemu zapaleniu wątroby typu B (WZW B) – dr Suzanne HumpriesW 1981 roku wprowadzona została szczepionka przeciw wirusowemu zapaleniu wątroby typu B a. Schorzenie to może powodować przewlekłą chorobę wątroby oraz raka wątrobowokomórkowego (ang. hepatocellular carcinoma, HCC), zwłaszcza jeśli do infekcji dojdzie zaraz po urodzeniu. W krajach rozwijających się niewielka liczba dzieci otrzymywała tę szczepionkę. Jedną z przyczyn był fakt, że pomimo iż WZW B często występowało w krajach o potencjalnie dużej liczbie szczepień, takich jak Indie, zachorowalność na HCC była bardzo niska c. Obecnie sądzi się, że nowonarodzone dzieci w Indiach mogą być chronione w pierwszych latach życia (kiedy prawdopodobieństwo zostania przewlekłym nosicielem jest najwyższe) dzięki odporności biernej przekazywanej niemowlętom przez matkę. Powszechne stosowanie szczepionki mogą sprawić, że dzieci utracą tę odporność i doprowadzić do paradoksalnego wzrostu liczby zachorowań na HCC d.
W 1987 roku wprowadzono szczepionkę skoniugowaną z białkiem przeciw Haemophilus influenza typu b (Hib). Zachorowalność na to inwazyjne schorzenie jest w Azji niewielka e, być może ze względu na odporność krzyżową ze strony innych bakterii posiadających antygeny reagujące krzyżowo z otoczkowym polisacharydem Hib f. Szczepienia przeciwko Hib było w Azji wykonywane na znikomą skalę.
Mówi się, że szczepionkę pięcioskładnikową wprowadzono, aby zwiększyć liczbę szczepień przeciwko Hib i WZW B przez połączenie nowych, nie w pełni wykorzystanych szczepionek z wcześniejszą szczepionką w ramach UIP (ang. Universal Immunization Programme, Uniwersalny Program Szczepień), taką jak DTP, jako sposób na to, by nowe szczepionki mogły „na barana” wjechać do UIP g. Szczepionkę pięcioskładnikową stosowano tylko w tych krajach rozwijających się, które nie przeszły na szczepionkę DTaP.
Szczepionka pięcioskładnikowa wiąże się z przypadkami zgonów. Prowadząc dochodzenie w związku ze zgonami w Sri Lance, zamiast zgłosić, że szczepionka ta „prawdopodobnie” miała związek ze szczepionką, eksperci WHO usunęli kategorie „prawdopodobny” i „możliwy” z klasyfikacji Brighton. O tej improwizacji ad hoc poinformowały czasopisma medyczne. Klasyfikacja Niepożądanych Odczynów Poszczepiennych została następnie skorygowana, tak aby wszystkie reakcje (w tym przypadku zgony) zaobserwowane po raz pierwszy w badaniach w Fazie 4 (badania po wprowadzeniu szczepionki na rynek) można było sklasyfikować jako mające „niespójny związek przyczynowy ze szczepieniem” i aby mogły uchodzić za „przypadkowe zgony z diagnozą SIDS”.
Niedawno przeprowadzone badanie, obejmujące 45 milionów niemowląt zaszczepionych szczepionką DTP i 25 milionów, które otrzymały szczepionkę pięcioskładnikową, dostarcza obecnie dowodów epidemiologicznych, że prawdopodobieństwo zgonu po szczepionce pięcioskładnikowej było dwukrotnie wyższe (OR 1,98 (95% CI 1,65 do 2,38)) w porównaniu do DTP. W ciągu 72 godzin nastąpiły 122 dodatkowe zgony (95% CI: 101-145), zgłoszone do rządowego systemu nadzoru i spowodowane przejściem z DTP na szczepionkę pięcioskładnikową. Znacznej liczby tych zgonów można by było uniknąć, gdyby instrukcje dotyczące NOP nie zostały skorygowane i gdyby Niepożądane Odczyny Poszczepienne oceniono wcześniej. W rzeczywistości zostało dobrze udokumentowane, że szczepionka skojarzona przeciwko DTP-WZW B-Hib wywołuje więcej reakcji miejscowych i jest mniej skuteczna niż wówczas, gdy podaje się osobne szczepionki h. Stosowanie oddzielnych, nieskojarzonych szczepionek zapewniłoby skuteczniejszą ochronę przed powyższym chorobami.
Aby zbadać czy zgony po zaszczepieniu szczepionką pięcioskładnikową były po prostu przypadkowymi zgonami na SIDS, przeprowadzono badanie obejmujące 45 milionów niemowląt, którym podano szczepionkę DTP i 25 milionów niemowląt, które otrzymały szczepionkę pięcioskładnikową. W badaniu założono, że wszystkie zgony (zgłoszone przez zainteresowanych rodziców do rządowego systemu nadzoru w ciągu 72 godzin po szczepieniu) kojarzone z DTP mogły być przypadkowymi zgonami z diagnozą SIDS, ale należy założyć, że jakikolwiek wzrost wskaźnika śmiertelności po zaszczepieniu szczepionką pięcioskładnikową był spowodowany przez tę szczepionkę. Prawdopodobieństwo zgonu po szczepionce pięcioskładnikowej było dwukrotnie wyższe (OR 1,98 (95% CI 1.65 to 2.38)) w porównaniu z DTP. Nastąpiły 4,7 dodatkowe zgony (95% CI: 3,5-5,9) na milion niemowląt zaszczepionych szczepionką pięcioskładnikową zamiast DTP (p<0,0001). Zanim zebrano te dowody, do rządowego systemu zgłoszono dodatkowe 122 zgony (95% CI: 101-145) spowodowane przejściem z DTP na szczepionkę pięcioskładnikową. Udział nowej klasyfikacji NOP w tym opóźnionym rozpoznaniu omawianego problemu jest ewidentny[24].
Konieczność dokonania korekty klasyfikacji Brighton
W skorygowanej klasyfikacji usunięto kategorie „prawdopodobny” i „możliwy” z klasyfikacji NOP – zupełnie tak, jak postąpili eksperci badający sprawę zgonów w Sri Lance. Wydaje się, że było to umotywowane godnym pochwały pragnieniem zmniejszenia niepewności związanej ze szczepieniami i towarzyszącego ryzyka choroby możliwej do uniknięcia dzięki szczepionce. W raporcie ze Sri Lanki czytamy, „Przypadki zostały w tym przeglądzie sklasyfikowane jako mało prawdopodobne, podczas gdy, pomimo braku dowodów, że szczepionka(i) przyczyniła(y) się do skutku ubocznego lub skutku w postaci zgonu, nie istniał decydujący dowód alternatywnej przyczyny (lub przyczyn) tego zdarzenia i skutku. Oznaczało to, że uznaliśmy, iż zaklasyfikowanie NOP do kategorii „niezwiązany” nie było w pełni uzasadnione (jako że nie mogło być w sposób decydujący przypisane do innej przyczyny). W takich przypadkach idziemy o krok dalej i stwierdzamy, że konkluzja „mało prawdopodobny” oznacza, iż szczepionka nie jest główną przyczyną zgonu nawet w tych przypadkach, w których rozważamy możliwość, że szczepionka ta lub szczepienie mogło ujawnić podstawową chorobę”.
Wydaje się, że eksperci ze Sri Lanki niechętnie sklasyfikowali te zgony nawet jako mające „mało prawdopodobny” związek ze szczepieniem, gdyż mogłoby to zostać zinterpretowane jako sugerowanie pewnego prawdopodobieństwa istnienia związku przyczynowego. Oto cytat z raportu, „Mało prawdopodobny: Definiując tę kategorię, panel wziął pod uwagę fakt, że kategoria ‘mało prawdopodobny’ według WHO interpretowana jest często w taki sposób, że występuje (odwrotnie) pewne prawdopodobieństwo istnienia związku przyczynowego między zdarzeniem niepożądanym a podaną szczepionką (szczepionkami)”.
Można się domyślać, że te same argumenty i motywacja (aby złagodzić niepokój społeczny dotyczący związku przyczynowego między NOP a szczepieniami) dostarczyły impulsu do skorygowania klasyfikacji NOP.
Skutki
To, że szczepionki robią więcej dobrego niż złego uznaje się za domenę wiary, dogmat, doktrynę. Jeżeli celem tej negacji istnienia Niepożądanych Odczynów Poszczepiennych jest zapobieganie osłabianiu wiary w szczepionki, zamysł ten nie wydaje się skuteczny. W istocie można wręcz odnieść wrażenie, że sceptycyzm społeczny rośnie, nie zaś maleje w obliczu tych starań mających na celu utwierdzanie w przekonaniu, że szczepionki są bezpieczne [25, 26]. Skutkiem są epidemie chorób, którym zapobiegają szczepionki[27].
Odpowiedzią na tę sytuację było wprowadzenie w niektórych stanach USA obowiązkowych szczepień przed przyjęciem do szkół publicznych. Od 1 lipca 2016 roku w Kalifornii nie zwalnia się z tego obowiązku ze względu na przekonania osobiste i religijne. Debaty republikańskich kandydatów na prezydenta USA w 2016 roku wskazują, że nie ma szeroko rozpowszechnionego poparcia dla tej decyzji. W ramach działalności Biura Praw Obywatelskich Departamentu Zdrowia i Usług Społecznych utworzono niedawno Wydział ds. Wolności Sumienia i Wyznania, do którego pojedyncze osoby mogą składać skargi, jeśli ich wolność sumienia lub wyznania została ograniczona. To w jaki sposób siły te będą na siebie oddziaływać pozostaje w sferze domysłów, jednak obecny scenariusz źle wróży publicznemu zaufaniu do szczepionek i dobrowolnych szczepień.
Co dalej
Należy pilnie dokonać ponownej oceny i korekty instrukcji dotyczących Niepożądanych Odczynów Poszczepiennych. Musimy stworzyć skuteczniejszy system, który będzie wyłapywał problemy, a jednocześnie nie spowoduje utraty zaufania do szczepionek, dzięki którym nastąpiło znaczne obniżenie śmiertelności dzieci.
Liczba niepożądanych reakcji i zgonów może nie być istotnie zwiększona w badaniach bezpieczeństwa na niewielką skalę. Jednak dokumentację wszystkich przypadków zgonów oraz poważnych, poszczepiennych zdarzeń niepożądanych należy przechowywać i okresowo przeglądać w celu wychwycenia sygnałów bezpieczeństwa. Praktyka polegająca na odrzucaniu tej dokumentacji jako mającej „niespójny związek przyczynowy ze szczepieniem” musi ulec zmianie. Porównania zdarzeń niepożądanych wywołanych przez szczepionki podanych dzieciom w tym samym wieku, jak uczyniono w przypadku szczepionki DTP i szczepionki pięcioskładnikowej, mogą pomóc w rozpoznaniu zdarzeń niepożądanych wywołanych przez jedną z tych szczepionek. Częstotliwość występowania takich skutków u obu płci również może stanowić wskazówkę. Wydaje się słuszne, abyśmy – do czasu, kiedy opracujemy skuteczniejszy system – polegali na sprawdzonych kategoriach przyczynowości opracowanych przez WHO-UMC i na kategoriach Brighton oraz dmuchali na zimne w kwestii bezpieczeństwa dzieci.