Tiomersal i autyzm – badanie kliniczno-kontrolne z użyciem bazy danych bezpieczeństwa szczepionek [VSD] – David A. Geier i inni. Szczepionka przeciwko wirusowemu zapaleniu wątroby typu B zawierająca tiomersal a ryzyko diagnozy specyficznych opóźnień rozwoju w Stanach Zjednoczonych: badanie kliniczno-kontrolne z użyciem bazy danych bezpieczeństwa szczepionek
Źródło: N Am J Med Sci. 2014 Oct; 6(10): 519–531; Thimerosal-Containing Hepatitis B Vaccination and the Risk for Diagnosed Specific Delays in Development in the United States: A Case-Control Study in the Vaccine Safety Datalink
Szczepionka przeciwko wirusowemu zapaleniu wątroby typu B zawierająca tiomersal a ryzyko diagnozy specyficznych opóźnień rozwoju w Stanach Zjednoczonych: badanie kliniczno-kontrolne z użyciem bazy danych bezpieczeństwa szczepionek
Poniższa publikacja oparta jest na bazie danych bezpieczeństwa szczepionek [Vaccine Safety Datalink]. Zanim przejdziemy do tytułowej publikacji zamieścimy fragment z książki pt. „Autyzm: Diagnoza, Leczenie i etiologia Niezaprzeczalnej Epidemii”, który nakreśla kontekst odnośnie tej bazy danych.
„Kluczowe badanie przeprowadzone przez Verstraetena i in. [badano związek tiomersalu z autyzmem] oraz główny temat konferencji Simpsonwood nigdy nie zostało opublikowane; w rzeczywistości Centrum Kontroli i Prewencji Chorób [CDC] starało się później uniemożliwić niezależnym badaczom uzyskanie dostępu do danych z których korzystał. Baza danych bezpieczeństwa szczepionek [Vaccine Safety Datalink – VSD] została utworzona w 1997 roku w celu zapewnienia „adekwatności nadzoru nad znaczącymi niepożądanymi odczynami poszczepiennymi i ogólnego bezpieczeństwa rutynowych szczepień” (RT Chen i in., 1997, s. 772). Opieka nad tą bazą została przekazana z rąk instytucji publicznej w ręce prywatnego podmiotu, co blokuje do niej dostęp. Niektórzy spekulują, że outsourcing był krokiem, który uniemożliwił niezależnym badaczom i opinii publicznej uzyskanie dostępu na mocy prawa. W efekcie przekazanie [outsourcing] tej bazy danych przez CDC, unieważniło możliwość wnioskowania o dostęp do niej na mocy ustawy o wolności informacji [Freedom of Information Act].
W 2002 roku Amerykańskie Stowarzyszenie Planów Zdrowotnych [A merican Association of Health Plans – AAHP] otrzymało kontrakt o wartości 190 mln dolarów i przejęcie kontroli nad bazą Vaccine Safety Datalink oraz skuteczne jej ukrycie przed widokiem publicznym (CDC, Procurements and Grants Office, 2002; patrz także RF Kennedy, Jr., 2005, s. 27). Zwolennicy zapobiegania publicznemu dostępowi do bazy Vaccine Safety Datalink argumentowali, że dane, które są teraz pod nadzorem AAHP, muszą być przechowywane z dala od niezależnych badaczy w celu ochrony tożsamości osób widniejących w tej bazie danych (patrz Institute of Medicine, 2005). Jednak jeden wytrwały zespół badaczy, David A. Geier i jego ojciec Mark R. Geier, po miesiącach wyczerpującej pracy, przekopywania się przez stosy papierów i procedur, wspiął się na biurokratyczny Everest – w końcu uzyskali dostęp do części danych, choć biurokraci z CDC powiedzieli im, że oryginalne dane z pracy Verstractena zostały utracone.” – Autism: The Diagnosis, Treatment, & Etiology of the Undeniable Epidemic
Abstrakt
Kontekst badania: W ciągu pierwszych 3 lat życia mózg rozwija się w szybkim tempie. Jego rozwój charakteryzują kluczowe okresy rozwojowe w sferach mowy, wzroku, słuchu, języka, równowagi itp., zaś zmiany następujące w którymkolwiek z procesów zachodzących w tych kluczowych okresach mogą prowadzić do specyficznych opóźnień rozwoju.
Cele badania: Omawiane badanie przeprowadzono, aby ocenić przypuszczalnie toksyczne działanie rtęci organicznej zawartej w tiomersalu (49,55% rtęci wagowo) wchodzącym w skład szczepionek przeciwko chorobom wieku dziecięcego i jego potencjalnie możliwy związek ze specyficznymi opóźnieniami rozwoju.
Materiały i metody: Przeprowadzono badanie kliniczno-kontrolne sprawdzające hipotezę w celu dokonania oceny związku między zawierającą tiomersal szczepionką przeciwko wirusowemu zapaleniu wątroby typu B (WZW B) podawaną w określonych odstępach czasu w ciągu pierwszych 6 miesiącach życia przypadkom ze zdiagnozowanymi specyficznymi opóźnieniami rozwoju oraz pacjentom w grupie kontrolnej urodzonym w latach 1991-2000 z wykorzystaniem informacji zawartych w bazie danych bezpieczeństwa szczepionek [Vaccine Safety Datalink].
Wyniki: U przypadków poddanych badaniu wystąpiło znacznie wyższe prawdopodobieństwo niż u przypadków w grupie kontrolnej ekspozycji na wysoką dawką rtęci organicznej z tiomersalu w szczepionce przeciwko WZW B podawanej w pierwszym, drugim i szóstym miesiącu życia.
Wnioski: Mimo że rutynowe szczepienia w okresie dzieciństwa mogą stanowić ważne narzędzie utrzymania zdrowia publicznego służące obniżeniu zachorowalności i śmiertelności spowodowanej przez choroby zakaźne, omawiane badanie wspiera związek między rosnącym kontaktem z rtęcią organiczną w szczepionkach wieku dziecięcego zawierających tiomersal a ryzykiem późniejszej diagnozy specyficznych opóźnień rozwoju u chłopców i dziewczynek.
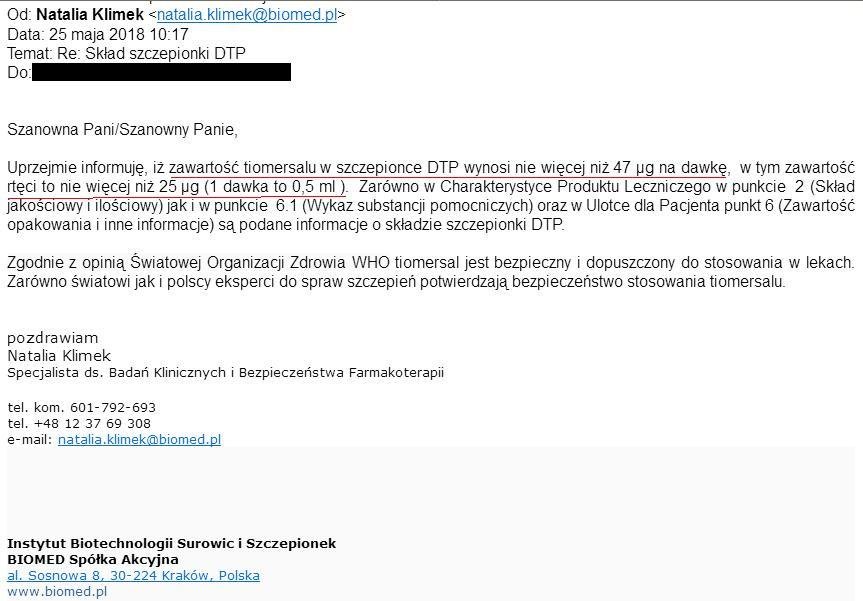
Uprzejmie informuję, iż zawartość tiomersalu w szczepionce DTP wynosi nie więcej niż 47 µg na dawkę, w tym zawartość rtęci to nie więcej niż 25 µg (1 dawka to 0,5 ml ).
Wstęp
Do mniej więcej 3 roku życia mózg rozwija się w szybkim tempie. W tym czasie jego rozwój charakteryzują określone kluczowe okresy rozwojowe. Rozwój mózgu jest niezwykle skomplikowany i obejmuje wiele skoordynowanych procesów i zdarzeń.[1] Te charakteryzujące się podatnością okresy zwiększonej aktywności, podczas których zachodzą liczne procesy mogą tworzyć okna wrażliwości dla rozwijającego się mózgu. Jeśli dany proces rozwojowy nie zachodzi lub ulega zmianie, okresu rozwojowego nie można w pełni przywrócić, a to z kolei prowadzi do nieprawidłowości w mózgu specyficznych dla danego obszaru i określonego czasu.[1,2] Zdolność mózgu do regeneracji i naprawy jest bardzo ograniczona, gdy proces rozwojowy ulega zawieszeniu lub opóźnieniu pod wpływem czynników wewnętrznych bądź zewnętrznych.[1,3] Zdolność mózgu do odzyskania utraconego okna rozwoju i procesów, które by z nim korespondowały praktycznie przestaje istnieć w następstwie takiej zmiany, co prowadzi do długotrwałych lub stałych szkodliwych skutków różniących się stopniem nasilenia.[1] Badania sugerują, że wiele kluczowych okresów rozwojowych następuje po urodzeniu, w tym dotyczące wzroku, słuchu, języka, równowagi itp. i że zmiana któregokolwiek z tych okresów lub procesów zachodzących w ich trakcie może prowadzić do specyficznych opóźnień rozwoju.
Przedmiotem zainteresowania jest zatem gwałtowny wzrost liczby przypadków specyficznych opóźnień rozwoju w ostatnich dwóch dekadach,[4] niepokojąca tendencja, która pociąga za sobą kosztowne skutki dla rodziny i społeczeństwa.[1] Do chwili obecnej nie osiągnięto zgody co do przyczyny lub czynników przyczyniających się do tego wzrostu. Wiele pytań dotyczących potencjalnego udziału dziedziczenia i podatności genetycznej, interakcji czynników genetycznych i środowiskowych oraz czynników epigenetycznych lub środowiskowych w specyficznych opóźnieniach rozwoju pozostaje bez odpowiedzi.
Badania jednak wykazały, że kontakt z metalami ciężkimi, zwłaszcza z rtęcią (Hg) stanowi czynnik ryzyka dla specyficznych opóźnień rozwoju,[5,6] i że kontakt dzieci z rtęcią wzrasta.[7] Dodatkowe badania udowodniły, że poziom rtęci zwiększa się zarówno w środowisku, jak i w organizmach ludzi. Dla przykładu badacze poinformowali o trendach czasowych na poziomie rtęci nieorganicznej we krwi 6.174 kobiet w wieku 18-49 lat w bazach danych z badania National Health and Nutrition Examination Survey (NHANES) przeprowadzonego w latach 1999-2006.[8] Badanie to udokumentowało, że procent kobiet z możliwym do wykrycia poziomem rtęci nieorganicznej we krwi wzrósł gwałtownie z 2% w latach 1999-2000 do 30% w latach 2005-2006. Dodatkowo średnie stężenie Hg nieorganicznej we krwi w populacji znacząco się zwiększyło w tym samym okresie z 0,33-0,39 µg/L. Poziom Hg nieorganicznej wiązał się istotnie z wiekiem, wskazując na bioakulumację. W badaniu stwierdzono, że odkładanie się Hg nieorganicznej w organizmie ludzkim jest procesem kumulatywnym nasilającym się u pojedynczej osoby z wiekiem, a w populacji z czasem, na skutek przewlekłego kontaktu z Hg.
Jako że Hg ulega bioakumulacji, niepokój budzi łączne narażenie na ten pierwiastek z różnych źródeł, zwłaszcza w obliczu podstawowej ekspozycji, które wydaje się zwiększać. Z tego powodu należy ocenić każde źródło, którego można uniknąć. Addytywne skutki narażenia na Hg z różnych źródeł mogą potencjalnie prowadzić do wzrostu całkowitego kontaktu dziecka z tym pierwiastkiem z bezobjawowego poziomu przewlekłej ekspozycji do poziomu klinicznego, na którym występują oczywiste specyficzne opóźnienia rozwoju. Szczególne obawy budzi ekspozycja na Hg organiczną, na jaką dziecko narażone jest poprzez kontakt z tiomersalem, konserwantem na bazie rtęci, wciąż rutynowo stosowanym składnikiem receptur niektórych szczepionek.
Tiomersal jest elementem zawierającym rtęć organiczną (49,55% Hg wagowo) i dodawanym do szczepionek jako środek konserwujący zazwyczaj w stężeniach nominalnych od 0,005 do 0,01% (12,5 µg lub 25 µg Hg na 0,5 mL dawki szczepionki).[9] Wiadomo, że tiomersal w szybkim tempie dysocjuje w soli fizjologicznej w chlorek etylortęci, wodorotlenek etylortęci i trójsalicylan sodu. Skutkiem przestrzegania programu zalecanych szczepień rutynowych przeciwko chorobom wieku dziecięcego w latach 90-tych w Stanach Zjednoczonych, niemowlęta w ciągu pierwszych sześciu miesięcy życia mogły otrzymywać z zawierających tiomersal szczepionek jednorazową dużą dawkę Hg nominalnie wahającą się od 12,5 µg do 62,5 µg i łącznie osiągającą wysokość nominalą 200 µg (> 50% całkowitego kontaktu z Hg jeśli wziąć pod uwagę źródła środowiskowe).[9] Powyższy schemat dawkowania stosowany jest nieustannie w wielu krajach rozwijających się do dnia dzisiejszego. Nawet w Stanach Zjednoczonych, pomimo wezwania Amerykańskiej Akademii Pediatrii i Amerykańskiej Służby Zdrowia Publicznego do usunięcia tiomersalu ze wszystkich szczepionek 7 lipca 1999 roku[10], wiele amerykańskich dzieci nadal otrzymuje znaczne dawki Hg z rutynowo zalecanych szczepionek przeciw grypie zawierających tiomersal (ponad 50% wszystkich dawek szczepionki przeciwko grypie wciąż ma w składzie 0,01% tiomersalu), którymi szczepi się kobiety w ciąży, niemowlęta oraz małe dzieci.[9]
Celem omawianego badania była ocena zasadności obaw związanych z toksycznym działaniem rtęci organicznej pochodzącej z tiomersalu w szczepionkach przeciwko chorobom wieku dziecięcego w drodze badania kliniczno-kontrolnego udokumentowanej ekspozycji na różne poziomy tiomersalu ze szczepionek. Przeprowadzono badanie sprawdzające hipotezę celem dokonania oceny związku między kontaktem z rtęcią organiczną z tiomersalu wchodzącego w skład szczepionek przeciw WZW B podawanych w określonych odstępach czasu w ciągu pierwszych 6 miesięcy życia a ryzykiem diagnozy specyficznych opóźnień rozwoju w bazie danych bezpieczeństwa szczepionek (ang. Vaccine Safety Datalink, VSD).
Materiały i metody
Zastosowany protokół badania został zatwierdzony przez Amerykańskie Centra Kontroli i Prewencji Chorób (ang. US Centers for Disease Control and Prevention, CDC), Niezależną Komisję Etyczną (ang. Institutional Review Board, IRB) Kaiser Permanente North-West (KPNW) oraz IRB Kaiser Permanente Northern California (KPNC). Dane przeanalizowano w bezpiecznym Centrum Danych Badawczych Narodowego Centrum Statystyk Zdrowotnych w Hyattsville w stanie Maryland. Poglądy wyrażone w kontekście omawianego badania niekoniecznie odzwierciedlają opinie CDC i Kaiser Permanente.
Określenie populacji narażonej na ryzyko
Włączoną do projektu bazę danych bezpieczeństwa szczepionek [VSD] (aktualizowaną do końca 2000 roku) z KPNW, Kaiser Permanente Colorado (KPC) i KPNC kohortę niemowląt zbadano z użyciem programu SAS. Projekt VSD został utworzony w 1991 roku przez Narodowy Program Szczepień (ang. National Immunization Program, NIP), będący oddziałem CDC, przy czym gromadzenie danych do VSD oraz metody zastosowane w badaniu zostały opisane powyżej.[11,12,13,14] Projekt ten łączy dane na temat zdarzeń medycznych, specyficzną historię szczepień i wybrane informacje dotyczące demografii ze skomputeryzowanych baz danych kilku prywatnych organizacji opieki zdrowotnej (ang. healthcare maintenance organizations, HMOs). Poddana badaniu kohorta obejmowała pacjentów, dla których wprowadzono datę urodzenia i płeć, zapisanych do HMO od chwili narodzin.
Dobór przypadków
Następnie skontrolowana została dokumentacja związana z wynikami leczenia (diagnozy pacjentów hospitalizowanych i dochodzących) pacjentów z tej populacji w celu ustalenia pierwszego przypadku sklasyfikowanych według międzynarodowej statystycznej klasyfikacji chorób i problemów zdrowotnych (ang. International Classification of Disease, 9th revision – ICD-9) specyficznych opóźnień w rozwoju, takich jak: zaburzenia czytania, niespecyficzne (315.00), aleksja (315.01), dysleksja rozwojowa (315.02), trudności z pisownią (315.09), dyskalkulia (315.1), zaburzenia ekspresji pisemnej (315.2), zaburzenia ekspresji mowy (315.31), mieszane receptywno-ekspresyjne zaburzenia języka (315.32), opóźnienie w rozwoju mowy i języka spowodowane utratą słuchu (315.34), rozwojowe zaburzenia artykulacji (315.39), rozwojowe zaburzenia koordynacji (315.4), mieszane zaburzenia rozwojowe (315.5), inne specyficzne opóźnienia rozwoju (315.8) oraz niespecyficzne opóźnienia rozwoju (315.9). Jeżeli u dziecka wystąpiły liczne przypadki tej samej diagnozy, uwzględniano wyłącznie pierwszy przypadek. Oprócz tego, w celu zapewnienia możliwości wykazania związku między ekspozycją a wynikiem, do omawianego badania jako przypadki włączeni zostali jedynie pacjenci, u których zdiagnozowano specyficzne opóźnienia rozwoju po zaszczepieniu wszystkimi badanymi szczepionkami.
Wyznaczono całkowitą liczbę 5.699 przypadków ze zdiagnozowanymi specyficznymi opóźnieniami rozwoju (chłopcy = 3.916, dziewczynki = 1.783; stosunek chłopców do dziewczynek = 2.2:1), urodzonych w latach 1991–2000. Zostali oni poddani ocenie w celu określenia średniego wieku, w którym po raz pierwszy zdiagnozowano u nich specyficzne opóźnienia rozwoju oraz odchylenia standardowego od średniego wieku, w którym postawiono pierwszą diagnozę specyficznych opóźnień rozwoju (2.62 ± 1,58 lat).
Dobór pacjentów w grupie kontrolnej
Aby nie dopuścić do sytuacji, w której w przypadku pacjentów w grupie kontrolnej z niezdiagnozowanymi specyficznymi opóźnieniami rozwoju istniałoby minimalne prawdopodobieństwo, że w późniejszym czasie otrzymaliby taką diagnozę, musieli oni stale uczestniczyć w badaniu od urodzenia do osiągnięcia wieku co najmniej 5,78 lat (średni wiek, w którym postawiono pierwszą diagnozę specyficznych opóźnień rozwoju plus dwukrotne odchylenie standardowe od średniego wieku, w którym postawionoa została pierwsza diagnoza specyficznych opóźnień rozwoju). Zastosowanie tego uzupełniającego kryterium dało całkowitą liczbę 48.528 pacjentów w grupie kontrolnej z niezdiagnozowanymi specyficznymi opóźnieniami rozwoju (chłopcy = 24.612, dziewczynki = 23.915; stosunek chłopców do dziewczynek = 1,03) urodzonych w latach 1991–1995.
Podanie szczepionki przeciwko WZW B
W następnej kolejności zweryfikowano dokumentację dotyczącą szczepień przypadków i pacjentów w grupie kontrolnej w celu określenia dokładnych dat podania szczepionki przeciwko WZW B. Do omawianego badania włączono także przypadki oraz pacjentów w grupie kontrolnej, którzy nie otrzymali żadnej dawki szczepionki przeciwko WZW B.
Ogólnie dla przypadków i pacjentów w grupie kontrolnej wyznaczono ilość 12,5 µg rtęci organicznej na dawkę dla dzieci szczepionych pediatryczną szczepionką przeciwko WZW B lub 0 µg rtęci organicznej na dawkę dla dzieci otrzymujących albo szczepionkę skojarzoną Haemophilus influenzae typu B (Hib)-wirusowe zapalenie wątroby typu B, albo nie otrzymujących żadnej z wyżej wymienionych szczepionek.
Badania statystyczne
We wszystkich badaniach analitycznych zastosowano dokładny test Fishera stanowiący część oprogramowania SAS, przy czym za istotną statystycznie uznano dwustronną wartość P < 0,05. W pierwszej grupie eksperymentalnej poddanej badaniu kliniczno-kontrolnemu (Doświadczenie I), zarówno dla przypadków, jak i pacjentów w grupie kontrolnej, przeanalizowano dane w celu określenia częstotliwości ekspozycji na dawkę 12,5 µg rtęci organicznej z dawki zawierającej tiomersal szczepionki przeciwko WZW B podanej w pierwszym miesiącu życia w porównaniu z częstotliwością dawki 0 µg rtęci organicznej z dawki szczepionki przeciwko WZW B nie zawierającej tiomersalu lub brakiem szczepienia przeciwko WZW B w pierwszym miesiącu życia. W drugiej grupie eksperymentalnej (Doświadczenie II), zarówno dla przypadków, jak i pacjentów w grupie kontrolnej, przeanalizowano dane w celu określenia częstotliwości otrzymania dwóch dawek zawierającej tiomersal szczepionki przeciwko WZW B w pierwszych dwóch miesiącach życia lub dawki całkowitej 25 µg rtęci organicznej w porównaniu z częstotliwością otrzymania 0 µg rtęci organicznej z dwóch dawek niezawierającej tiomersalu szczepionki przeciwko WZW B i/lub brakiem szczepienia przeciwko WZW B w pierwszych dwóch miesiącach życia. W trzeciej grupie eksperymentalnej (Doświadczenie III), zarówno dla przypadków, jak i pacjentów w grupie kontrolnej, przeanalizowano dane w celu określenia częstotliwości otrzymania trzech dawek zawierającej tiomersal szczepionki przeciwko WZW B w pierwszych sześciu miesiącach życia lub dawki całkowitej 37,5 µg rtęci organicznej w porównaniu z częstotliwością otrzymania dawki 0 µg rtęci organicznej w pierwszych sześciu miesiącach życia pochodzącej z dawek niezawierającej tiomersalu szczepionki przeciwko WZW B i/lub brakiem szczepienia przeciwko WZW B. Ponadto, jako że stosunek chłopców do dziewczynek wyniósł 2.2:1, przeprowadzono dodatkowe, odrębne badania, w których przypadki płci męskiej zostały porównane do pacjentów płci męskiej w grupie kontrolnej (Doświadczenia IV-VI), zaś przypadki płci żeńskiej porównano do pacjentek w grupie kontrolnej (Doświadczenia VII-IX). Całkowita hipoteza zerowa dla każdej z tych zbadanych grup eksperymentalnych zakładała, że nie będzie różnicy w częstotliwości ekspozycji na dawki rtęci organicznej z zawierających tiomersal szczepionek przeciwko WZW B między przypadkami a pacjentami w grupie kontrolnej. Na zakończenie wykonano serię doświadczeń służących ocenie wpływu płci przypadków oraz zwiększającej się ekspozycji na dawki rtęci organicznej z zawierających tiomersal szczepionek przeciwko WZW B. Doświadczenie X określało częstotliwość ekspozycji na dawkę 12,5 µg rtęci organicznej z dawki zawierającej tiomersal szczepionki przeciwko WZW B w pierwszym miesiącu życia w porównaniu z częstotliwością dawki 0 µg rtęci organicznej z dawki niezawierającej tiomersalu szczepionki przeciwko WZW B lub brakiem szczepienia przeciw tej chorobie w pierwszym miesiącu życia, przy czym w doświadczeniu tym porównano przypadki płci męskiej i żeńskiej. Doświadczenie XI określało częstotliwość otrzymania dwóch dawek zawierającej tiomersal szczepionki przeciwko WZW B w dwóch pierwszych miesiącach życia lub całkowitej dawki 25 µg rtęci organicznej w porównaniu do częstotliwości otrzymania dawki 0 µg rtęci organicznej z dwóch dawek niezawierającej tiomersalu szczepionki przeciwko WZW B i/lub brakiem szczepienia przeciwko WZW B w pierwszych dwóch miesiącach życia, przy czym w doświadczeniu tym porównano przypadki płci męskiej i żeńskiej. Doświadczenie XII określało częstotliwość otrzymania trzech dawek zawierającej tiomersal szczepionki przeciwko WZW B w pierwszych trzech miesiącach życia lub całkowitej dawkę 37,5 µg rtęci organicznej w porównaniu do częstotliwości otrzymania dawki 0 µg rtęci organicznej z dwóch dawek niezawierającej tiomersalu szczepionki przeciwko WZW B i/lub brakiem szczepienia przeciwko tej chorobie w pierwszych 6 miesiącach życia, przy czym w doświadczeniu porównano przypadki płci męskiej i żeńskiej. Całkowita hipoteza zerowa dla każdej z tych zbadanych grup eksperymentalnych zakładała, że nie będzie różnicy w częstotliwości ekspozycji na dawki rtęci organicznej z zawierających tiomersal szczepionek przeciwko WZW B między przypadkami płci męskiej i żeńskiej.
Tiomersal i autyzm
Wyniki
Tabela 1 przedstawia związek między przypadkami a pacjentami w grupie kontrolnej, którzy otrzymywali coraz większe dawki rtęci organicznej z zawierających tiomersal szczepionek przeciwko WZW B w kilku konkretnych punktach w czasie podczas pierwszych 6 miesięcy życia. Doświadczenie I udokumentowało, że wśród przypadków istniało znacząco większe prawdopodobieństwo (iloraz szans, OR = 1,99, P < 0,00001) niż u pacjentów w grupie kontrolnej przyjęcia 12,5 µg rtęci organicznej z zawierającej tiomersal dawki szczepionki przeciwko WZW B w porównaniu z 0 µg rtęci organicznej z niezawierającej tiomersalu dawki szczepionki przeciwko WZW B lub na skutek niezaszczepienia szczepionką przeciwko WZW B w pierwszym miesiącu życia. Doświadczenie II udokumentowało, że wśród przypadków istniało znacząco większe prawdopodobieństwo (iloraz szans, OR = 1,98, P < 0,00001) niż u pacjentów w grupie kontrolnej przyjęcia 12,5 µg rtęci organicznej z dwóch dawek zawierającej tiomersal szczepionki przeciwko WZW B w porównaniu z 0 µg rtęci organicznej z niezawierających tiomersalu dawek szczepionki przeciwko WZW B i/lub na skutek niezaszczepienia szczepionką przeciwko WZW B w pierwszych dwóch miesiącach życia. I wreszcie w Doświadczeniu III wśród przypadków istniało znacząco większe prawdopodobieństwo (iloraz szans, OR = 3,07, P < 0,00001) niż u pacjentów w grupie kontrolnej przyjęcia 37,5 µg rtęci organicznej z trzech dawek zawierającej tiomersal szczepionki przeciwko WZW B w porównaniu z 0 µg rtęci organicznej z trzech dawek niezawierającej tiomersalu szczepionki przeciwko WZW B i/lub na skutek niezaszczepienia szczepionką przeciwko WZW B w pierwszych 6 miesiącach życia.
Tabela 1
Zestawienie ekspozycji na rtęć organiczną na skutek podania zawierającej tiomersal szczepionki przeciwko WZW B przypadkom ze zdiagnozowanymi specyficznymi opóźnieniami w porównaniu z pacjentami w grupie kontrolnej z bazie danych VSD.
| Grupa poddana badaniu | Liczba przypadków ze zdiagnozowanymi specyficznymi opóźnieniami rozwoju (%) | Liczba pacjentów w grupie kontrolnej z niezdiagnozowanymi specyficznymi opóźnieniami rozwoju (%) | Iloraz szans (przedział ufności 95%) | Wartość P |
| Doświadczenie I
12,5 µg rtęci organicznej w pierwszym miesiącu życia
0 µg rtęci organicznej w pierwszym miesiącu życia |
3,094 (14,60)
18,101 (85,40) |
2,605 (7,89)
30,427 (92,11) |
1,99 (1,89-2,11) |
<0,00001 |
| Doświadczenie II
25 µg rtęci organicznej w pierwszych 2 miesiącach życia
0 µg rtęci organicznej w pierwszych 2 miesiącach życia |
3,095 (14,59)
18,122 (85,41) |
2,561 (7,94)
29,6% (92,06)
|
1,98 (1,87-2,09) |
<0,00001
|
| Doświadczenie III
37,5 µg rtęci organicznej w pierwszych 6 miesiącach życia 0 µg rtęci organicznej w pierwszych 6 miesiącach życia |
663 (16,35)
3,391 (83,65) |
115 (5,98)
1,807 (94,02) |
3,07 (2,50-3,77) |
<0,00001 |
Tabele Tabele 22 i 33 przedstawiają związek między przypadkami a pacjentami w grupie kontrolnej odpowiednio płci męskiej i żeńskiej, którzy otrzymywali coraz większe dawki rtęci organicznej z zawierających tiomersal szczepionek przeciwko WZW B w kilku konkretnych punktach w czasie podczas pierwszych 6 miesięcy życia. Tabela 2 pokazuje, że w Doświadczeniu IV wśród przypadków płci męskiej istniało znacząco większe prawdopodobieństwo (iloraz szans, OR = 2,05, P < 0,00001) niż u pacjentów płci męskiej w grupie kontrolnej przyjęcia 12,5 µg rtęci organicznej z zawierającej tiomersal dawki szczepionki przeciwko WZW B w porównaniu z 0 µg rtęci organicznej z niezawierającej tiomersalu dawki szczepionki przeciwko WZW B lub na skutek niezaszczepienia szczepionką przeciwko tej chorobie w pierwszym miesiącu życia. Doświadczenie V udokumentowało, że wśród przypadków płci męskiej istniało znacząco większe prawdopodobieństwo (iloraz szans, OR = 2,03, P < 0,00001) niż u pacjentów płci męskiej w grupie kontrolnej przyjęcia 25 µg rtęci organicznej z dwóch dawek zawierającej tiomersal szczepionki przeciwko WZW B w porównaniu z 0 µg rtęci organicznej z dwóch dawek niezawierającej tiomersalu szczepionki przeciwko WZW B i/lub na skutek niezaszczepienia szczepionką przeciwko tej chorobie w pierwszych dwóch miesiącach życia. I wreszcie w Doświadczeniu VI wśród przypadków płci męskiej istniało znacząco większe prawdopodobieństwo (iloraz szans, OR = 3,38, P < 0,00001) niż u pacjentów płci męskiej w grupie kontrolnej przyjęcia 37,5 µg rtęci organicznej z trzech dawek zawierającej tiomersal szczepionki przeciwko WZW B w porównaniu z 0 µg rtęci organicznej z trzech dawek niezawierającej tiomersalu szczepionki przeciwko WZW i/lub na skutek niezaszczepienia szczepionką przeciwko tej chorobie w pierwszych sześciu miesiącach życia.
Tabela 2
Zestawienie ekspozycji na rtęć organiczną na skutek podania zawierającej tiomersal szczepionki przeciwko WZW B przypadkom płci męskiej ze zdiagnozowanymi specyficznymi opóźnieniami rozwoju w porównaniu z pacjentami płci męskiej w grupie kontrolnej z bazy danych VSD.
| Grupa poddana badaniu | Liczba przypadków płci męskiej ze zdiagnozowanymi specyficznymi opóźnieniami rozwoju (%) | Liczba pacjentów płci męskiej w grupie kontrolnej z niezdiagnozowanymi specyficznymi opóźnieniami rozwoju (%) | Iloraz szans (przedział ufności 95%) | Wartość P |
| Doświadczenie IV
12,5 µg rtęci organicznej w pierwszym miesiącu życia
0 µg rtęci organicznej w pierwszym miesiącu życia |
2,133 (19,01)
9,085 (80,99) |
1,783 (10,30)
15,527 (89,70) |
2,05 (1,91-2,19)
|
<0,00001 |
| Doświadczenie V
25 µg rtęci organicznej w pierwszych 2 miesiącach życia 0 µg rtęci organicznej w pierwszych 2 miesiącach życia |
2,135 (19,01)
9,095 (80,99) |
1,754 (10,38)
15,141 (89,62) |
2,03 (1,89-2,17) |
<0,00001 |
| Doświadczenie VI
37,5 µg rtęci organicznej w pierwszych 6 miesiącach życia 0 µg rtęci organicznej w pierwszych 6 miesiącach życia |
457 (21,49)
1,670 (78,51) |
74 (7,48)
915 (92,52) |
3,38 (2,61-4,38) |
<0,00001 |
Tabela 3
Zestawienie ekspozycji na rtęć organiczną na skutek podania zawierającej tiomersal szczepionki przeciwko WZW B przypadkom płci żeńskiej ze zdiagnozowanymi specyficznymi opóźnieniami rozwoju w porównaniu z pacjentkami w grupie kontrolnej z bazy danych VSD.
| Grupa poddana badaniu | Liczba przypadków płci żeńskiej ze zdiagnozowanymi specyficznymi opóźnieniami rozwoju (%) | Liczba pacjentek w grupie kontrolnej z niezdiagnozowanymi specyficznymi opóźnieniami rozwoju (%) | Iloraz szans (przedział ufności 95%) | Wartość P |
| Doświadczenie VII
12,5 µg rtęci organicznej w pierwszym miesiącu życia
0 µg rtęci organicznej w pierwszym miesiącu życia |
961 (9,63)
9,015 (90,37) |
822 (5,23)
14,900 (94,77) |
1,93 (1,75-2,13)
|
<0,00001 |
| Doświadczenie VIII
25 µg rtęci organicznej w pierwszych 2 miesiącach życia
0 µg rtęci organicznej w pierwszych 2 miesiącach życia |
960 (9,61)
9,026 (90,39)
|
807 (5,25)
14,555 (94,75) |
1,92 (1,74-2,11) |
<0,00001 |
| Doświadczenie IX
37,5 µg rtęci organicznej w pierwszych 6 miesiącach życia 0 µg rtęci organicznej w pierwszych 6 miesiącach życia |
206 (10,69)
1,721 (89,31) |
41 (4,39)
892 (95,61) |
2,60 (1,84-3,68) |
<0,00001 |
Tabela 3 pokazuje, że w Doświadczeniu VII wśród przypadków płci żeńskiej istniało znacząco większe prawdopodobieństwo (iloraz szans, OR = 1,93, P < 0,00001) niż wśród pacjentek w grupie kontrolnej, iż otrzymały one 12,5 µg rtęci organicznej z zawierającej tiomersal dawki szczepionki przeciwko WZW B w porównaniu z 0 µg rtęci organicznej z niezawierającej tiomersalu dawki szczepionki przeciwko WZW B lub na skutek niezaszczepienia szczepionką przeciwko tej chorobie w pierwszym miesiącu życia. Doświadczenie VIII udokumentowało, że wśród przypadków płci żeńskiej istniało znacząco większe prawdopodobieństwo (iloraz szans, OR = 1,92, P < 0,00001) niż wśród pacjentek w grupie kontrolnej, iż otrzymały one 25 µg rtęci organicznej z dwóch dawek zawierającej tiomersal szczepionki przeciwko WZW B w porównaniu z 0 µg rtęci organicznej z dwóch dawek niezawierającej tiomersalu szczepionki przeciwko WZW B i/lub na skutek niezaszczepienia szczepionką przeciwko tej chorobie w pierwszych dwóch miesiącach życia. I wreszcie w Doświadczeniu IX wśród przypadków płci żeńskiej istniało znacząco większe prawdopodobieństwo (iloraz szans, OR = 2,60, P < 0,00001) niż wśród pacjentek w grupie kontrolnej, iż otrzymały one 37,5 µg rtęci organicznej z trzech dawek zawierającej tiomersal szczepionki przeciwko WZW B w porównaniu z 0 µg rtęci organicznej z trzech dawek niezawierającej tiomersalu szczepionki przeciwko WZW B i/lub na skutek niezaszczepienia szczepionką przeciwko WZW B w pierwszych 6 miesiącach życia.
Tabela 4 pokazuje relatywną zależność między zwiększającymi się dawkami rtęci organicznej z dawek zawierającej tiomersal szczepionki przeciwko WZW B w kilku konkretnych punktach w czasie w ciągu pierwszych 6 miesięcy życia między narażonymi i nienarażonymi przypadkami płci męskiej w porównaniu z narażonymi i nienarażonymi przypadkami płci żeńskiej (względny stosunek chłopców do dziewczynek). Ogólnie nie wystąpił statystycznie istotny wzrost stosunku chłopców do dziewczynek na skutek rosnących dawek rtęci organicznej z zawierającej tiomersal szczepionki przeciwko WZW B między narażonymi i nienarażonymi przypadkami płci męskiej w porównaniu z narażonymi i nienarażonymi przypadkami płci żeńskiej. Wystąpił jednak nieistotny trend w stronę stosunku narażonych przypadków płci męskiej do przypadków nienarażonych otrzymujących 37,5 µg rtęci organicznej z trzech dawek zawierającej tiomersal szczepionki przeciwko WZW B w porównaniu z 0 µg rtęci organicznej z trzech dawek niezawierającej tiomersalu szczepionki przeciwko WZW B i/lub niezaszczepieniem szczepionką przeciwko tej chorobie w ciągu pierwszych sześciu miesięcy życia w porównaniu ze stosunkiem narażonych do nienarażonych przypadków płci żeńskiej (OR = 1,23, P = 0,33).
Tabela 4
Zestawienie ekspozycji na rtęć organiczną na skutek podania zawierającej tiomersal szczepionki przeciwko WZW B przypadkom płci męskiej w porównaniu z przypadkami płci żeńskiej z bazy danych VSD.
| Grupa poddana badaniu | Liczba przypadków płci męskiej ze zdiagnozowanymi specyficznymi opóźnieniami rozwoju (%) | Liczba przypadków płci żeńskiej ze zdiagnozowanymi specyficznymi opóźnienieniami rozwoju (%) | Relatywny stosunek chłopców do dziewczynek (przedział ufności 95%) | Wartość P |
| Doświadczenie X
12,5 µg rtęci organicznej w pierwszym miesiącu życia 0 µg rtęci organicznej w pierwszym miesiącu życia |
2,133 (54,47)
1,783 (45,53) |
961 (53,90)
822 (46,10) |
1,02 (0,91-1,14)
|
0,69 |
| Doświadczenie XI
25 µg rtęci organicznej w pierwszych 2 miesiącach życia 0 µg rtęci organicznej w pierwszych 2 miesiącach życia |
2,135 (54,90)
1,754 (45,10) |
960 (54,33)
807 (45,67) |
1,02 (0,91-1,14) |
0,71 |
| Doświadczenie XII
37,5 µg rtęci organicznej w pierwszych 6 miesiącach życia 0 µg rtęci organicznej w pierwszych 6 miesiącach życia |
457 (86,06)
74 (13,94)
|
206 (83,40)
41 (16,60)
|
1,23 (0,79-1,89) |
0,33 |
Omówienie
Naukowcy z amerykańskich CDC (ang. Centers for Disease Control and Prevention, pl. Centra Kontroli i Prewencji Chorób) i Agencji Żywności i Leków (FDA, ang. Food and Drug Administration) nieustająco utrzymują, że produkty takie jak szczepionki, które przeznaczone są dla zdrowych ludzi, muszą spełniać najwyższe standardy bezpieczeństwa.[15,16,17] Jednak analiza zagrożeń związanych ze szczepionkami jest bardziej złożona niż analiza dotycząca produktów leczniczych, ponieważ kontakt z wieloma szczepionkami jest w zasadzie powszechny, gwarantując losowe wystąpienie wielu niepożądanych skutków w czasowej koincydencji ze szczepieniami. W rezultacie naukowcy ci opisali w jaki sposób wykorzystywać VSD, konsorcjum HMOs, do bardziej rygorystycznej oceny zagrożeń związanych ze szczepionkami (weryfikacja hipotezy). Omawiane badanie służące weryfikacji hipotezy oceniało potencjalny związek między ekspozycją na rtęć organiczną pochodzącą ze szczepionek wieku dziecięcego zawierających tiomersal a specyficznymi opóźnieniami rozwoju z wykorzystaniem dokładnego testu statystycznego Fishera.
Wytyczne Dotyczące Przedklinicznych Badań Farmakologicznych i Toksykologicznych Szczepionek – EMA
Czy na pewno szczepionki to najlepiej przebadane produkty firm farmaceutycznych? Sprawdźmy.
Konkretne metody zastosowane w omawianym badaniu do oceny możliwej zależności między ekspozycją na rtęć organiczną pochodzącą z zawierających tiomersal szczepionek wieku dziecięcego a ryzykiem specyficznych opóźnień rozwoju pozwoliły na uwzględnienie zaleceń dotyczących czasu podania szczepionki, przy czym zalecenia te znacznie się różniły. W szczególności ocenie poddano różnice między dawkami skumulowanymi rtęci podanymi w konkretnych odstępach czasu w wieku niemowlęcym na podstawie zaleceń o szerokim zasięgu odnośnie do rutynowych szczepień szczepionką przeciwko WZW B. W 1991 roku Amerykański Komitet Doradczy ds. Szczepień Ochronnych (ang. Advisory Committee on Immunization Practices, ACIP) zalecił następujące dawki szczepionki przeciwko WZW B dla niemowląt: Pierwsza dawka między narodzinami a 2 miesiącem życia, druga dawka w wieku 1-4 miesięcy i trzecia dawka w wieku 6-18 miesięcy.[18] Istotne jest, że ogólnie rzecz biorąc widać wyraźnie, iż różnice w ekspozycji na rtęć organiczną zaobserwowane we wszystkich doświadczeniach w ramach omawianego badania nie wystąpiły na skutek zaszczepienia niewielkiej grupy dzieci w nietypowy sposób. Doświadczenia te oceniały raczej różne poziomy ekspozycji na rtęć organiczną wynikające z różniących się od siebie okien zalecanych w związku z podawaniem szczepionki przeciwko WZW B w pierwszym roku życia.
Wyniki omawianego badania wydają się także umożliwiać dokonanie ważnych, biologicznych, mechanicystycznych spostrzeżeń dotyczących zależności między czasem podania szczepionki a skumulowanymi skutkami ekspozycji na rtęć organiczną pochodzącą ze szczepionek zawierających tiomersal i ryzykiem diagnozy specyficznych opóźnień rozwoju. Przykładowo dla uczestników badania ze zdiagnozowanymi specyficznymi opóźnieniami rozwoju nie istniało większe prawdopodobieństwo, że w późniejszym czasie będą narażeni na rtęć organiczną na skutek zaszczepienia drugą lub trzecią zawierającą tiomersal szczepionką przeciwko WZW B w sposób zależny od dawki w porównaniu z pacjentami w grupie kontrolnej. Natomiast iloraz szans postawienia diagnozy „specyficznych opóźnień rozwoju” po zaszczepieniu dwiema dawkami zawierającej tiomersal szczepionki przeciwko WZW B (25 µg rtęci organicznej) przed ukończeniem drugiego miesiąca życia był zbliżony do ilorazu szans występującego przy podaniu jednej dawki zawierającej tiomersal szczepionki przeciwko WZW B (12,5 µg rtęci organicznej) przed ukończeniem pierwszego miesiąca życia. OR postawienia diagnozy niespecyficznych opóźnień rozwoju po zaszczepieniu trzema dawkami zawierającej tiomersal szczepionki przeciwko WZW B (37,5 µg rtęci organicznej) zwiększył się u dzieci, które otrzymały jedną lub dwie dawki zawierającej tiomersal szczepionki przeciwko WZW B, ale zaobserwowany wzrost był znacząco niższy niż spodziewany z kumulatywnej perspektywy, bez uwzględnienia zmiennej czasu zaszczepienia. Nasze spostrzeżenie, że czas ekspozycji zmienia ilorazy szans jest zgodne z wcześniejszymi obserwacjami dotyczącymi innych przypadków zatrucia rtęcią, w których wczesne narażenie wiąże się z bardziej istotnymi niepożądanymi skutkami (czyli podatność na zatrucie rtęci: Płody˃niemowlęta˃dzieci˃dorośli).[19]
Co ważne, wyniki wielu najnowszych badań wspierają możliwą pod względem biologicznym rolę ekspozycji na rtęć organiczną pochodzącą ze szczepionek zawierających tiomersal w patogenezie specyficznych opóźnień rozwoju.[20] Badacze przeanalizowali dystrybucję rtęci organicznej w następstwie podania tiomersalu zwierzętom i niemowlętom. Przykładowo podając tiomersal oseskom małp na wzór amerykańskiego harmonogramu szczepień we wczesnym dzieciństwie obowiązującego w latach 90-tych, naukowcy odkryli, że znaczne ilości Hg były obecne w mózgu (około 40-50 części na miliard), przy czym znaczna część tej Hg była obecna jako rtęć nieorganiczna (około 16 części na miliard) i zaobserwowano też, że poziom tej rtęci nieorganicznej nie obniżył się znacząco po 120 dniach od podania ostatniej dawki tiomersalu.[21] Inni naukowcy dokonali dalszych ocen specjacji Hg obecnej w tkankach szczurów w następstwie podania tiomersalu.[22] Co ciekawe, naukowcy ci zaobserwowali, że podanie tiomersalu skutkowało pojawieniem się znacznych ilości Hg w mózgu, przy czym 63% w postaci rtęci nieorganicznej, 13,5% w postaci etylortęci i, tutaj rzecz niespodziewana, w postaci 23,7% metylortęci.
Niepokój budzą wyniki niektórych badań wskazujące, że podawanie niemowlętom szczepionek zawierających tiomersal znacząco podwyższa poziom Hg we krwi szczepionego dziecka (całkowity poziom Hg we krwi niektórych niemowląt przekraczał granicę bezpieczeństwa przyjętą przez Amerykańską Agencję Ochrony Środowiska -EPA)[23,24,25], jak również w istotnym stopniu zwiększa poziom etylortęci we krwi niemowlęcia (całkowity poziom Hg we włosach niektórych niemowląt przekraczał granicę bezpieczeństwa przyjętą przez Amerykańską Agencję Ochrony Środowiska).[26] I na koniec, w niedawno przeprowadzonym, dodatkowym badaniu dystrybucji gatunków rtęci w organizmie naukowcy wykazali, że etylortęć jest aktywnie przenoszona przez błony komórkowe neuronów w takim samym stopniu jak metylortęć, na drodze transportu z udziałem nośnika przemieszczającego neutralne aminokwasy typu L. [27]
Kiedy rtęć dostanie się do mózgu, wywołuje rozliczne skutki.[28] Jednym z najważniejszych jest degeneracja aksonów, zwłaszcza aksonów o dużym promieniu przekroju, które są zwykle aksonami dalekiego zasięgu łączącymi odległe części mózgu. Kiedy aksony dalekiego zasięgu ulegają zniszczeniu, nie regenerują się, aby przywrócić połączenie planowane przed uszkodzeniem po części dlatego, że im mniejsza odległość między miejscem regeneracji a jego dystalnym celem, tym większe prawdopodobieństwo, że odnowa nerwu zakończy się pomyślnie. Po narodzinach, uszkodzone dojrzałe aksony komórek nerwowych regenerują się jedynie na bardzo małe odległości w ośrodkowym układzie nerwowym (ang. central nervous system, CNS). Co więcej, połączenia dalekiego zasięgu są zależne od kluczowych okresów rozwojowych przed narodzinami i wkrótce po przyjściu na świat, w których połączenia tworzone przez aksony dalekiego zasięgu prowadzone są do punktów docelowych w korze mózgowej przez mechanizmy sygnalizacji komórkowej.
Co istotne, naukowcy byli w stanie zmierzyć połączenia dalekiego zasięgu transportujące sygnały między odległymi obszarami mózgu i wykazali dlaczego proces tworzenia tych połączeń jest ważny dla wielu procesów zachodzących w mózgu takich jak czytanie, słyszenie, koordynacja oraz mowa/język.[29,30,31,32,33,33] Nieprawidłowości dróg nerwowych o dalekim zasięgu związane z tymi procesami mogą skutkować specyficznymi opóźnieniami rozwoju. Dla przykładu naukowcy wykazali, że schemat wzrostu połączeń dalekiego zasięgu w mózgu zapowiada w jaki sposób rozwinie się u dziecka umiejętność czytania.[33] Badacze ci wskazali, że umiejętność czytania i pisania wymaga integracji aktywności w obszarach mózgu odpowiedzialnych za widzenie, słyszenie i język, a ponieważ obszary te rozmieszczone są w całym mózgu, konieczna jest większa liczba sieci neuronowych o dalekim zasięgu, charakteryzujących się efektywnym wykorzystaniem prędkości, aby ogólna komunikacja między tymi obszarami mogła być skuteczna. Inni naukowcy stwierdzili brak integralności w aksonach o dalekim zasięgu w pęczku łukowatym dzieci z opóźnionym rozwojem mowy.[34] Są oni zdania, że jakiekolwiek anomalia w neuronach na początku lub zakończeniu drogi nerwowej mogą prowadzić do nieprawidłowego rozwoju tej drogi.
Film Odblokowani – Ułatwiona Komunikacja
Badania wykazały, że rtęć [Hg] powoduje nie tylko degenerację aksonów, w szczególności tych o dalekim zasięgu, które mają kluczowe znaczenie i których regeneracja wymagałaby przewodnictwa aksonalnego, ale także prowadzi do zahamowania przewodnictwa aksonalnego.[35] Ponadto badania dowiodły, że Hg zaburza proces dojrzewania neuronów,[35] co również obserwuje się u dzieci z opóźnionym rozwojem mowy/języka.[34]
W badaniach przeanalizowano także czy ekspozycja na rtęć organiczną pochodzącą ze szczepionek zawierających tiomersal powoduje patologię specyficznych opóźnień rozwoju lub objawy kliniczne w systemach modeli zwierzęcych. Badania te wykazały znaczące objawy patologiczne lub kliniczne u myszy,[36] szczurów,[37,38,39] chomików,[40] i małp[41], które pokrywają się z objawami charakterystycznymi dla specyficznych opóźnień rozwoju w następstwie ekspozycji na szczepionki zawierające tiomersal podawane na wzór programu rutynowych szczepień wieku dziecięcego obowiązującego w latach 90-tych w Stanach Zjednoczonych.
Wyniki omawianego badania wspiera również znaczna liczba opublikowanych badań epidemiologicznych, które wykazały istnienie znaczącego związku między ekspozycją na rtęć organiczną pochodzącą ze szczepionek zawierających tiomersal a specyficznymi opóźnieniami rozwoju z wykorzystaniem kilku metod epidemiologicznych w różnych bazach danych. Przykładowo w bazie VSD, naukowcy, stosując ekologiczny model badania, ocenili zależność między występowaniem kilku różnych rodzajów specyficznych opóźnień rozwoju w kohorcie urodzeniowej a ekspozycją na rtęć organiczną pochodzącą z zawierających tiomersal szczepionek wieku dziecięcego w kohorcie urodzeniowej.[42] Zgodnie z wynikami uzyskanymi w omawianym badaniu, naukowcy zaobserwowali, że u niemowląt otrzymujących dodatkowo 100 µg rtęci organicznej z zawierających tiomersal szczepionek wieku dziecięcego od urodzenia do osiągnięcia wieku 7 miesięcy, wystąpił znacznie podwyższony współczynnik częstości występowania o wartości 2,27 dla zdiagnozowanych zaburzeń rozwoju/zaburzeń zdolności uczenia się, natomiast u niemowląt otrzymujących dodatkowo 100 µg rtęci organicznej z zawierających tiomersal szczepionek wieku dziecięcego od urodzenia do osiągnięcia 13 miesięcy współczynnik ten był również istotnie zwiększony i wyniósł 2,91 dla zdiagnozowanych zaburzeń rozwoju/zaburzeń zdolności uczenia się. Inni badacze, wykorzystując model badania kohortowego, ocenili związek między zwiększającą się ekspozycją na rtęć organiczną z zawierających tiomersal szczepionek pediatrycznych podawanych w wieku 1, 2, 3 i 6 miesięcy a ewentualnym ryzykiem diagnozy specyficznych zaburzeń rozwoju.[43] Zaobserwowali, że rosnąca, łączna ekspozycja na rtęć organiczną ze szczepionek zawierających tiomersal wiąże się ze zwiększonym ryzykiem diagnozy niespecyficznych opóźnień rozwoju, a także opóźnienia rozwoju języka i mowy.
Jako inny przykład może posłużyć badanie, w którym naukowcy ocenili zależność między zaszczepieniem trzema dawkami zawierającej tiomersal szczepionki przeciwko WZW B przed rokiem 2000 a późniejszym ryzykiem zdiagnozowania zaburzeń rozwoju u dziecka w wieku 1-9 lat, na podstawie ogólnokrajowej ankiety dotyczącej stanu zdrowia ludności w USA (ang. National Health Interview Survey, NHIS) w zbiorze danych z lat 1999-2000.[44] Naukowcy poinformowali, że u chłopców ze zdiagnozowanymi zaburzeniami rozwoju w porównaniu z grupą kontrolną wystąpił 9-krotnie wyższy iloraz szans zaszczepienia trzema dawkami zawierającej tiomersal szczepionki przeciwko WZW B w porównaniu do tych, którzy w ogóle nie otrzymali zawierającej tiomersal szczepionki przeciwko tej chorobie.
Wcześniej podano do wiadomości wyniki meta-analizy wykorzystującej modelowanie statystyczne do oceny związku między ekspozycją na dodatkowe dawki Hg pochodzącej z zawierających tiomersal szczepionek wieku dziecięcego a zaburzeniami neurorozwojowymi zgłoszonymi w raportach zdarzeń niepożądanych w systemie VAERS (ang. Vaccine Adverse Event Reporting System).[45] Badanie to wykazało statystycznie istotne, podwyższone ryzyko zgłoszenia do systemu VAERS zaburzeń mowy, upośledzenia umysłowego, zaburzeń osobowości, zaburzeń myślenia i ataksji w następstwie otrzymania dodatkowych dawek rtęci organicznej ze szczepionek zawierających tiomersal.
W USA rejestruje się mniej niż 1% NOPów – Harvard Pilgrim Health Care
W kolejnym badaniu, które może posłużyć jako przykład, naukowcy ocenili narażenie na rtęć organiczną ze szczepionek zawierających tiomersal a rozwojem dziecka w pierwszych 3 latach życia w próbie badania obejmującej 196 niemowląt urodzonych między styczniem 2001 roku a marcem 2003 roku.[46] Badacze zaobserwowali znaczący ogólny deficyt w skali rozwoju psychomotorycznego spowodowany ekspozycją noworodka na rtęć organiczną ze szczepionki zawierającej tiomersal zmierzoną w ciągu 3-letniego okresu obserwacyjnego. W podobny sposób naukowcy ocenili rozwój układu nerwowego według skali rozwoju Gesella w związku z ekspozycją noworodków na rtęć [Hg] w jednym ośrodku miejskim i dwóch wsiach.[47] Przy zastosowaniu analizy regresji logistycznej zaobserwowali, że narażenie na rtęć organiczną ze szczepionek zawierających tiomersal było negatywnie skojarzone w skali rozwoju Gesella.
Tiomersal i autyzm – niejednoznaczne wyniki badań
Wyniki omawianego badania różnią się od wyników kilku innych analiz, w których nie ustalono stałej zależności między specyficznymi opóźnieniami rozwoju a ekspozycją na rtęć organiczną pochodzącą z zawierających tiomersal szczepionek wieku dziecięcego. Przyczyną może być po części fakt, że w innych badaniach uwzględniono kohorty różniące się znacznie programami szczepień, jak również zastosowano różne kryteria diagnostyczne dotyczące wyników.
Różnica mogła wystąpić także dlatego, że w innych badaniach zastosowano odmienne metody epidemiologiczne, zwłaszcza w odniesieniu do kwestii odpowiednio długiego okresu obserwacyjnego dzieci w badanych kohortach. Metoda przyjęta do oceny w jaki sposób ustala się okres obserwacyjny dla poszczególnych osób stanowi kluczową kwestię we wszystkich badaniach dotyczących związku między ekspozycją a ryzykiem późniejszej diagnozy specyficznych zaburzeń rozwoju, zwłaszcza w przypadkach, kiedy ekspozycja dla wszystkich uczestników badania jest taka sama. Decyduje o tym fakt, że ryzyko diagnozy specyficznych opóźnień rozwoju nie jest jednakowe przez całe życie danej osoby. Jak zaobserwowano w omawianym badaniu, początkowy średni wiek postawienia diagnozy specyficznych zaburzeń rozwoju wyniósł 2,62 lata, zaś odchylenie standardowe od średniego wieku postawienia takiej diagnozy wyniosło 1,58 lat. Z tego powodu prawdopodobne jest, że zastosowanie jakiejkolwiek metody obserwacji po badaniu, która nie uwzględnia czasu spóźnienia między narodzinami a wiekiem, w jakim u osoby badanej po raz pierwszy zdiagnozowano specyficzne zaburzenia rozwoju, uniemożliwiło zaobserwowanie rzeczywistego związku pomiędzy ekspozycją na Hg pochodzącą ze szczepionek a późniejszym ryzykiem diagnozy specyficznych zaburzeń rozwoju.
Kwestia okresu obserwacyjnego może mieć szczególne znaczenie w przypadku badań wykorzystujących modele hazardu, które zakładają, że ryzyko diagnozy specyficznych zaburzeń rozwoju jest równe z każdym dodatkowym dniem okresu obserwacyjnego.[48,49] W jednym z przykładów[49] zastosowano ilorazy hazardu Coxa do oceny okresów obserwacyjnych w kohorcie badanej przez naukowców w bazie danych lekarzy ogólnych (ang. General Practitioner Research Database, GPRD). Naukowcy ci zaobserwowali, że zwiększona ekspozycja na rtęć organiczną ze szczepionek zawierających tiomersal wiązała się ze znacznie obniżonym ryzykiem diagnozy ogólnych zaburzeń rozwoju i niespecyficznych opóźnień rozwoju (chociaż wystąpiło znacząco wyższe ryzyko zdiagnozowania tików).
Jeszcze inni naukowcy dostrzegli negatywną zależność między rtęcią organiczną ze szczepionek zawierających tiomersal a specyficznymi opóźnieniami rozwoju, jednak nie byli w stanie wyciągnąć wniosków w oparciu o uzyskane wyniki. Dla przykładu, naukowcy zbadali umiejętności neuropsychologiczne 10 lat po zaszczepieniu w wieku niemowlęcym szczepionkami zawierającymi tiomersal.[50] Poddali badaniu dzieci, które były zarejestrowane do badania oceniającego skuteczność szczepionek przeciwko krztuścowi w latach 1992-1993 i zostały losowo przypisane w pierwszym roku życia do jednej zaszczepionej grupy, która otrzymała dawkę skumulowaną 62,5 µg rtęci organicznej ze szczepionek zawierających tiomersal lub do grupy drugiej, która otrzymała dawkę skumulowaną 137,5 µg rtęci organicznej ze szczepionek z zawartością tiomersalu. Dziesięć lat po zaszczepieniu w wieku niemowlęcym dzieci poddano w godzinach szkolnych jedenastu testom neuropsychologicznym dla 24 parametrów. Zwiększona ekspozycja na rtęć organiczną ze szczepionek zawierających tiomersal wywarła znacząco negatywny wpływ na 2 spośród 24 parametrów neuropsychologicznych, które zostały poddane ocenie. Naukowcy doszli do wniosku, że wyniki mogły być przypadkowe, a istotność kliniczna zaobserwowanych wyników pozostaje kwestią otwartą.
Trzy rzekome badania porównujące „szczepionych z nieszczepionymi” obalone
W podobny sposób naukowcy przeprowadzili badanie kohortowe z wykorzystaniem bazy danych VSD, aby ocenić związek między ekspozycją na rtęć organiczną pochodzącą ze szczepionek zawierających tiomersal a diagnozą zaburzeń neurorozwojowych.[48] Pomimo włączenia dzieci zbyt małych, aby można było w ich przypadku postawić diagnozę specyficznych zaburzeń rozwoju, naukowcy zaobserwowali znacząco zwiększone ryzyko względne wystąpienia tików i opóźnienia rozwoju języka w miarę zwiększania dawek rtęci organicznej ze szczepionek zawierających tiomersal. Jednakże według naukowców wyniki te nie były wystarczająco spójne, aby sformułować jednoznaczne stwierdzenie dotyczące potencjalnych niepożądanych skutków ekspozycji na rtęć organiczną pochodzącą ze szczepionek zawierających tiomersal. Patrząc na badanie w krytycznym świetle, było ono istotnie ograniczone w swojej mocy statystycznej wykrycia zależności między ekspozycją na rtęć organiczną ze szczepionek zawierających tiomersal a przypadkami diagnozy specyficznych opóźnień rozwoju, ponieważ zbadano tylko niektóre kategorie subdiagnostyczne zdiagnozowanych specyficznych opóźnień rozwoju (to jest nie dokonano oceny całej kategorii specyficznych opóźnień rozwoju).
Mocne strony/Ograniczenia
Mocną stroną omawianego doświadczenia było zbadanie kohorty dzieci z bazy danych VSD. Obserwacje w VSD zostały dokonane w oparciu o retrospektywną ocenę prospektywnie zebranej dokumentacji medycznej pacjentów zarejestrowanych w rozmaitych prywatnych organizacjach ochrony zdrowia. Wszystkie przypadki objęte omawianym badaniem musiały być zarejestrowane od urodzenia, przy czym wymagano, aby pozostawały stale zarejestrowane aż do postawienia diagnozy medycznej jednego ze specyficznych opóźnień rozwoju poddanych badaniu, a dodatkowo pacjenci w grupie kontrolnej musieli być zarejestrowani od urodzenia przez wystarczająco długi czas, aby zagwarantować, że istnieje bardzo niewielka szansa, iż w uzupełniającym okresie obserwacyjnym u któregokolwiek pacjenta w grupie kontrolnej zostaną zdiagnozowane specyficzne opóźnienia rozwoju. W rezultacie wszelkie czynniki związane z zarejestrowaniem (dostosowanie do potencjalnych zmiennych między przypadkami a pacjentami w grupie kontrolnej nie było konieczne, ponieważ osoby w grupie kontrolnej były zarejestrowane od urodzenia) lub poszukiwaniem pomocy medycznej (dostosowanie do potencjalnej dostępności opieki medycznej było stałe wśród przypadków i pacjentów w grupie kontrolnej) były zminimalizowane. Oprócz tego zbadano konkretnie przypadki ze zdiagnozowanymi specyficznymi opóźnieniami rozwoju, by zagwarantować, że jedynie pacjenci ze zdiagnozowanymi specyficznymi opóźnieniami rozwoju wskutek zaszczepienia zostali uwzględnieni w omawianym badaniu.
W odniesieniu do przypadków ze zdiagnozowanymi specyficznymi opóźnieniami rozwoju możliwe było dokonanie matematycznego oszacowania odchylenia średniego i standardowego od wieku postawienia pierwszej diagnozy specyficznych opóźnień rozwoju w bazie VSD. Na podstawie tej informacji możliwe było oszacowanie liczby dodatkowych potencjalnych błędnych diagnoz. Aby zapewnić odpowiednią ilość danych do naszego badania, a jednocześnie zminimalizować ryzyko późniejszej diagnozy specyficznych opóźnień rozwoju, a priori, pacjenci w grupie kontrolnej musieli być stale zarejestrowani w bazie VSD od urodzenia do wieku przynajmniej 5,78 lat (średni wiek pierwszej diagnozy specyficznych opóźnień rozwoju plus 2 razy odchylenie standardowe od średniego wieku pierwszej diagnozy specyficznych opóźnień rozwoju). W oparciu o dane dotyczące wieku postawienia pierwszej diagnozy badanych specyficznych opóźnień rozwoju, był to wystarczająco długi czas, by zagwarantować, że – uwzględniając późniejszy okres obserwacyjny – w przypadku pacjentów w grupie kontrolnej z niezdiagnozowanymi specyficznymi opóźnieniami rozwoju nie zostanie w późniejszym czasie postawiona diagnoza analizowanych specyficznych opóźnień rozwoju w bazie VSD (pod względem matematycznym istnieje <2,5% prawdopodobieństwo, że u tych pacjentów zostaną zdiagnozowane specyficzne zaburzenia rozwoju przy uzupełniającym okresie obserwacyjnym po ukończeniu przez nich wieku 5,78 lat).
Interesujące, że skracając okres obserwacyjny i tym samym wprowadzając większą niepewność co do prawidłowości statusu diagnostycznego badanych dzieci, możliwe było złagodzenie zaobserwowanych negatywnych skutków związanych z ekspozycją na rtęć organiczną z zawierających tiomersal szczepionek przeciwko wirusowemu zapaleniu wątroby typu B, lecz mimo to zaobserwowany wpływ był tak silny, że w każdej analizie i tak odkryto istotne zależności. Przykładowo, wymóg, by pacjenci w grupie kontrolnej byli wpisani do bazy VSD nieprzerwanie od urodzenia do osiągnięcia wieku co najmniej 4,2 lata (średni wiek postawienia pierwszej diagnozy specyficznych opóźnień rozwoju plus odchylenie standardowe od średniego wieku pierwszej diagnozy specyficznych opóźnień rozwoju) sprawił, że nadal istniało znacząco większe prawdopodobieństwo, iż przypadki (OR = 2,36, P < 0,00001) w porównaniu z pacjentami w grupie kontrolnej otrzymały 37,5 µg rtęci organicznej pochodzącej z trzech dawek zawierającej tiomersal szczepionki przeciwko WZW B w porównaniu do 0 µg rtęci organicznej z niezawierającej tiomersalu szczepionki przeciwko WZW B i/lub niezaszczepieniem przeciwko tej chorobie w pierwszych 6 miesiącach życia. Analogicznie, dalsze skrócenie okresu obserwacyjnego w taki sposób, że pacjenci w grupie kontrolnej musieli być nieprzerwanie wpisani do bazy VSD od urodzenia do osiągnięcia wieku 2,62 lata (średni wiek postawienia pierwszej diagnozy specyficznych opóźnień rozwoju) spowodowało, że ponownie mamy do czynienia ze znacząco większym prawdopodobieństwem, iż przypadki (OR = 2,29, P < 0,00001) w porównaniu z pacjentami w grupie kontrolnej otrzymały 3,75 µg rtęci organicznej pochodzącej z trzech dawek zawierającej tiomersal szczepionki przeciwko WZW B w porównaniu do 0 µg rtęci organicznej z trzech dawek niezawierającej tiomersalu szczepionki przeciwko WZW B i/lub niezaszczepieniem przeciwko tej chorobie w pierwszych 6 miesiącach życia.
Kolejną mocną stroną jest, że dane z bazy VSD zostały zebrane niezależnie od metodyki zastosowanej w omawianym badaniu.
Poddane analizie zapisy danych z bazy VSD zostały zebrane w ramach rutynowej opieki zdrowotnej, jaką poszczególne dzieci uzyskały przez swoją przynależność do odpowiednich organizacji ochrony zdrowia i z tego powodu personel medyczny w żadnym wypadku nie brał pod uwagę potencjalnego związku między ekspozycją na szczepionki a ewentualnymi wynikami zdrowotnymi.
Jeszcze inną mocną stroną omawianego badania był fakt, że rozpatrywano w nim wpływ płci na zależność między ekspozycją na rtęć organiczną pochodzącą z zawierających tiomersal szczepionek przeciwko WZW B a diagnozą specyficznych opóźnień rozwoju. Jak pokazano w tabelach 2 i 3, nawet gdy dane w bazie VSD przeanalizowano w oddzielnych badaniach dotyczących płci (męskiej lub żeńskiej), nadal istniało znacząco większe prawdopodobieństwo, że przypadki ze zdiagnozowanymi specyficznymi opóźnieniami rozwoju w porównaniu z pacjentami w grupie kontrolnej otrzymały większą ilość rtęci organicznej pochodzącej z zawierających tiomersal szczepionek przeciwko WZW B podanych w określonych odstępach czasu w pierwszych 6 miesiącach życia. W omawianym badaniu oceniono także ekspozycję na dawki zawierającej tiomersal szczepionki przeciw WZW B podane w określonych odstępach czasu w pierwszych 6 miesiącach życia wśród wskaźników zaszczepionych i niezaszczepionych przypadków płci męskiej w porównaniu ze wskaźnikami przypadków płci żeńskiej dla każdego poziomu ekspozycji. Dla tych wyników ogólnie nie wystąpiły istotnie podwyższone wskaźniki względne chłopców w porównaniu do dziewczynek w przypadku zwiększonej ekspozycji na rtęć organiczną pochodzącą z dawek zawierającej tiomersal szczepionki przeciwko WZW B wśród przypadków płci męskiej w porównaniu z przypadkami płci żeńskiej, wystąpiła jednak nieistotna tendencja w kierunku wskaźnika zaszczepionych wobec niezaszczepionych przypadków płci męskiej, gdy zaszczepieni chłopcy otrzymali 37,5 µg rtęci organicznej z trzech dawek zawierającej tiomersal szczepionki przeciwko WZW B w porównaniu z 0 µg rtęci organicznej z trzech dawek niezawierającej tiomersalu szczepionki przeciwko WZW B i/lub niezaszczepieniem przeciwko tej chorobie w pierwszych 6 miesiącach życia w porównaniu z tym samym wskaźnikiem zaszczepionych wobec niezaszczepionych przypadków płci żeńskiej. Należy przeprowadzić dalsze badania z uwzględnieniem zróżnicowanych dawek rtęci organicznej pochodzącej ze szczepionek zawierających tiomersal i wyników zdrowotnych innych niż poddane analizie w omawianym badaniu.
Jednak wyniki omawianego badania mogą wykazywać liczne potencjalne ograniczenia. Niewykluczone, że zaobserwowane wyniki są skutkiem nieznanych błędów systematycznych obecnych w analizowanych zbiorach danych. Wydaje się to mało prawdopodobne, ponieważ przeanalizowane zostały inne wyniki kontrolne (wyniki, co do których nie jest możliwe pod względem biologicznym, że wiążą się z ekspozycją na rtęć organiczną ze szczepionek zawierających tiomersal podanych w okresie postnatalnym), takie jak diagnoza wad wrodzonych (kod ICD-9: 759.9) w bazie danych VSD, z wykorzystaniem tej samej metodologii, jak dla specyficznych opóźnień rozwoju. Nie zaobserwowano żadnych podobnych wzorców istotnych zależności dla tych wyników w porównaniu z wynikami ustalonymi dla ekspozycji na rtęć organiczną pochodzącą z zawierającej tiomersal szczepionki przeciwko WZW B i późniejszego ryzyka diagnozy specyficznych zaburzeń rozwoju. Dla przykładu, przypadki z wadami wrodzonymi i pacjenci w grupie kontrolnej zostali zaszczepieni tą samą ilością 12,5 µg rtęci organicznej z dawki zawierającej tiomersal szczepionki przeciw WZW B w pierwszym miesiącu życia w porównaniu do 0 µg rtęci organicznej z dawki niezawierającej tiomersalu szczepionki przeciwko WZW B lub niezaszczepieniem przeciwko tej chorobie w pierwszym miesiącu życia (OR = 1,03, P ˃ 0,50).
Innym potencjalnym ograniczeniem omawianego badania jest możliwość, że wyniki zaobserwowane dla specyficznych opóźnień rozwoju są skutkiem przypadku statystycznego. Jednak taka możliwość jest mało prawdopodobna, jeśli weźmie się pod uwagę ograniczoną liczbę przeprowadzonych testów statystycznych, wysoce istotne zaobserwowane wyniki (wszystkie wyliczone wartości P były < 0,00001) oraz zgodność w kierunku i znaczenie uzyskanych wyników.
Wśród jeszcze innych potencjalnych ograniczeń omawianego badania wymienić należy możliwość, że niektóre dzieci w kohorcie w zbadanej bazie danych VSD mogły posiadać bardziej subtelne dysfunkcje neurologiczne, na które personel medyczny nie zwrócił uwagi, personel medyczny mógł nieprawidłowo zdiagnozować niektóre dzieci lub niektóre szczepienia mogły nie zostać właściwie sklasyfikowane. Mimo że powyższe ograniczenia, choć mogły wystąpić w danych będących przedmiotem analizy w omawianym badaniu, nie powinny były wywrzeć znaczącego wpływu na zaobserwowane wyniki, nie jest jasne jak zróżnicowane musiały być zabiegi, żeby miały wpływ na poddane badaniu kohorty w oparciu o dawki tiomersalu, które te dzieci otrzymały. Co więcej, nieprawidłowa klasyfikacja analizowanych informacji odchylałaby wszelkie zaobserwowane wyniki w kierunku hipotezy zerowej, jako że takie działanie doprowadziłoby do umieszczenia dzieci w niewłaściwych badanych kategoriach ekspozycji i/lub wyników, to zaś skutkowałoby obniżoną siłą statystyczną przy ustalaniu rzeczywistego potencjalnego związku między ekspozycją a wynikami zdrowotnymi.
Autyzm i rtęć z innych źródeł niż szczepionki
Dodatkowo, kolejnym możliwym ograniczeniem omawianego badania jest fakt, że nie oceniono w nim ekspozycji na inne źródła rtęci [Hg]. Jest bardzo prawdopodobne, że dzieci poddane analizie w omawianym badaniu były narażone na rtęć organiczną z innych zawierających tiomersal szczepionek wieku dziecięcego, w wyniku karmienia piersią i mieszanką dla niemowląt oraz, w mniejszym stopniu, na rtęć pochodzącą z wypełnień dentystycznych, ryb i innych źródeł środowiskowych. Pomimo że inne wymienione źródła rtęci [Hg] mogły w istotny sposób uczestniczyć w patogenezie specyficznych opóźnień rozwoju, kontakt z rtęcią [Hg] nie uwzględniony w badaniu w rzeczywistości powodowałby odchylenie zaobserwowanych wyników w kierunku hipotezy zerowej, ponieważ mógłby wprowadzać zamęt do określonych kategorii ekspozycji na analizowaną Hg. Dla przykładu, dzieci sklasyfikowane jako te, które otrzymały mniejszą ilość rtęci organicznej ze szczepionek zawierających tiomersal, mogły faktycznie otrzymać wysokie dawki Hg z innych źródeł, natomiast dzieci, które przyjęły większą ilość rtęci organicznej ze szczepionek zawierających tiomersal mogły w rzeczywistości otrzymać niskie dawki Hg z innych źródeł, co w efekcie końcowym zminimalizowałoby wagę zaobserwowanych zależności. Oprócz tego innym potencjalnym ograniczeniem omawianego badania może być fakt, że nie przeprowadzono analiz, w których bardziej dogłębnie zbadano by dokładny czas podania i dawki skumulowane rtęci organicznej ze wszystkich zawierających tiomersal szczepionek wieku dziecięcego, które wiążą się z najbardziej niepożądanymi skutkami. W przyszłych badaniach warto byłoby przeanalizować dokładny czas podania oraz zjawisko dawek skumulowanych.
I w końcu omawiane badanie jest ograniczone przez rodzaje analizowanych wyników neurorozwojowych, jak również przez inne zmienne towarzyszące, takie jak rasa, masa urodzeniowa itd., które mogą wpływać na znaczenie ustalonych skutków niepożądanych. Bardzo interesującym krokiem byłoby uwzględnienie w przyszłych badaniach innych wyników neurorozwojowych i innych zmiennych towarzyszących.
Wnioski
Omawiane badanie dostarcza nowych nieodpartych dowodów epidemiologicznych wspierających istnienie znaczącej zależności między rosnącą ekspozycją na rtęć organiczną z zawierających tiomersal szczepionek wieku dziecięcego a późniejszym ryzykiem diagnozy specyficznych opóźnień rozwoju zarówno u chłopców, jak i dziewczynek. Wiele niedawno przeprowadzonych badań wspiera biologicznie wiarygodną rolę ekspozycji na rtęć organiczną pochodzącą z zawierających tiomersal szczepionek wieku dziecięcego w patogenezie specyficznych opóźnień rozwoju. Konkretny kod w ICD-9, poddany analizie w omawianym badaniu, uwzględniał specyficzne opóźnienia rozwoju/ obejmujące zaburzenia mowy/języka, koordynacji, słuchu i umiejętności czytania. Rtęć [Hg] jest znaną neurotoksyną wywołującą zaburzenia neurorozwojowe, zaś jej specyfika polegająca na obieraniu ze cel aksonów dalekiego zasięgu, jak wskazują dowody uzyskane w omawianym badaniu, przyczynia się być może do nieprawidłowości dróg nerwowych dalekiego zasięgu obserwowanych u dzieci ze zdiagnozowanymi specyficznymi opóźnieniami rozwoju obejmującymi umiejętność czytania, słuch, koordynację i mowę/język.
Podsumowując, przy zastosowaniu metodologii badania analitycznego epidemiologicznego uwzględniającego testowanie hipotezy z wykorzystaniem bazy danych VSD ustalono, że ekspozycja na rtęć organiczną pochodzącą z zawierających tiomersal szczepionek wieku dziecięcego stanowi znaczący czynnik ryzyka późniejszej diagnozy specyficznych opóźnień rozwoju u chłopców i dziewczynek. Ponadto, omawiane badanie kładło szczególny nacisk na konieczność uwzględnienia w analizie odpowiedniego okresu obserwacyjnego. Tym samym przypadki i dzieci w grupie kontrolnej pozostawały pod obserwacją przez trwającą wystarczająco długo i wynikającą z dowodów przerwę, tak by upewnić się, że zostały właściwie sklasyfikowane pod względem przebytych szczepień i wyników zdrowotnych. Ten precyzyjnie ustalony okres obserwacyjny pomógł zatem uniknąć ewentualnej stronniczości lub zagmatwania związku przyczynowo-skutkowego między ekspozycją a wynikiem. Konieczne jest przeprowadzenie dalszych badań, aby ocenić potencjalną zależność między ekspozycją na rtęć organiczną pochodzącą z zawierających tiomersal szczepionek wieku dziecięcego a innymi przewlekłymi zaburzeniami, a także zbadać czas narażenia na rtęć organiczną ze szczepionek zawierających tiomersal, które łączą się z niepożądanymi skutkami w określonych podzbiorowościach.
Jak już wcześniej wspomniano, ze względu na fakt, że rtęć [Hg] kumuluje się, łączna ekspozycja z różnych źródeł stanowi poważny problem, zwłaszcza w obliczu ukrytej, przewlekłej ekspozycji, która wydaje się nasilać i wywiera szkodliwy wpływ. Z tego powodu każde możliwe do uniknięcia źródło ekspozycji powinno zostać ocenione i każdej ekspozycji z takiego źródła należy zapobiegać. Działanie addycyjne z różnych źródeł może potencjalnie zwiększyć narażenie dziecka na Hg z subklinicznego poziomu przewlekłej ekspozycji do poziomu klinicznego, w którym występują oczywiste skutki neurorozwojowe. Rutynowe szczepionki wieku dziecięcego mogą być ważnym narzędziem zdrowia publicznego zmniejszającym zachorowalność i śmiertelność, która wiąże się z określonymi chorobami zakaźnymi. Jednakże imperatywem zachowania zdrowia publicznego jest także zaprzestanie niepotrzebnego dodawania do szczepionek rtęci organicznej w postaci tiomersalu stosowanego jako środek konserwujący uwzględniając dane wskazujących na zależność między podawaniem rtęci a niepożądanymi skutkami.
Podziękowania
Badanie uzyskało wsparcie finansowe Dwoskin Family Foundation i Selz Foundation.
Źródło finansowania: Badanie uzyskało wsparcie finansowe Dwoskin Family Foundation i Selz Foundation.
Konflikt interesów: Wszyscy naukowcy biorący udział w omawianym badaniu uczestniczą w postępowaniu sądowym dotyczącym produktów biologicznych/szczepionek.
Zobacz na: Ekonomia polityczna autyzmu – dr Toby Rogers
Czy chińscy naukowcy odkryli brakujący fragment układanki autyzmu? – J.B. Handley
Niebezpieczeństwa nadmiernych szczepień w trakcie rozwoju mózgu – dr Russell Blaylock
Ciąża, Odporność, Schizofrenia i Autyzm – dr Paul Patterson
Prawdopodobny centralny mechanizm zaburzeń ze spektrum autyzmu, część 1 – dr Russell L. Blaylock
Prawdopodobny centralny mechanizm zaburzeń ze spektrum autyzmu, część 2 – dr Russell L. Blaylock
Zaburzenia mitochondrialne u osób z autyzmem
Autyzm i Szczepionki na Świecie – Kalendarze szczepień, wskaźniki występowania autyzmu i śmiertelność poniżej 5 roku życia
Naukowe obalenie duńskiego badania kohortowego [MMR i autyzm] – dr Brian S. Hooker
Przypisy:
1. Kalia M. Brain development: Anatomy, connectivity, adaptive plasticity, and toxicity. Metabolism. 2008;57(Suppl 2):S2–5.
2. Migliarini S, Pacini G, Pelosi B, Lunardi G, Pasqualetti M. Lack of brain serotonin affects postnatal development and serotonergic neuronal circuitry formation. Mol Psychiatry. 2013;18:1106–18.
3. LeBlanc JJ, Fagiolini M. Autism: A “critical period” disorder? Neural Plast. 2011;2011:921680.
4. Boyle CA, Boulet S, Schieve LA, Cohen RA, Blumberg SJ, Yeargin-Allsopp M, et al. Trends in the prevalence of developmental disabilities in US children, 1997-2008. Pediatrics. 2011;127:1034–42.
5. Arroyo HA, Fernandez MC. Environmental toxic and its effect on neurodevelopment. Medicina (B Aires) 2013;73(Suppl 1):93–102.
6. Roberts AL, Lyall K, Hart JE, Laden F, Just AC, Bobb JF, et al. Perinatal air pollutant exposures and autism spectrum disorder in the children of nurses’ health study II participants. Environ Health Perspect. 2013;121:978–84.
7. Kern JK, Geier DA, Ayzac F, Adams JB, Mehta JA, Geier MR. Toxicity biomarkers among US children compared to a similar cohort in France: A blinded study measuring urinary porphyrins. Toxicol Environ Chem. 2011;93:396–405.
8. Laks DR. Assessment of chronic mercury exposure within the U.S. population, National Health and Nutrition Examination Survey, 1999-2006. Biometals. 2009;22:1103–14.
9. Kern JK, Haley BE, Geier DA, Sykes LK, King PG, Geier MR. Thimerosal exposure and the role of sulfation chemistry and thiol availability in autism. Int J Environ Res Public Health. 2013;10:3771–800.
10. Ball LK, Ball R, Pratt RD. An assessment of thimerosal use in childhood vaccines. Pediatrics. 2001;107:1147–54.
11. Geier DA, Geier MR. A review of the Vaccine Adverse Event Reporting System database. Expert Opin Pharmacother. 2004;5:691–8.
12. Chen RT, DeStefano F, Davis RL, Jackson LA, Thompson RS, Mullooly JP, et al. The Vaccine Safety Datalink: Immunization research in health maintenance organizations in the USA. Bull World Health Organ. 2000;78:186–94.
13. Chen RT, Glasser JW, Rhodes PH, Davis RL, Barlow WE, Thompson RS, et al. Vaccine Safety Datalink project: A new tool for improving vaccine safety monitoring in the United States. The Vaccine Safety Datalink Team. Pediatrics. 1997;99:765–73.
14. Wassilak SG, Glasser JW, Chen RT, Hadler SC. Utility of large-linked databases in vaccine safety, particularly in distinguishing independent and synergistic effects. The Vaccine Safety Datalink Investigators. Ann N Y Acad Sci. 1995;754:377–82.
15. Ellenberg SS, Braun MM. Monitoring the safety of vaccines: Assessing the risks. Drug Saf. 2002;25:145–52.
16. Varricchio F, Iskander J, Destefano F, Ball R, Pless R, Braun MM, et al. Understanding vaccine safety information from the Vaccine Adverse Event Reporting System. Pediatr Infect Dis J. 2004;23:287–94.
17. Iskander J, Pool V, Zhou W, English-Bullard R. VAERS Team. Data mining in the US using the Vaccine Adverse Event Reporting System. Drug Saf. 2006;29:375–84.
18. Hepatitis B virus: A comprehensive strategy for eliminating transmission in the United States through universal childhood vaccination. Recommendations of the Immunization Practices Advisory Committee (ACIP) MMWR Recomm Rep. 1991;40:1–25.
19. Clarkson TW, Nordberg GF, Sager PR. Reproductive and developmental toxicity of metals. Scand J Work Environ Health. 1985;11:145–54.
20. Dorea JG. Low-dose mercury exposure in early life: Relevance of thimerosal to fetuses, newborns, and infants. Curr Med Chem. 2013;20:4060–9.
21. Burbacher TM, Shen DD, Liberato N, Grant KS, Cernichiari E, Clarkson T. Comparison of blood and brain mercury levels in infant monkeys exposured to methylmercury or vaccines containing Thimerosal. Environ Health Perspect. 2005;113:1015–21.
22. Rodrigues JL, Sepeloni JM, Batista BL, Souza SS, Barbosa F., Jr Identification and distribution of mercury species in rat tissues following administration of Thimerosal or methylmercury. Arch Toxicol. 2010;84:891–6.
23. Pichichero ME, Gentile A, Giglio N, Umido V, Clarkson T, Cernichiari E, et al. Mercury levels in newborns and infants after receipt of Thimerosal-containing vaccines. Pediatrics. 2008;121:e208–14.
24. Pichichero ME, Gentile A, Giglio N, Alonso MM, Fernandez Mentaberri MV, Zareba G, et al. Mercury levels in premature and low birth weight newborn infants after receipt of Thimerosal-containing vaccines. J Pediatr. 2009;155:495–9.
25. Stajich GV, Lopez GP, Harry SW, Sexson WR. Iatrogenic exposure to mercury after hepatitis B vaccination in preterm infants. J Pediatr. 2000;136:679–81.
26. Marques RC, Dorea JG, Fonseca MF, Bastos WR, Malm O. Hair mercury in breast-fed infants exposed to Thimerosal-preserved vaccines. Eur J Pediatr. 2007;166:935–41.
27. Zimmermann LT, Santos DB, Naime AA, Leal RB, Dorea JG, Barbosa F, Jr, et al. Comparative study on methyl- and ethylmercury-induced toxicity in C6 glioma cells and the potential role of LAT-1 in mediating mercurial-thiol complexes uptake. Neurotoxicology. 2013;38:1–8.
28. Kern JK, Geier DA, Audhya T, King PG, Sykes LK, Geier MR. Evidence of parallels between mercury intoxication and the brain pathology of autism. Acta Neurobiol Exp (Wars) 2012;72:113–53.
29. Hagmann P, Cammoun L, Gigandet X, Meuli R, Honey CJ, Wedeen VJ, et al. Mapping the structural core of human cerebral cortex. PLoS Biol. 2008;6:e159.
30. Fujioka T, Mourad N, Trainor LJ. Development of auditory-specific brain rhythm in infants. Eur J Neurosci. 2011;33:521–9.
31. Smith JB, Alloway KD. Functional specificity of claustrum connections in the rat: Interhemispheric communication between specific parts of motor cortex. J Neurosci. 2010;30:16832–44.
32. Wandell BA, Yeatman JD. Biological developing of reading circuits. Curr Opin Neurobiol. 2013;23:261–8.
33. Yeatman JD, Dougherty RF, Ben-Shachar M, Wandell BA. Developing of white matter and reading skills. Proc Natl Acad Sci U S A. 2012;109:E3045–53.
34. Jeong JW, Sundaram SK, Kumar A, Chugani DC, Chugani HT. Aberrant diffusion and geometric properties in the left arcuate fasciculus of developmentally delayed children: A diffusion tensor imaging study. AJNR Am J Neuroradiol. 2011;32:323–30.
35. Pallocca G, Fabbri M, Sacco MG, Gribaldo L, Pamies D, Laurenza I, et al. miRNA expression profiling in a human stem cell-based model as a tool for developmental neurotoxicity testing. Cell Biol Toxicol. 2013;29:239–57.
36. Hornig M, Chian D, Lipkin WI. Neurotoxic effects of postnatal thimerosal are mouse strain dependent. Mol Psychiatry. 2004;9:833–45.
37. Olczak M, Duszczyk M, Mierzejewski P, Meyza K, Majewska MD. Persistent behavioral impairments and alterations of brain dopamine system after early postnatal administration of thimerosal in rats. Behav Brain Res. 2011;223:107–18.
38. Chen YN, Wang J, Zhang J, Li SJ, Hel L, Shao DD, et al. Effect of thimerosal on the neurodevelopment of premature rats. World J Pediatr. 2013;9:356–60.
39. Sulkowski ZL, Chen T, Midha S, Zavacki AM, Sajdel-Sulkowska EM. Maternal thimerosal exposure results in aberrant cerebellar oxidative stress, thyroid hormone metabolism, and motor behavior in rat pups; sex- and strain-dependent effects. Cerebellum. 2012;11:575–86.
40. Laurente J, Remuzgo F, Avalos B, Chiquinta J, Ponce B, Avendano R, et al. Neurotoxic effects of thimerosal at vaccines doses on the encephalon and development in 7 days-old hamsters. An Fac Med Lima. 2007;68:222–37.
41. Hewitson L, Houser LA, Stott C, Sackett G, Tomko JL, Atwood D, et al. Delayed acquisition of neonatal reflexes in newborn premates receiving a Thimerosal-containing hepatitis B vaccine: Influence of gestational age and birth weight. J Toxicol Environ Health A. 2010;73:1298–313. [Tiomersal i autyzm]
42. Young HA, Geier DA, Geier MR. Thimerosal exposure in infants and neurodevelopmental disorders: An assessment of computerized medical records in the Vaccine Safety Datalink. J Neurol Sci. 2008;271:110–8. [Tiomersal i autyzm]
43. Geier DA, Geier MR. A Two-phased population epidemiological study of the safety of Thimerosal-containing vaccines: A follow-up analysis. Med Sci Monit. 2005;11:CR160–70. [Tiomersal i autyzm]
44. Gallagher C, Goodman M. Hepatitis B triple series vaccine and developmental disability in US children aged 1-9 years. Toxicol Environ Chem. 2008;90:997–1008.
45. Geier DA, Geier MR. A meta-analysis epidemiological assessment of neurodevelopmental disorders following vaccines administered from 1994 through 2000 in the United States. Neuro Endocrinol Lett. 2006;27:401–13. [Tiomersal i autyzm]
46. Mrozek-Budzyn D, Majewska R, Kieltyka A, Augustyniak M. Neonatal exposure to thimerosal from vaccines and child development in the first 3 years of life. Neurotoxicol Teratol. 2012;34:592–7.
47. Dorea JG, Marques RC, Isejima C. Neurodevelopment of amazonian infants: Antenatal and postnatal exposure to methyl- and ethylmercury. J Biomed Biotechnol. 2012;2012:132876.
48. Verstraeten T, Davis RL, DeStefano F, Lieu TA, Rhodes PH, Black SB, et al. Vaccine Safety Datalink Team. Safety of Thimerosal-containing vaccines: A two-phased study of computerized health maintenance organization databases. Pediatrics. 2003;112:1039–48.
49. Andrews N, Miller E, Grant A, Stowe J, Osborne V, Taylor B. Thimerosal exposure in infants and developmental disorders: A retrospective cohort study in the United Kingdom does not support a causal association. Pediatrics. 2004;114:584–91.
50. Tozzi AE, Bisiacchi P, Tarantino V, De Mei B, D’Elia L, Chiarotti F, et al. Neuropsychological performance 10 years after immunization in infancy with thimerosal-containing vaccines. Pediatrics. 2009;123:475–82.