Infuzja autologicznej krwi pępowinowej jest bezpieczna i możliwa u małych dzieci z zaburzeniami ze spektrum autyzmu: wyniki jednoośrodkowego otwartego badania klinicznego pierwszej fazy
Źródło: Autologous Cord Blood Infusions Are Safe and Feasible in Young Children with Autism Spectrum Disorder: Results of a Single‐Center Phase I Open‐Label Trial; Stem Cells Transl Med. Maj 2017; 6(5): 1332-1339.

Infuzja autologicznej krwi pępowinowej jest bezpieczna i możliwa u małych dzieci z zaburzeniami ze spektrum autyzmu
„Uniwersytet Duke wykazał w tym badaniu, że znaczną poprawę w zachowaniu zaobserwowano, gdy dzieciom z zaburzeniem ze spektrum autyzmu podano ich własną autologiczną krew pępowinową. To leczenie wyraźnie pokazuje, że większość dzieci z autyzmem nie rodzi się z nim, ponieważ chorób genetycznych, takich jak zespół Downa lub zwłóknienie mięśni, nie można leczyć za pomocą autologicznych komórek macierzystych. Dlatego wyzwalacz środowiskowy lub wyzwalacze wprowadzone na świat około 1980 roku kiedy autyzm zaczął narastać, muszą zostać zidentyfikowane i wyeliminowane lub zredukowane w środowisku.” – dr Theresa Deisher, Open Letter from Dr. Theresa Deisher to Legislators Regarding Fetal Cell DNA in Vaccines https://www.talkingaboutthescience.com/DOCS/Deisher2019.pdf
Streszczenie
Mimo postępu we wczesnym diagnozowaniu i terapiach behawioralnych potrzebne są bardziej skuteczne metody leczenia dzieci z zaburzeniami ze spektrum autyzmu (ang. autism spectrum disorder, ASD). Postawiliśmy hipotezę, że terapie z wykorzystaniem komórek pochodzących z krwi pępowinowej mogą działać łagodząco na objawy ASD poprzez regulowanie procesów zapalnych w mózgu. Przeprowadziliśmy zatem pierwszą fazę otwartego badania klinicznego, by ocenić bezpieczeństwo i możliwość wykonania pojedynczej infuzji dożylnej autologicznej krwi pępowinowej, a także podatność na zmiany kilku narzędzi oceny służących ustaleniu odpowiednich punktów końcowych dla przyszłych badań. Do badania przyjęto dwadzieścioro pięcioro dzieci, których średnia wieku wynosiła 4,6 lat (przedział wiekowy 2,26-5,97), z potwierdzoną diagnozą ASD i przechowywaną w banku odpowiednią jednostką krwi pępowinowej. Dzieci poddano badaniu za pomocą zestawu testów behawioralnych i funkcjonalnych bezpośrednio przed infuzją krwi pępowinowej (początek badania) oraz po upływie 6 i 12 miesięcy. Ocena zdarzeń niepożądanych w okresie 12 miesięcy wskazywała, że omawiana metoda leczenia jest bezpieczna i dobrze tolerowana. Znaczącą poprawę zachowania dzieci zaobserwowano w zakresie ocenianych przez rodziców parametrów dotyczących komunikacji społecznej i objawów autyzmu, ocen klinicystów ogólnego nasilenia objawów autyzmu i stopnia poprawy, standaryzowanych parametrów dotyczących słownictwa ekspresywnego oraz obiektywnych parametrów okulograficznych uwagi, jaką dzieci zwracają na bodźce społeczne, co wskazuje, że parametry te mogą być użytecznymi punktami końcowymi dla badań w przyszłości. Poprawę zachowania obserwowano w ciągu pierwszych 6 miesięcy po infuzji, przy czym była ona bardziej widoczna u dzieci z wyższym wyjściowym ilorazem inteligencji niewerbalnej. Powyższe dane będą stanowiły podstawę dla przyszłych badań służących określeniu skuteczności infuzji krwi pępowinowej u dzieci z ASD.
Infuzja autologicznej krwi pępowinowej jest bezpieczna i możliwa u małych dzieci z zaburzeniami ze spektrum autyzmu
Wstęp
Spektrum autyzmu (ASD) to zaburzenie neurorozwojowe charakteryzujące się upośledzeniem komunikacji społecznej, występowaniem zachowań powtarzających się oraz ograniczonym zakresem wykonywanych czynności, które pojawia się w dzieciństwie. Szacuje się, że w Stanach Zjednoczonych na autyzm choruje w przybliżeniu 1 na 68 dzieci.[1] Większość chorych na ASD nie jest w stanie prowadzić niezależnego życia i wymaga trwającej całe życie pomocy lub mieszkania z opiekunem. Według szacunków koszt dożywotniego utrzymania osoby z ASD wynosi 1,4 miliona dolarów. Dla osób, które dodatkowo są niepełnosprawne intelektualnie wynosi on 2,4 miliony.[2]
Wśród metod leczenia autyzmu wymienić można farmakologię, terapię behawioralną, terapię zajęciową i terapię mowy, jak również specjalistyczne wsparcie edukacyjne i zawodowe. Wczesna intensywna terapia behawioralna wiąże się z zasadniczo lepszymi wynikami, ale nawet dzieci z ASD poddane tej terapii pozostają często w istotnym stopniu upośledzone. Celem wszystkich dostępnych obecnie metod leczenia, takich jak leki psychotropowe, jest łagodzenie powiązanych objawów współistniejących, jak np. rozdrażnienie, ale nie oddziałują one na kluczowe objawy autyzmu. W tym świetle istnieje znaczna niezaspokojona potrzeba wypracowania bardziej skutecznych metod leczenia celujących w podstawowe objawy ASD.
Aktywacja komórek glejowych i stan zapalny układu nerwowego w mózgu pacjentów z autyzmem – Dr Diana L. Vargas
Zapalenie mózgu cechą autyzmu, wykazują wyniki badania z Johns Hopkins University
Pierwszy dowód na odpowiedź immunologiczną atakującą komórki mózgowe u osób z diagnozą autyzmu – dr Matthew Anderson
Zaburzenia mitochondrialne u osób z autyzmem
Do etiologii ASD przyczyniają się zarówno czynniki genetyczne, jak i środowiskowe[4,5,6]. Chociaż dokładna fizjologia patologiczna jest nieznana, zaobserwowano m.in. nieprawidłowe funkcjonowanie synaps w niektórych obszarach mózgu[7,8,] nieprawidłowości istoty białej[9] oraz stan zapalny układu nerwowego[10]. Przyczyną patogenezy patologii odpornościowej w mózgach pacjentów z ASD może być nadekspresja układów genów związanych z odpornością[11], obecność przeciwciał matki przeciwko tkance mózgu płodu[12], nietypowe poziomy cytokin prozapalnych (IL-6, TNF-ɑ) w płynie mózgowo-rdzeniowym [13] oraz nadmierna aktywacja komórek mikrogleju prowadząca do powstawania nieprawidłowych szlaków nerwowych[14,15]. Metody terapeutyczne jako takie, wywierające wpływ na modulację odporności lub regulację łączliwości neuronów stanowią logiczne cele dla nowatorskich metod leczenia tej populacji. Modele przedkliniczne wykazały, że krew pępowinowa zawiera komórki efektorowe, które, poprzez sygnalizację parakrynową, zmieniają łączliwość mózgu, a także powstrzymują stan zapalny[16,17]. Wykazano, że infuzja komórek krwi pępowinowej jest bezpieczna u pacjentów z mózgowym porażeniem dziecięcym oraz innymi nabytymi uszkodzeniami mózgu.[18,19,20]
Postawiliśmy hipotezę, że infuzja krwi pępowinowej może odgrywać ważną rolę w leczeniu ASD i przeprowadziliśmy jednoośrodkowe otwarte badanie I fazy służące określeniu bezpieczeństwa i możliwości wykonywania, któremu poddaliśmy dzieci pozostające pod opieką pediatryczną. Badanie koncentrowało się na
(a) bezpieczeństwie pojedynczej infuzji dożylnej krwi pępowinowej i
(b) podatności na zmiany oraz możliwości stosowania kilku różnych narzędzi oceny w przypadku małych dzieci z ASD.
Materiały i metody
Rodzaj i opis badania
Przeprowadzone badanie było jednoośrodkowym badaniem otwartym I fazy dotyczącym pojedynczej dożylnej infuzji krwi pępowinowej u 25 dzieci z ASD. Wszystkie dzieci zostały początkowo wpisane do protokołu części przesiewowej, by uzyskać dokumentację medyczną oraz informacje na temat przechowywanych w banku jednostkach ich krwi pępowinowej. Przed badaniem z opiekunami wszystkich uczestników przeprowadzono telefoniczną rozmowę decydującą o włączeniu do badania, jak również dostarczyli oni dokumentację medyczną i nagrania do wglądu zespołu prowadzącego badanie w celu ustalenia przydatności do badania. Dzieci z potwierdzoną diagnozą ASD i odpowiednią jednostką krwi pępowinowej przechowywanej w banku zakwalifikowały się do udziału w badaniu. Uzyskano pisemną świadomą zgodę na udział w badaniu zarówno dla fazy przesiewowej, jak i fazy leczenia omawianego badania. Badanie zostało zatwierdzone przez Niezależną Komisję Etyczną Szpitala Duke i przeprowadzone jako badanie z wykorzystaniem nowego produktu leczniczego o numerze 15949.
W ramach udziału w badaniu uczestnicy i ich opiekunowie przyjechali na Uniwersytet Duke trzykrotnie. W czasie pierwszej wizyty uczestnicy zostali zbadani i otrzymali pojedynczą dożylną infuzję autologicznej krwi pępowinowej. Po upływie 6 i 12 miesięcy od infuzji uczestnicy wrócili, by poddać się kontrolnej ocenie klinicznej. Dodatkowe wywiady i ankiety wypełnione przez opiekunów zebrano po upływie 3 i 9 miesięcy od infuzji.
Uczestnicy
Do badania zakwalifikowani zostali uczestnicy w wieku od 2 do 5 lat spełniający kryteria diagnozy klinicznej ASD zgodnie z klasyfikacją zaburzeń psychicznych Amerykańskiego Towarzystwa Psychiatrycznego DSM-5[21]. Diagnoza ASD w oparciu o DSM-5 została postawiona przez kompetentnych klinicystów i podana do wiadomości w protokole obserwacji do diagnozowania zaburzeń ze spektrum autyzmu ADOS-2 oraz w wywiadzie do diagnozowania autyzmu ADI-R[23]. Dodatkowe kryteria włączenia obejmowały między innymi
(a) iloraz inteligencji niewerbalnej (IQ) ≥ 35 zgodnie ze skalami inteligencji stanford-binet dla wczesnego dzieciństwa, edycja piąta[24] lub skalami mullen dla wczesnego uczenia[25],
(b) dostępność odpowiedniej jednostki autologicznej krwi pępowinowej,
(c) stan pacjenta pozostawał stabilny w okresie przyjmowania dotychczasowych leków przez co najmniej 2 miesiące przed infuzją,
(d) możliwość trzykrotnego przyjazdu do Duke University (pierwsza wizyta i dwie wizyty po upływie 6 i 12 miesięcy od rozpoczęcia badania) i
(e) rodzice mówiący po angielsku.
Wśród kryteriów wyłączenia z badania wymienić można
(a) wcześniejszą terapię komórkową w wywiadzie,
(b) stosowanie dożylnej immunoglobuliny lub innych leków przeciwzapalnych (z wyjątkiem niesteroidowych leków przeciwzapalnych),
(c) znane genetyczne (np. zespół łamliwego chromosomu X) bądź inne istotne schorzenie współistniejące,
(d) widoczną dysmorfologię wskazującą na syndrom genetyczny,
(e) niekontrolowaną padaczkę,
(f) w znacznym stopniu upośledzone funkcjonowanie nerek lub wątroby i
(g) znaczące klinicznie nieprawidłowości w morfologii krwi.
Jednostki krwi pępowinowej
Wszyscy uczestnicy musieli posiadać dostępną jednostkę autologicznej krwi pępowinowej przechowywaną w rodzinnym lub publicznym banku krwi pępowinowej. W przesiewowej fazie badania opisy krwi pępowinowej potencjalnych uczestników zostały zweryfikowane w celu upewnienia się, że spełniają następujące kryteria dotyczące stanu przed krwioprezerwacją:
(a) całkowita liczba komórek jądrzastych (ang. total nucleated cell count, TNCC) ≥ 1 x 107/kg,
(b) ukształtowane i negatywne kultury sterylności,
(c) ujemne markery chorób zakaźnych matki przetestowane na dawcy-matce lub produkcie krwi pępowinowej (takich jak co najmniej wirusowe zapalenie wątroby typu B, wirusowe zapalenie wątroby typu C, wirus ludzkiego niedoboru odporności [HIV], wirus ludzkiej białaczki z komórek T [HTLV] i syfilis) i
(d) próbka testowa dostępna w celu przeprowadzenia dodatkowych badań. Jeśli istniało prawdopodobieństwo, że uczestnik i jego jednostka krwi pępowinowej zostaną zakwalifikowani do badania, próbkę jednostki krwi pępowinowej wysyłano na Uniwersytet Duke w celu przeprowadzenia badania efektywności[26]. Zarówno uczestnik, jak i próbka jednostki krwi pępowinowej poddani zostali badaniu niskiej rozdzielczości ludzkich antygenów leukocytarnych (ang. human leukocyte antigens, HLA) w celu potwierdzenia identyczności. Jeżeli w próbce testowej żywotność antygenu różnicowania komórkowego CD45 wynosiła ˃40% i potwierdzono identyczność HLA, poddaną krwioprezerwacji jednostkę krwi pępowinowej wysyłano w zbiorniku suchym do Laboratorium Transplantologicznego Komórek Macierzystych na Uniwersytecie Duke, gdzie była przechowywana w stanie zamrożonym w płynnym azocie do dnia wykonania infuzji.
Procedury
Infuzja autologicznej krwi pępowinowej
W dniu wykonania infuzji, krew pępowinowa była rozmrażana i płukana w roztworze dekstranu 40 tys. oraz 5-procentowym roztworze albumin i umieszczana w 1,25 ml/kg mieszanki tych roztworów w celu przeprowadzenia zabiegu[27]. Rozmrożone jednostki krwi pępowinowej badano pod kątem całkowitej liczby komórek jądrzastych, żywotnych komórek CD34+, jednostek tworzących kolonię (ang. colony-forming units, CFUs), a także żywotności komórek przy użyciu błękitu trypanu i kultur sterylności. Infuzję autologicznej krwi pępowinowej wykonywano po obrazowaniu metodą rezonansu magnetycznego (ang. magnetic resonance imaging, MRI) mózgu poddanego sedacji. Dostęp dożylny (ang. intravenous, IV) uzyskiwał anestezjolog dziecięcy. Po wykonaniu MRI dzieci przyjmowano do ośrodka leczenia ambulatoryjnego Children’s Health Center Day Hospital na Uniwersytecie Duke w celu przeprowadzenia infuzji. Po premedykacji z zastosowaniem Benadrylu (0,5 mg/kg IV), Sol-Medrolu (0,5 mg/kg IV) oraz, jeśli dziecko było wybudzone i zdolne do przyjęcia leku doustnie, Tylenolu [paracetamol] (10 mg/kg doustnie), pacjenci otrzymywali albo część albo całą jednostkę swojej krwi pępowinowej, dostosowaną by dostarczyć 1-5 x 107 komórek na kilogram, przy zastosowaniu infuzji poprzez wenflon, trwającej od 2 do 30 minut. Podano dożylnie 1,5 razy dawki podtrzymującej płynów przez 30 minut do 2 godzin po infuzji krwi pępowinowej. Podczas infuzji i do chwili wybudzenia się dziecka z sedacji nieprzerwanie monitorowano parametry życiowe i dokonywano pomiarów metodą pulsoksymetrii. Infuzja autologicznej krwi pępowinowej.
Kryteria bezpiecznej oceny
Pacjentów obserwowano podczas wykonywania infuzji i monitorowano pod kątem reakcji na nią. Dodatkowe zdarzenia niepożądane (ang. adverse events, AE) zidentyfikowano w czasie telefonicznych wywiadów z rodzicem/opiekunem uczestnika po upływie 7-10 dni, 3 miesięcy i 9 miesięcy od infuzji oraz osobiście w czasie wyjściowej wizyty i podczas wizyt klinicznych po upływie 6 i 12 miesięcy od infuzji. W celu dokonania analizy dokładne terminy dotyczące działań niepożądanych zostały naniesione na standardową terminologię zdefiniowaną według powszechnych kryteriów terminologicznych dla zdarzeń niepożądanych (ang. Common Terminology Criteria for Adverse Events, CTCAE) wersja 4.0 i podsumowane ze względu na stopień nasilenia oraz związek z omawianym zabiegiem zgodnie z oceną pracownika naukowego.
Narzędzia oceny klinicznej
W celu ustalenia zarówno możliwości podania, jak i przydatności jako punktu końcowego dla przyszłych badań klinicznych fazy II i III wykorzystano liczne narzędzia oceny klinicznej. Wśród nich wymienić można: skalę zachowań adaptacyjnych Vineland (VABS-II), skalę ogólnego wrażenia klinicznego (ang. Clinical Global Impression Scale, CGI), inwentarz zachowań typowych dla całościowych zaburzeń rozwoju (ang. Pervasive Developmental Disorder Behavior Inventory, PDDBI), test słownikowy Expressive One-Word Picture Vocabulary Test-4 (EOWPVT-4), podskalę Behavior Assessment for Children-Social Skills, skalę Aberrant Behavior Checklist, Sensory Experiences Questionnaire, skalę powtarzającego się zachowania, skalę inteligencji (skale mullen dla wczesnego uczenia lub stanford-binet), analizę środowiska językowego, wywiad rodzicielski PAPA (ang. Preschool Age Psychiatric Assessment), skalę Aberrant Behavior Checklist, ATN GI Symptoms Inventory oraz inwentarz stresu rodzicielskiego. Uwzględniono ponadto trzy obiektywne biomarkery: śledzenie ruchu gałki ocznej w reakcji na bodźce społeczne (ang. EGT, Eye Gaze Tracking of Social Stimuli), EEG, a także rezonans magnetyczny mózgu. Wyniki badań EEG i rezonansu magnetycznego mózgu zostaną podane oddzielnie. Wyniki pomiarów, które zostały wybrane a priori jako główny punkt końcowy dotyczący zachowania (VABS-II Socialization Subscale Standard Score) i jako kluczowe dodatkowe punkty końcowe dotyczące zachowania (CGI, PDDBI, EOWPVT) oraz biomarker śledzenia ruchu gałki ocznej są zawarte w niniejszym omówieniu.
Skala zachowań adaptacyjnych (VABS-II)28 to skala dla opiekuna stosowana do oceny zachowań adaptacyjnych dziecka w wielu sferach. VABS-II jest dobrze ustandaryzowanym narzędziem pomiaru charakteryzującym się dużą niezawodnością i trafnością[29,30,31,32], który daje ogólny wynik łączny, jak również wyniki standardowe według podskali w następujących obszarach: socjalizacja, komunikacja, codzienne umiejętności oraz umiejętności motoryczne. Główny opiekun każdego uczestnika wypełnił kwestionariusz oceny według skali VABS-II podczas pierwszej wizyty i wizyt po upływie 6 i 12 miesięcy. Poprawę podstawowych objawów ASD w zakresie zachowania społecznego zmierzono za pomocą skali Socialization Subscale Score.
CGI to powszechnie stosowana skala klasyfikacji, za pomocą której mierzy się nasilenie objawów i reakcję na leczenie lub zmianę zachowania między punktami czasowymi. Wykorzystano dwie wersje CGI: skalę ogólnego wrażenia klinicznego – ogólnej oceny ciężkości choroby (ang. CGI-Severity, CGI-S) i skalę ogólnego wrażenia klinicznego – ogólnej oceny poprawy klinicznej (ang. CGI-Improvement, CGI-I). CGI-S jest 7-punktową skalą wskazującą nasilenie objawów ASD każdego uczestnika w chwili dokonywania oceny względem wcześniejszych doświadczeń opiniodawcy związanych z uczestnikami, którzy zostali tak samo zdiagnozowani. W oparciu o całokształt doświadczeń klinicznych opiniodawcy i wszystkie dostępne informacje, objawy każdego uczestnika zostały sklasyfikowane jako
1: nieobecne (brak ASD),
2: objawy ASD prawie niezauważalne,
3: łagodne objawy ASD,
4: objawy ASD o umiarkowanym nasileniu,
5: objawy ASD umiarkowanie ciężkie,
6: ciężkie objawy ASD lub
7: bardzo ciężkie objawy ASD.
Każdemu uczestnikowi przypisano klasyfikację według skali CGI-S podczas pierwszej wizyty i w czasie wizyt po upływie 6 i 12 miesięcy. CGI-I to 7-stopniowa skala wskazująca stopień poprawy lub pogorszenia objawów ASD w stosunku do początku badania. W oparciu o całość dostępnych informacji stan każdego uczestnika został sklasyfikowany jako
1: bardzo znacząca poprawa,
2: znacząca poprawa,
3: minimalna poprawa,
4: bez zmian,
5: minimalne pogorszenie,
6: znaczące pogorszenie lub
7: bardzo znaczące pogorszenie.
Każdemu uczestnikowi przypisano klasyfikację według skali CGI-I w czasie wizyt po upływie 6 i 12 miesięcy i każdy zgłosił stopień poprawy lub pogorszenia względem początku badania. Wszystkie oceny zostały przeprowadzone przez wysoce doświadczonych klinicystów specjalizujących się w ASD. PDDBI jest kwestionariuszem w formie ankiety dla opiekuna opracowanym w celu dokonania oceny zachowań społecznych, funkcjonowania adaptacyjnego i funkcjonowania nieadaptacyjnego w obszarach zazwyczaj dotkniętych przez ASD. PDDBI został ustandaryzowany za pomocą próby opiekunów i nauczycieli dzieci z ASD wywodzących się z różnych środowisk rasowych, etnicznych i socjoekonomicznych[34]. Główny opiekun każdego uczestnika wypełnił PDDBI na początku badania i w czasie wizyt po upływie 6 i 12 miesięcy, a także na odległość po upływie 3 i 9 miesięcy od pierwszej wizyty. EOWPVT-4[35] to instrument kliniczny do oceny umiejętności dopasowania przez pacjenta wypowiedzianego słowa do obrazu przedstawiającego przedmiot, czynność lub pojęcie. Każde dziecko poddano EOWPVT-4 na początku badania i w czasie wizyt po upływie 6 i 12 miesięcy.
Przeprowadzono również badanie z wykorzystaniem urządzeń do śledzenia wzroku i ruchu gałki ocznej służące ocenie stopnia skupienia wzroku na bodźcach społecznych w porównaniu z niespołecznymi. EGT jest technologią, która umożliwia oznaczanie ilościowe rozkładu uwagi wzrokowej danej osoby od niemowlęctwa do dorosłości. Sprzęt do badania EGT wykorzystuje diody emitujące podczerwień i kamery na podczerwień do pomiaru odbicia światła na rogówce oka wykorzystywanego z kolei do oceny kierunku patrzenia. Podczas badania EGT uczestnicy obejrzeli 4-minutowe nagranie przedstawiające dynamiczne bodźce społeczne, w tym fragmenty ukazujące aktorkę inicjującą wspólne pole uwagi[37]. Wcześniejsze badania wykorzystujące powyższe bodźce unaoczniły, że małe dzieci z ASD wykazują zmniejszoną uwagę zarówno wobec całej tej sceny, jak i wobec twarzy aktorki podczas inicjowania wspólnego pola uwagi. Wystąpiła także korelacja między zmniejszoną uwagą wobec całej sceny a nasileniem objawów autyzmu[37]. Każde dziecko przeszło badanie EGT na początku badania i podczas wizyt po upływie 6 i 12 miesięcy.
Informacje dotyczące liczby godzin, jakie dzieci spędziły na zajęciach terapii behawioralnej, zajęciowej i z zakresu mowy-języka oraz innych terapiach behawioralnych i jaki spędziły korzystając z usług edukacyjnych podlegały ocenie co trzy miesiące od początku badania do 12 miesięcy po badaniu za pośrednictwem zorganizowanego wywiadu rodzicielskiego intervention history interview.
Metody statystyczne
Analiza w głównej mierze opierała się na metodach opisowych, przy czym na początku umieszczono streszczenie wyjściowych cech kohorty. W celu zobrazowania rozmieszczenia w czasie trwałych miar wyników przygotowano wykresy pudełkowe. Częstotliwość porządkowych miar wyników w każdym punkcie czasowym została oznaczona na wykresach słupkowych. Istotność statystyczną zmiany wyników trwałych i porządkowych oceniono za pomocą testu rangowanych znaków Wilcoxona z wyjątkiem kwestionariusza PDDBI, który opracowano wykorzystując model efektów stałych liniowej funkcji sklejanej z węzłem w punkcie 3 miesiące. Model ten wybrano spośród innych modeli wzdłużnych efektów stałych i losowych z wykorzystaniem kryterium informacyjnego Akaike. Wyniki badania EGT poddano analizie stosując uogólnione równania estymacyjne (ang. Generalized Estimating Equations, GEE) wraz z powiązaniem logitowym, dwumianowym rozkładem zmiennej losowej i zamienną bądź nieusystematyzowaną korelacją roboczą. Związek między wiekiem na początku badania, ilorazem inteligencji niewerbalnej i dawką komórek w infuzji a zmianą w czasie zbadano każdorazowo stosując korelację Spearmana (r s). Do badania zakwalifikowano zbyt małą liczbę dziewczynek, aby zbadać struktury zmiany ze względu na płeć. I wreszcie oceniliśmy możliwość wystąpienia wyników fałszywie pozytywnych (ang. False Discovery Rate, FDR) stosując względem zaobserwowanych rezultatów procedurę Benjamini i Hochberga dla okresów od pierwszej wizyty do 6 miesięcy i od 6 do 12 miesięcy po badaniu.
Wyniki
Uczestnicy
Do badania zakwalifikowano dwudziestu pięciu uczestników (21 chłopców, 4 dziewczynki), w większości białych (n = 22, 1 Azjata, dwoje rasy mieszanej), których średnia wieku wynosiła 4,62 lata (przedział wiekowy 2,26-5,97), zaś średni iloraz inteligencji niewerbalnej wynosił 65 (przedział 22 – 123). Średni wynik porównawczy uczestników w protokole ADOS wyniósł na początku badania 8,0 (przedział 6-10), przy czym 72% uczestników wykazywało umiarkowanie ciężkie lub ciężkie objawy ASD (tabela 1). Wszyscy uczestnicy wypełnili kwestionariusze oceny podczas pierwszej wizyty i po upływie 6 miesięcy. Trzech uczestników nie wypełniło kwestionariuszy po upływie 12 miesięcy.
Tabela 1
Charakterystyka pacjentów i jednostek autologicznej krwi pępowinowej na początku badania (n =25)
Charakterystyka pacjentów
Płeć, liczba (%)
Dziewczynki 4 (16,0%)
Chłopcy 21 (84,0%)
Wiek, lata, średnia (przedział)
4,62 (2,26-5,97)
Rasa, liczba (%)
Biała 22 (88%)
Inna 3 (12%)
Pochodzenie etniczne, liczba (%)
Latynoamerykańskie 2 (8%)
Nielatynoamerykańskie 23 (92%)
Ocena nasilenia objawów ASD w protokole ADOS, średnia (przedział) 8 (6-10)
Iloraz inteligencji niewerbalnej, średnia (przedział) 65 (22-123)
CGI-S, liczba (%)
Objawy prawie niezauważalne 4 (16,0%)
Objawy ASD o umiarkowanym nasileniu 3 (12,0%)
Objawy ASD umiarkowanie ciężkie 10 (40,0%)
Ciężkie objawy ASD 8 (32,0%)
Charakterystyka krwi pępowinowej, średnia (przedział)
Całkowita liczba komórek poddanych infuzji, x108 4,42 (1,53-12,28)
Dawka do infuzji na komórkę, x106/kg 25,80 (9,97-80,80)
Dawka wlanych żywotnych komórek CD34, x105/kg 0,3 (0,1-4,2)
Dawka wlanych CFUs,/kg 1.122,50 (85,50-4.620,00)
Skróty: ADOS, protokół obserwacji do diagnozowania zaburzeń ze spektrum autyzmu, ang. Autism Diagnostic Observation Schedule; ASD, zaburzenia ze spektrum autyzmu, ang. autism spectrum disorder; CFU, jednostki tworzące kolonię, ang. colony-forming units; CGI-S, skala ogólnego wrażenia klinicznego – ogólnej oceny ciężkości choroby, ang. Clinical Global Impression-Severity; TNCC, całkowita liczba komórek jądrzastych, ang. total nucleated cell count.
Infuzja krwi pępowinowej
Jednostki autologicznej krwi pępowinowej zostały pozyskane z dwóch amerykańskich rodzinnych banków krwi pępowinowej i z jednego banku publicznego (n =1). Wszystkie przechowywane były w dwukomorowych workach na krew. W celu uzyskania dawki docelowej 1-5 x 107 TNCC/kg, całą jednostkę krwi wykorzystano u sześciu uczestników badania. W przypadku 19 uczestników rozmrożono i wykorzystano do infuzji jednostkę krwi pępowinowej z komory o objętości 80%, zaś pozostałe 20% zachowano w stanie krwioprezerwacyjnym i oddano do przechowania, za zgodą rodziców, do ewentualnego wykorzystania w przyszłości. U wszystkich pacjentów wykonano infuzję krwi pępowinowej. Charakterystykę rozmrożonego produktu krwi podanego pacjentom przedstawiono w tabeli 1. Średnia dawka wlanych TNCC i żywotnych komórek CD34 wlanych wynosiła odpowiednio 2,6 x 107/kg (przedział 1-8 x 107) i 0,3 x 105/kg (przedział 0,1-4,2 x 105). Średnia dawka wlanych CFUs wynosiła 1225,5/kg (przedział 85,5-4620). Pomimo że kryteria dawkowania zastosowane w omawianym badaniu były zgodne z naszymi poprzednimi badaniami, w których wykorzystano jednostki krwi pępowinowej przechowywane w prywatnych bankach, wartości TNCC, CD34 i CFUs są niższe niż stosowane wcześniej[18]. Mimo ujemnych wyników posiewów przed krwioprezerwacją zgłoszonych przez bank, na jednej jednostce krwi wyhodowano koagulozo-ujemny szczep bakterii rodzaju staphylococcus [gronkowca] z próbki krwi po rozmrożeniu na Uniwersytecie Duke.
Bezpieczeństwo
Głównym punktem końcowym omawianego otwartego badania klinicznego pierwszej fazy było bezpieczeństwo (tabela 1). Jak uprzednio ustaliliśmy w przeprowadzonym przez nas wcześniejszym badaniu bezpieczeństwa infuzji krwi pępowinowej u dzieci z zaburzeniami neurologicznymi[18], infuzja krwi pępowinowej jest dobrze tolerowana. Nie zgłoszono żadnych poważnych zdarzeń niepożądanych u żadnego z uczestników. Całkowitą liczbę 92 zdarzeń niepożądanych zgłoszono u 23 uczestników (tabela 1) ze średnią trzech wydarzeń na jednego uczestnika (przedział: 1-15). Wszystkie zdarzenia sklasyfikowane zostały jako łagodne (71 wydarzeń) lub umiarkowane (21 wydarzeń). Dwanaście zdarzeń (13%) uznano za powiązane z infuzją, przy czym najczęściej występowała reakcja alergiczna objawiająca się pokrzywką i/lub kaszlem występującymi w dniu infuzji (5 wydarzeń u 4 pacjentów; wszystkie łagodne; 2 wymagające dożylnego podania dodatkowej dawki Benadrylu). Do najpowszechniejszych zdarzeń niepożądanych niezwiązanych z infuzją należały: pobudzenie, zmiany skórne i typowe infekcje wieku dziecięcego zgłaszane w okresie od 2 dni do roku po infuzji. U żadnego pacjenta nie zaobserwowano zakażeń krwi związanych z infuzją ani żadnych innych poważnych infekcji.
Wykres 1

https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5442708/figure/sct312144-fig-0001/
Częstotliwość zdarzeń niepożądanych. Liczbę pacjentów zgłaszających zdarzenie podano w nawiasach.
Testy behawioralne
Zbadaliśmy także możliwość zastosowania i opisaliśmy wyniki kilku testów stosowanych powszechnie do oceny wyników behawioralnych dzieci z ASD. Ocenie poddano dużą liczbę testów rodzicielskich i klinicznych. Wyniki behawioralne korelowały z wyjściowym IQ, ale nie z wiekiem ani dawką komórek. Zmiany zachowania nie korelowały również z liczbą godzin interwencji behawioralnej, terapii z zakresu mowy-języka, terapii zajęciowej ani z liczbą godzin zajęć edukacyjnych, w których dziecko uczestniczyło w trakcie badania. Wszystkie wybrane testy, pierwszorzędne i kluczowe drugorzędne behawioralne punkty końcowe dotyczące zachowania (VABS-II, CGI-S, CGI-I, PDDBI, EOWPBT) oraz biomarker EGT wykazały poprawę i zostały opisane poniżej.
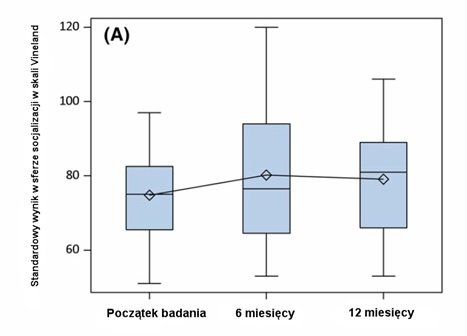
VABS-II to kwestionariusz rodzicielski oceniający zachowania społeczne, komunikacyjne i adaptacyjne. Wykres 2 przedstawia rozmieszczenie wyników standardowych wszystkich pacjentów (ramka A) oraz wyników stratyfikowanych na podstawie IQ (ramka B) uzyskanych w skali VABS-II w części dotyczącej socjalizacji przez 24 uczestników, którzy przeszli ocenę we wszystkich trzech punktach czasowych. Istotny statystycznie wzrost wyniku standardowego zaobserwowano w okresie od początku badania do 6 miesięcy. Zmiana ta była stabilna w okresie od 6 do 12 miesięcy. Pozostawała w korelacji dodatniej z IQ niewerbalnym w obszarach zachowań społecznych (rs = .57.95% przedział ufności [ang. confidence interval, CI]: 0,20-0,79, p = .004) i zachowań adaptacyjnych (r s = .42.95% CI: 0,01-0,70, p = .04), ale nie w obszarze zachowań komunikacyjnych (r s = .22.95% CI: -0,21 do 0,57, p = .331).
WYKRES 2 (A)
WYKRES 2 (B)
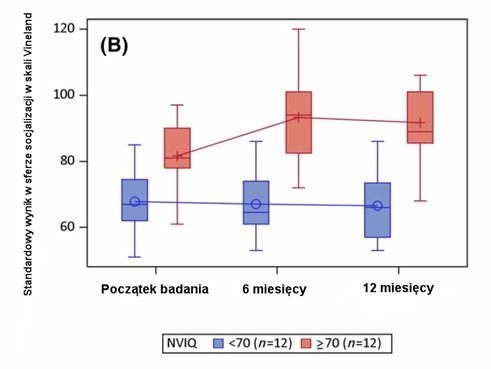
Wykres 2: Standardowy wynik w obszarze zachowań społecznych uzyskany w skali zachowań adaptacyjnych (VABS-II). (A): Rozmieszczenie w czasie standardowych wyników w obszarze zachowań społecznych uzyskanych w skali VABS-II przez wszystkich uczestników. (B): Rozmieszczenie standardowych wyników w obszarze zachowań społecznych uzyskanych w skali VABS-II stratyfikowanych na podstawie ilorazu inteligencji niewerbalnej.
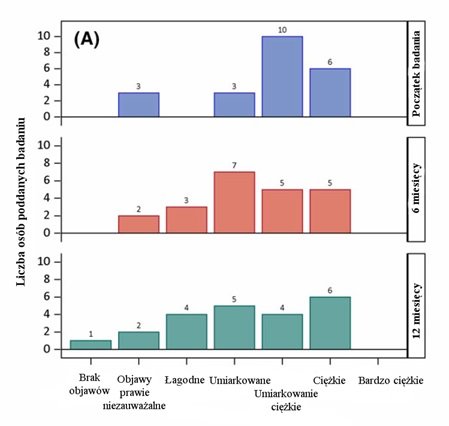
CGI-S i –I to skale kliniczne stosowane do oceny stopnia i zmiany nasilenia najważniejszych objawów ASD w czasie. Wykres 3 przedstawia rozmieszczenie wyników w skalach CGI-S (ramka A) i CGI-I (ramka B) 22 uczestników spełniających warunki poddania ocenie we wszystkich punktach czasowych.
Na początku badania objawy większości uczestników zostały sklasyfikowane w skali CGI-S jako umiarkowanie ciężkie (43,5%) lub ciężkie (26,1%), zaś u pozostałych uczestników stwierdzono objawy ASD umiarkowane lub prawie niezauważalne (13,6% każdy). Po upływie 6 miesięcy odsetek uczestników z umiarkowanie ciężkimi i ciężkimi objawami zmniejszył się (22,7% każdy), przy czym objawy pozostałych uczestników zostały sklasyfikowane jako umiarkowane (31,8%), łagodne (13,6%) lub prawie niezauważalne (9,1%).
Wykres 3 przedstawia rozmieszczenie wyników w skali CGI-I po upływie 6 i 12 miesięcy. Poprawa mierzona w każdym z tych punktów czasowych jest podana względem początku badania. Po upływie 6 miesięcy u 9 uczestników (40,9%) nie stwierdzono żadnej zmiany, podczas gdy u 2 (9,1%) zaobserwowano minimalną poprawę, u 8 (36,4%) znaczącą poprawę, zaś u 3 (13,6%) bardzo znaczącą poprawę (p< .001). W skali CGI-I uzyskano podobny wynik (p = .001), chociaż objawy 2 uczestników (13,6%) sklasyfikowano jako minimalnie gorsze niż na początku badania, podczas gdy żaden z uczestników nie znalazł się w tej kategorii w czasie dokonywania oceny po 6 miesiącach. Skala CGI-I po upływie 12 miesięcy została skojarzona z ilorazem inteligencji niewerbalnej, ale nie z wiekiem ani dawką wlaną na komórki (nie pokazano).
WYKRES 3 (A)
WYKRES 3 (B)
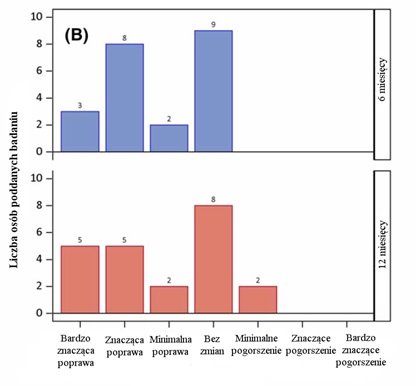
Wykres 3: Skala ogólnego wrażenia klinicznego (GCI). (A): Skala ogólnego wrażenia klinicznego – ogólnej oceny ciężkości choroby w czasie. (B): Skala ogólnego wrażenia klinicznego – ogólnej oceny poprawy klinicznej względem początku badania zgodnie z oceną po upływie 6 i 12 miesięcy od pierwszej wizyty.
Złożona ocena na skali T całościowych zaburzeń rozwojowych z inwentarza zachowań (ang. PDDBI) to kwestionariusz rodzicielski oceniający objawy ASD. Zastosowano go na początku badania oraz po upływie 3, 6, 9 i 12 miesięcy (tabela 2). Złożona ocena zaburzeń ze spektrum autyzmu na skali T zmniejszyła się w czasie, co wskazuje na poprawę objawów ASD. Zmiany nastąpiły głównie w okresie od początku badania do 3 miesięcy, przy czym przewidywany średni spadek wyniósł 7,52 punkty (95% CI: -12,38, -2,67; p = .004). W okresie od 3 do 12 miesięcy po badaniu nie wystąpiły istotne zmiany (średnia: 0,72,95% CI: -1,14, 2,57; p = .43).
Tabela 2
Zestawienie wyników behawioralnych
Od początku badania Od 6 do 12
do 6 miesięcy miesięcy
| Miara wyników | Liczba zbadanych pacjentów | Zmiana od oceny wyjściowej średnia (przedział) | Wartość p | Zmiana od oceny wyjściowej średnia (przedział) | Wartość pa |
| Standardowy wynik uzyskany w skali VABS w części dotyczącej socjalizacji | 24 | 2,0 (-8.30) | .016 | 0 (-19.9) | .602 |
| Standardowy wynik uzyskany w skali VABS w części dotyczącej komunikacji | 24 | 4,5 (-8.20) | .002 | 0,0 (-13.13) | .459 |
| Standardowy złożony wynik uzyskany w skali VABS w części dotyczącej zachowań adaptacyjnych | 24 | 3 (-3.24) | .007 | 0 (-12.8) | .687 |
| Standardowy wynik uzyskany w skali VABS w części dotyczącej umiejętności motorycznych | 24 | 0 (-10.7) | .788 | 0 (-14.16) | .991
|
| Standardowy wynik uzyskany w skali VABS w części dotyczącej codziennych umiejętności | 24 | 1 (-9.34) | .457 | 0 (-16.16) | .999 |
| Bezwzględna liczba punktów uzyskanych w teście słownikowym EOWPVT | 22 | 4 (-1.24) | .001 | 5,5
(-12.16) |
.001 |
| Złożona ocena na skali T całościowych zaburzeń rozwojowych z inwentarza zachowań (ang. PDDBI)b | 25 | 7,52 (-12,38,
-2,67) |
.004 | 0,72 (-1,14, 2,57) | .430 |
a wartości p pochodzą z testu rangowanych znaków Wilcoxona lub modelu sklejanego inwentarza zachowań PDD-BI.
b PDD-BI przeprowadzono na początku badania oraz po upływie 3 i 6 miesięcy. Zmiany od oceny wyjściowej stanowią średnią przewidywaną (i 95-procentowy przedział ufności) pochodzącą z modelu liniowej funkcji sklejanej z węzłem w punkcie 3 miesiące.
Zastosowane skróty: EOWPVT, test słownikowy Expressive One-Word Picture Vocabulary Test-4; VABS, skala zachowań adaptacyjnych Vineland-II; PDDBI, inwentarz zachowań typowych dla całościowych zaburzeń rozwojowych.
Test słownikowy EOWPVT to ocena kliniczna umiejętności dopasowania słowa mówionego do ilustracji. Wyniki surowe testu EOWPVT poprawiły się u 57% pacjentów w ciągu 6 miesięcy od pierwszej wizyty i u 68% pacjentów w okresie od 6 do 12 miesięcy (tabela 2). Zmiana wyników surowych testu EOWPVT była związana z ilorazem inteligencji niewerbalnej (pierwsza wizyta do 6 miesięcy: r S = .59.95% CI: 0,23, 0,80, p = .002; 6-12 miesięcy: r S = .55.95% CI: 0,15, 0,78; p = .009), ale nie z wiekiem ani dawką wlanych komórek (p ˃.05 dla obu).
Badanie EGT jest badaniem skomputeryzowanym, w którym komputer śledzi ruchy gałki ocznej uczestników, podczas gdy osoba badana ogląda na monitorze naturalistyczne, dynamiczne bodźce społeczne (aktorkę inicjującą wspólne pole uwagi) w otoczeniu rozmaitych bodźców niespołecznych. Zmierzono uwagę skierowaną na cztery cele (oczy, usta, twarz i górna część ciała aktorki) i do każdego z tych celów dopasowano osobne modele GEE. Każdy model uwzględniał 21 uczestników, których poddano ocenie podczas pierwszej wizyty oraz po upływie 6 i 12 miesięcy. Modele te wykazały 20-procentowy wzrost szansy patrzenia na oczy aktorki w czasie (OR [ang. odds ratio]/iloraz szans = 1,20, 95% CI: 1,00, 1.43, p = .048). Nie stwierdzono istotnych zmian w ruchu gałki ocznej podczas patrzenia na pozostałe trzy cele (tabela 3). Analiza związku między śledzeniem ruchu gałki ocznej a standardowym wynikiem uzyskanym w skali VABS-II w obszarze dotyczącym socjalizacji wykazała, że 7-punktowa zmiana standardowego wyniku w skali VABS-II w obszarze socjalizacji wiązała się z 14-procentowym wzrostem szansy patrzenia na aktorkę (OR/iloraz szans = 1,14, 95% CI: 1,07, 1,21; p < .001).
Tabela 3
Zestawienie badań EGT (n = 21)
| Cel | Iloraz szans (95% CI)a | Wartość p |
| Oczy | 1,20 (1,00, 1,43) | .048 |
| Aktorka | 1,02 (0,92, 1,12) | .716 |
| Usta | 0,93 (0,81, 1,06) | .270 |
| Twarz | 1,02 (0,91, 1,14) | .800 |
a Ilorazy szans oszacowano z zastosowaniem uogólnionych równań szacunkowych (jeden model dla każdego celu) i odzwierciedlają one średnią tendencję w kohorcie pomiędzy następującymi kolejno 6-miesięcznymi okresami obserwacji po zakończeniu badania (od pierwszej wizyty do 6 miesięcy i od 6 do 12 miesięcy).
Dostosowanie badania do uwzględnionych w nim licznych testów
Biorąc pod uwagę, że badanie to obejmuje znaczną liczbę testów behawioralnych, sprawdziliśmy możliwość uzyskania wyników fałszywie pozytywnych wśród dziewięciu behawioralnych miar wyników stosując procedurę Benjaminiego-Hochberga kontroli FDR oddzielnie dla pierwszego i drugiego 6-miesięcznego okresu obserwacji po badaniu (tabela 4). Wszystkie miary wyników, które wykazały istotne rezultaty w ciągu pierwszych 6 miesięcy okresu obserwacji pozostały statystycznie istotne po zastosowaniu procedury Benjaminiego-Hochberga kontroli FDR wobec wartości p. W okresie od 6 do 12 miesięcy test słownikowy EOWPVT oraz skala CGI-I pozostały statystycznie istotne po zastosowaniu procedury Benjaminiego-Hochberga.
Tabela 4
Surowe i skorygowane wartości p w testach badających hipotezę zerową braku zmiany w czasie w wynikach behawioralnych
Od początku badania Od 6 do 12
do 6 miesięcy miesięcy
| Miara wyników | Surowa wartość p | Wartość p po zastosowaniu procedury Benjaminiego-Hochberga kontroli FDR | Surowa wartość p | Wartość p po zastosowaniu procedury Benjaminiego-Hochberga kontroli FDR |
| Wynik surowy testu słownikowego EOWPVT | .0001 | .0009 | .0011 | .0059 |
| CGI-I | .0010 | .0045 | .0013 | .0059 |
| Standardowa ocena uzyskana w skali VABS w części dotyczącej komunikacji | .0020 | .0060 | .4590 | .8262 |
| Złożona ocena na skali T całościowych zaburzeń rozwojowych z inwentarza zachowań (ang. PDDBI)a | .0040 | .0090 | .4300 | .8262 |
| Złożona ocena uzyskana w skali VABS w części dotyczącej zachowań adaptacyjnych | .0070 | .0126 | .6870 | .8833 |
| Standardowy wynik uzyskany w sferze socjalizacji według skali VABS | .0160 | .0240 | .6020 | .8833 |
| CGI-S | .0220 | .0283 | .3750 | .8262 |
| Standardowy wynik uzyskany w sferze codziennych umiejętności według skali VABS | .4600 | .5175 | .9999 | .9999 |
| Standardowy wynik uzyskany w sferze umiejętności motorycznych według skali VABS | .7880 | .7880 | .9907 | .9999 |
a wartości p dla PDDBI dotyczą okresów od pierwszej wizyty do 3 miesięcy i od 3 do 12 miesięcy.
Zastosowane skróty: CGI-I/S, skala ogólnego wrażenia klinicznego – poprawa/ciężkość choroby; EOWPVT, test słownikowy Expressive One-Word Picture Vocabulary Test-4; FDR, wyniki fałszywie dodatnie; PDDBI, inwentarz zachowań typowych dla całościowych zaburzeń rozwoju; VABS, skala zachowań adaptacyjnych Vineland-II.
Omówienie
W omawianym badaniu klinicznym pierwszej fazy oceniliśmy bezpieczeństwo i możliwość wykonania pojedynczej infuzji dożylnej autologicznej krwi pępowinowej u małych dzieci z ASD. Opisaliśmy także zmiany rozmaitych miar wyników behawioralnych i funkcjonalnych, aby ustalić które będą najbardziej odpowiednie do zastosowania jako punkty końcowe w przyszłych badaniach nad terapią komórkową. Ocena zdarzeń niepożądanych w okresie 12 miesięcy po infuzji wykazała, że wlew krwi pępowinowej był bezpieczny i dobrze tolerowany. Wszystkie powiązane zdarzenia uznano za oczekiwane i zaradzono im bez żadnych następstw. Do najbardziej powszechnych niezwiązanych zdarzeń niepożądanych należały: rozdrażnienie, zmiany skórne oraz infekcje typowe dla wieku dziecięcego. W szczególności rozdrażnienie nie było powszechnym skutkiem ubocznym w naszych poprzednich badaniach dotyczących infuzji autologicznej krwi pępowinowej u dzieci z innymi nabytymi chorobami neurologicznym i z tego powodu może być charakterystyczne dla dzieci chorych na ASD. W omawianym badaniu uczestnicy zostali poddani sedacji do badania rezonansem magnetycznym, po którym nastąpiła infuzja krwi pępowinowej. Zwiększona częstotliwość występowania rozdrażnienia może zatem odzwierciedlać wyzwania, jakie dla dziecka z ASD wiązały się z wybudzeniem się z sedacji oraz podłączeniem wenflonu i pulsoksymetru i jako takie może się ono wiązać z ich chorobą podstawową.
W omawianym badaniu stwierdzono istotną poprawę zachowania w szerokim zakresie miar wyników. Można wśród nich wymienić poprawę, na którą wskazali rodzice w testach rodzicielskich, takich jak PDDBI i VABS-II w częściach dotyczących socjalizacji, komunikacji i zachowań adaptacyjnych, jak również klinicyści za pomocą narzędzi do oceny klinicznej jak CGI-S, CGI-I, test słownikowy EOWPVT oraz obiektywne badanie EGT. Większość zaobserwowanych zmian behawioralnych nastąpiła w ciągu pierwszych 6 miesięcy i utrzymała się między 6 a 12 miesiącem po infuzji. Nie podlega dyskusji ustalenie, że iloraz inteligencji niewerbalnej dzieci był skorelowany ze zmianą dla większości miar wyników, przy czym wyższy iloraz inteligencji niewerbalnej wiązał się z większą poprawą zachowania.
Co istotne, większość uczestników omawianego badania należała do rasy białej odzwierciedlając grupę demograficzną, co do której prawdopodobne jest, że posiada środki i zdecyduje się pozostawić krew pępowinową dziecka w prywatnym banku. Jednakże, jako że na ASD chorują dzieci ze wszystkich środowisk demograficznych, jeżeli terapia krwią pępowinową okaże się skuteczna, dostęp będzie ograniczony do rodzin dysponujących środkami finansowymi umożliwiającymi skorzystanie z banków prywatnych, o ile wykorzystywane będą jedynie komórki autologiczne. Zgodnie z tym nasze kolejne badanie poświęcone będzie sprawdzeniu najlepszego dostępnego dawcy (autologicznego bądź alogenicznego) w porównaniu do placebo, aby stworzyć podstawy do zwiększenia dostępu do tej metody leczenia dla wszystkich dzieci dotkniętych chorobą, zakładając, że okaże się ona skuteczna.
Mimo że przedstawione powyżej wyniki dają pewne nadzieje związane ze stosowaniem w przyszłości terapii wykorzystujących krew pępowinową u chorych na ASD, ważne jest, by zwrócić uwagę na ograniczenia omawianego badania. Jako że mamy do czynienia z badaniem niekontrolowanym otwartym, niemożliwe jest ustalenia czy zaobserwowane zmiany behawioralne stanowiły efekt leczenia czy odzwierciedlały naturalny tok rozwoju przed osiągnięciem wieku szkolnego. Przeprowadzone niedawno badanie podłużne szwedzkich dzieci z ASD w wieku od 1,5 do 3 lat wykazało średnią poprawę 3,0 punktów w sferze komunikacji według skali VABS i 1,0 punktu w sferze socjalizacji według skali VABS w ciągu 2 lat[38] w porównaniu do odpowiednio 4,5 punktów i 2,0 punktów w ciągu 6 miesięcy u pacjentów leczonych krwią pępowinową w omawianym badaniu. Jednak potencjalne uwarunkowania kulturowe, a także różny czas dokonywania oceny utrudniają bezpośrednie porównanie tych dwóch grup. Co więcej, mała liczebność próby w przedmiotowym badaniu powoduje, że trudne staje się również dokonanie pełnej oceny udziału zmiennych zakłócających. Chociaż nie stwierdziliśmy korelacji między zmianami behawioralnymi a wiekiem, liczba interwencji behawioralnych lub dawka wlanych komórek, nieznaczna wielkość próby, jak również ograniczone przedziały wiekowe i dawkowania mogą ograniczać możliwość wykrycia takich powiązań. Infuzja autologicznej krwi pępowinowej.
Każda opisana powyżej miara wyników wykazała podatność na zmiany, udowadniając potencjalną użyteczność w badaniach na większą skalę. Oprócz tego ścieranie się spowodowane niezgodnością tych miar było minimalne, co wskazuje, że miary te można stosować u dzieci z ASD w tym przedziale wiekowym. Wykorzystując wyniki omawianego badania jako „drogowskaz”, wybraliśmy standardowy wynik uzyskany w skali VABS w obszarze socjalizacji jako główną miarę wyników w naszym kolejnym badaniu, którym kierować będą wyszkoleni klinicyści, aby zredukować efekty oczekiwań rodziców. Wynik ten zapewnia zwalidowaną miarę podstawowych zachowań społecznych właściwych dla autyzmu, wykazał podatność na zmiany w okresie 6 miesięcy w obecnym badaniu i można go zastosować w badaniach klinicznych na większą skalę. Zgodnie z ostatnim projektem zawierającym wytyczne dotyczące planowania badań klinicznych nad autyzmem opracowanym przez Europejską Agencję Leków[39], uznajemy, że pojedyncza terapia nie musi prowadzić do poprawy wszystkich objawów autyzmu i że z tego powodu całkowita poprawa funkcjonalna stanowi istotny komponent oceny skuteczności w autyzmie. W związku z tym w naszym kolejnym badaniu – klinicznym badaniu randomizowanym drugiej fazy z podwójnie ślepą próbą opracowanym w celu dokonania formalnej oceny skuteczności infuzji krwi pępowinowej w poprawie podstawowych objawów ASD – uwzględniliśmy także ocenianą przez klinicystów skalę CGI i dodatkowe testy jako drugorzędne punkty końcowe.
Wnioski
W otwartym badaniu pierwszej fazy wykazaliśmy, że dożylna infuzja autologicznej krwi pępowinowej u małych dzieci z ASD jest bezpieczna i możliwa do wykonania. Opisujemy znaczącą poprawę zachowania zaobserwowaną w ciągu pierwszych 6 miesięcy po infuzji i utrzymującą się do 12 miesięcy. Wyższy wyjściowy iloraz inteligencji niewerbalnej związany był z większym zakresem poprawy. Zidentyfikowaliśmy miary wyników, które są realne, podatne na zmiany i dostosowane do poziomu rozwoju dzieci, a zatem nadają się do wykorzystania w przyszłych badaniach klinicznych mających na celu określenie skuteczności terapii krwią pępowinową w leczeniu małych dzieci z ASD.
Zobacz na: Szczepionki nie powodują autyzmu – Marcella Piper-Terry
Prawda o komórkach macierzystych – wywiad z dr Theresą Deisher
Wykrycie retrowirusa zakaźnego XMRV w komórkach krwi pacjentów z zespołem chronicznego zmęczenia – dr Judy A. Mikovits i inni.
Czy chińscy naukowcy odkryli brakujący fragment układanki autyzmu? – J.B. Handley
Niebezpieczeństwa nadmiernych szczepień w trakcie rozwoju mózgu. – dr Russell L. Blaylock
Dieta w Zespole Psychologiczno – Jelitowym (GAPS) w leczeniu Autyzmu i Zespołu Aspergera – dr Natasha Campbell-McBride
Synergiczne, toksyczne działanie glifosatu i aluminium – Dr Stephanie Seneff
Bibliografia:
- Baio J. Prevalence of autism spectrum disorder among children aged 8 years—Autism and developmental disabilities monitoring network, 11 sites, United States, 2010. MMWR Surveill Summ 2014;63:1–21.
- Buescher AS, Cidav Z, Knapp M et al. Costs of autism spectrum disorders in the United Kingdom and the United States. JAMA Pediatr 2014;168:721–728.
- Dawson G, Rogers S, Munson J et al. Randomized, controlled trial of an intervention for toddlers with autism: The early start denver model. Pediatrics 2010;125:e17–e23.
- de la Torre‐Ubieta L, Won H, Stein JL et al. Advancing the understanding of autism disease mechanisms through genetics. Nat Med 2016;22:345–361.
- Mandy W, Lai MC. Annual Research Review: The role of the environment in the developmental psychopathology of autism spectrum condition. J Child Psychol Psychiatry 2016;57:271–292.
- Sahin M, Sur M. Genes, circuits, and precision therapies for autism and related neurodevelopmental disorders. Science 2015;350 http://science.sciencemag.org/content/350/6263/aab3897.long
- Gao R, Penzes P. Common mechanisms of excitatory and inhibitory imbalance in schizophrenia and autism spectrum disorders. Curr Mol Med 2015;15:146–167.
- Volk L, Chiu SL, Sharma K et al. Glutamate synapses in human cognitive disorders. Annu Rev Neurosci 2015;38:127–149.
- Wolff JJ, Gu H, Gerig G et al. Differences in white matter fiber tract development present from 6 to 24 months in infants with autism. Am J Psychiatry 2012;169:589–600.
- Young AMH, Chakrabarti B, Roberts D et al. From molecules to neural morphology: Understanding neuroinflammation in autism spectrum condition. Mol Autism 2016;7:1–8.
- Voineagu I, Wang X, Johnston P et al. Transcriptomic analysis of autistic brain reveals convergent molecular pathology. Nature 2011;474:380–384.
- Braunschweig D, Krakowiak P, Duncanson P et al. Autism‐specific maternal autoantibodies recognize critical proteins in developing brain. Transl Psychiatry 2013;3:e277.
- Vargas DL, Nascimbene C, Krishnan C et al. Neuroglial activation and neuroinflammation in the brain of patients with autism. Ann Neurol 2005;57:67–81.
- Morgan JT, Chana G, Pardo CA et al. Microglial activation and increased microglial density observed in the dorsolateral prefrontal cortex in autism. Biol Psychiatry 2010;68:368–376.
- Suzuki K, Sugihara G, Ouchi Y et al. Microglial activation in young adults with autism spectrum disorder. JAMA Psychiatry 2013;70:49–58.
- Bachstetter AD, Pabon MM, Cole MJ et al. Peripheral injection of human umbilical cord blood stimulates neurogenesis in the aged rat brain. BMC Neurosci 2008;9:22.
- Shahaduzzaman M, Golden JE, Green S et al. A single administration of human umbilical cord blood T cells produces long‐lasting effects in the aging hippocampus. Age (Dordr) 2013;35:2071–2087.
- Sun J, Allison J, McLaughlin C et al. Differences in quality between privately and publicly banked umbilical cord blood units: A pilot study of autologous cord blood infusion in children with acquired neurologic disorders. Transfusion 2010;50:1980–1987.
- Cotten CM, Murtha AP, Goldberg RN et al. Feasibility of autologous cord blood cells for infants with hypoxic‐ischemic encephalopathy. J Pediatr 2014;164:973–979.e1.
- Sun JM, Grant GA, McLaughlin C et al. Repeated autologous umbilical cord blood infusions are feasible and had no acute safety issues in young babies with congenital hydrocephalus. Pediatr Res 2015;78:712–716.
- Diagnostic and Statistical Manual of Mental Disorders: DSM‐5. Washington, D.C: American Psychiatric Association, 2013.
- Lord C, Rutter M, DiLavore P et al. Autism Diagnostic Observation Schedule (ADOS‐2). 2nd ed. Torrance, CA: Western Psychological Services, 2012.
- Rutter M, Le Couteur A, Lord C et al. Autism Diagnostic Interview‐Revised (ADI‐R). Torrance, CA: Western Psychological Services, 2005.
- Roid GH. Stanford‐Binet Intelligence Scales for Early Childhood (Early SB5). Fifth ed. Itasca, IL: Riverside Publishing, 2003.
- Mullen E. Mullen Scales of Early Learning. AGS ed. Bloomington, MN: NCS Pearson Inc, 1995.
- Shoulars K, Noldner P, Troy JD et al. Development and validation of a rapid, aldehyde dehydrogenase bright‐based cord blood potency assay. Blood 2016;127:2346–2354.
- Rubinstein P, Dobrila L, Rosenfield RE et al. Processing and cryopreservation of placental/umbilical cord blood for unrelated bone marrow reconstitution. Proc Natl Acad Sci USA 1995;92:10119–10122.
- Sparrow S, Cicchetti D, Balla D. Vineland Adaptive Behavior Scales (Vineland II): Parent/Caregiver Rating Form. 2nd ed Minneapolis, MN: NCS Pearson Inc, 2005.
- Balboni G, Tasso A, Muratori F et al. The vineland‐II in preschool children with autism spectrum disorders: An item content category analysis. J Autism Dev Disord 2016;46:42–52.
- Perry A, Flanagan HE, Dunn Geier J et al. Brief report: The vineland adaptive behavior scales in young children with autism spectrum disorders at different cognitive Levels. J Autism Dev Disord 2009;39:1066–1078.
- Yang S, Paynter JM, Gilmore L. Vineland adaptive behavior scales: II profile of young children with autism spectrum disorder. J Autism Dev Disord 2016;46:64–73.
- Sparrow S, Cicchetti DV, Balla DA. Vineland Adaptive Behavior Scales: Survey Forms Manual. 2nd ed Minneapolis, MN: NCS Pearson Inc, 2005.
- Cohen IL, Sudhalter V. PDDBI Parent Rating Form. Lutz, FL: Psychological Assessment Resources Inc; 2005.
- Cohen IL, Sudhalter V. PDD Behavior Inventory Professional Manual. Lutz, FL: Psychological Assessment Resources Inc; 2005.
- Martin NA, Brownell R. Expressive One‐Word Picture Vocabulary Test (EOWPVT‐4). 4th ed. Novato, CA: Academic Therapy Publications Inc, 2011.
- Tobii. Tobii TX300. Danderyd, Sweden: Tobii Technology, 2014.
- Chawarska K, Macari S, Shic F. Context modulates attention to social scenes in toddlers with autism. J Child Psychol Psychiatry 2012;53:903–913.
- Kantzer AK, Fernell E, Westerlund J et al. Young children who screen positive for autism: Stability, change and “comorbidity” over two years. Res Dev Disabil 2016. http://www.sciencedirect.com/science/article/pii/S0891422216302232 Infuzja autologicznej krwi pępowinowej.
- Guideline on the Clinical Development of Medicinal Products for the Treatment of Autism Spectrum Disorder (ASD) ‐ Draft. 2016. Available at http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2016/03/WC500202650.pdf. Last accessed November 14, 2016.