Skuteczność i efektywność szczepionek COVID-19 – bez marketingowej ściemy

Źródło: Lancet Microbe. 2021 Apr 20; COVID-19 vaccine efficacy and effectiveness—the elephant (not) in the room
Około 96 szczepionek przeciw COVID-19 znajduje się na różnych etapach rozwoju klinicznego[1]. Obecnie dysponujemy wynikami pośrednimi czterech badań opublikowanymi w czasopismach naukowych (dotyczących szczepionki mRNA BNT162b2 firmy Pfizer-BioNTech[2], szczepionki mRNA-1273 firmy Moderna i amerykańskiego Narodowego Instytutu Zdrowia US [NIH][3], szczepionki nCov-19 firmy AstraZeneca-Oxford ChAdOx1[4], oraz szczepionki Gamaleya GamCovidVac [Sputnik V][5]), oraz trzema badaniami za pośrednictwem dokumentów informacyjnych amerykańskiej Agencji ds. Żywności i Leków (FDA) (dotyczących szczepionek Pfizer-BioNTech[6], Moderna-NIH[7], oraz Johnson & Johnson [J&J] Ad26. COV2.S)[8]. Co więcej, fragmenty tych wyników były szeroko komunikowane i omawiane w doniesieniach prasowych i mediach, czasami w sposób wprowadzający w błąd[9]. Chociaż uwagę skupiono na skuteczności szczepionek i porównywaniu zmniejszenia liczby przypadków objawowych, pełne zrozumienie skuteczności i efektywności szczepionek jest mniej jednoznaczne, niż mogłoby się wydawać. W zależności od sposobu przedstawienia wielkości efektu, może wyłonić się całkiem inny obraz (rycina; załącznik).
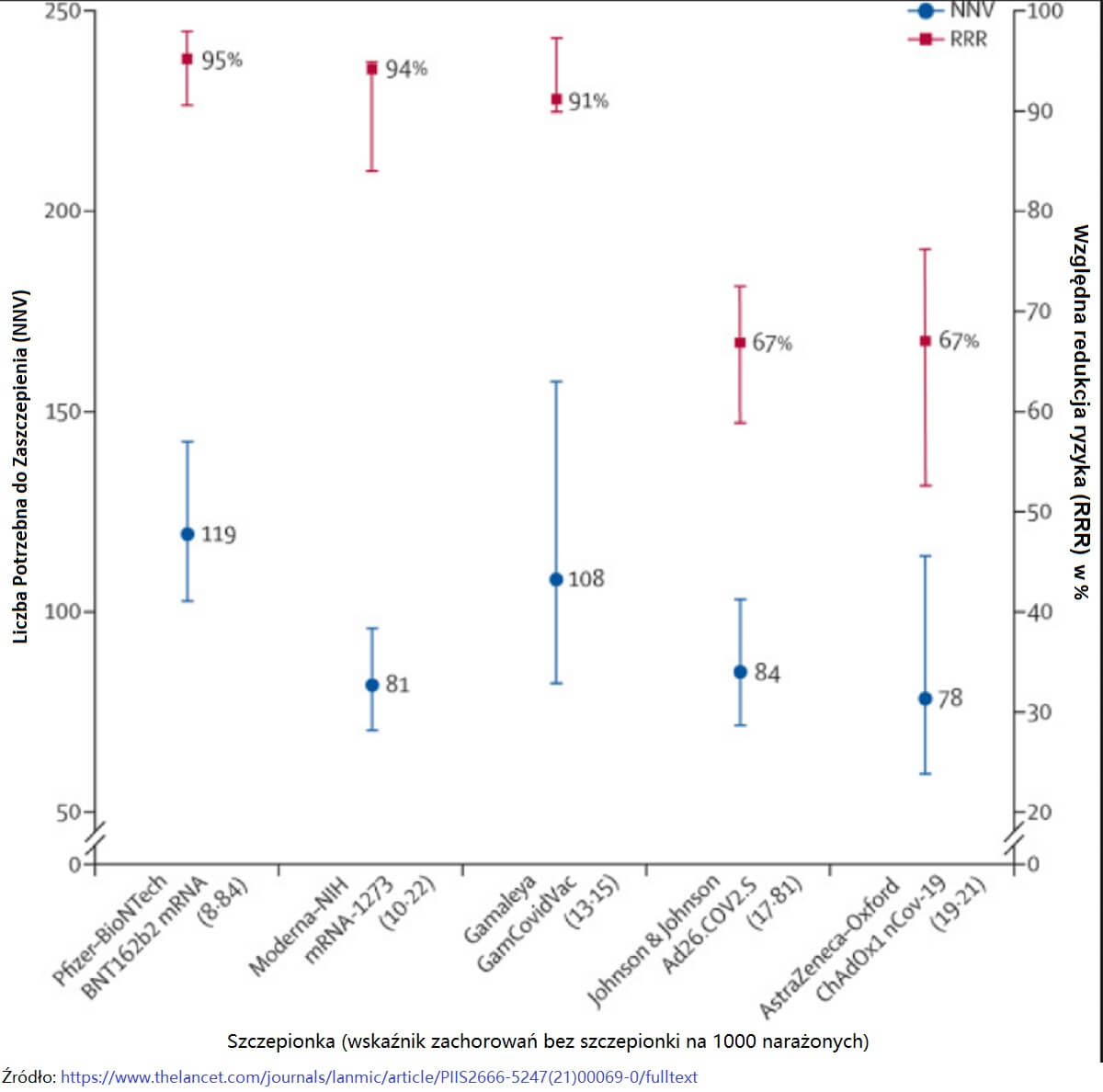
Względna redukcja ryzyka (RRR) i Liczba Potrzebna do Zaszczepienia NNV z 95% CI uszeregowane według częstości występowania zachorowań w grupie nieszczepionej (placebo) dla pięciu szczepionek COVID-19.
Skuteczność i efektywność szczepionek COVID-19
Skuteczność szczepionek jest zwykle podawana jako względne zmniejszenie ryzyka (RRR). Wykorzystuje się tu ryzyko względne (RR) – tzn. stosunek liczby zachorowań w grupie której podano szczepionką z grupą której jej nie podano – co wyraża się jako 1-RR. Ranking według zgłoszonej skuteczności daje względne zmniejszenie ryzyka o 95% w przypadku szczepionek Pfizer-BioNTech, 94% w przypadku szczepionek Moderna-NIH, 90% w przypadku szczepionek Gamaleya, 67% w przypadku szczepionek J&J i 67% w przypadku szczepionek AstraZeneca-Oxford.
Jednak względne zmniejszenie ryzyka (RRR) należy rozpatrywać na tle ryzyka zakażenia i zachorowania na COVID-19, które jest różne w różnych populacjach i w czasie. Chociaż względne zmniejszenie ryzyka (RRR) uwzględnia tylko uczestników, którzy mogliby odnieść korzyści ze szczepionki, bezwzględne zmniejszenie ryzyka (ARR), czyli różnica między częstością zachorowań przy zastosowaniu szczepionki i bez niej, dotyczy całej populacji. Bezwzględne zmniejszenie ryzyka (ARR) jest zwykle ignorowane, ponieważ daje znacznie mniej imponującą wielkość efektu niż względne zmniejszenie ryzyka RRR: 1,3% w przypadku szczepionki AstraZeneca-Oxford, 1,2% w przypadku szczepionki Moderna-NIH, 1,2% w przypadku szczepionki J&J, 0,93% w przypadku szczepionki Gamaleya oraz 0,84% w przypadku szczepionki Pfizer-BioNTech.
Bezwzględne zmniejszenie ryzyka (ARR) służy również do oszacowania skuteczności szczepionki, czyli liczby potrzebnej do zaszczepienia (NNV), aby zapobiec jednemu dodatkowemu przypadkowi zachorowania na COVID-19 jako 1/ARR. Liczba potrzebna do zaszczepienia (NNV) daję nam inną perspektywę: 76 dla szczepionki Moderna-NIH, 78 dla szczepionki AstraZeneca-Oxford, 80 dla szczepionki Gamaleya, 84 dla szczepionki J&J i 117 dla szczepionki Pfizer-BioNTech. Wyjaśnienie leży w połączeniu skuteczności szczepionki i różnego ryzyka związanego z tłem COVID-19 w różnych badaniach: 0-9% dla szczepionki Pfizer-BioNTech, 1% dla szczepionki Gamaleya, 1-4% dla szczepionki Moderna-NIH, 1-8% dla szczepionki J&J i 1-9% dla szczepionki AstraZeneca-Oxford.
Bezwzględne zmniejszenie ryzyka [ARR] i liczba potrzebna do zaszczepienia (NNV) są wrażliwe na ryzyko tła – im wyższe ryzyko, tym wyższa skuteczność – czego przykładem są analizy szczepionki J&J dotyczące przypadków potwierdzonych centralnie w porównaniu ze wszystkimi przypadkami[8]: w przypadku zmiany zarówno licznika, jak i mianownika, względne zmniejszenie ryzyka (RRR) nie ulega zmianie (66-67%), ale wzrost o jedną trzecią liczby zachorowań w grupie nieszczepionej (z 1-8% do 2-4%) przekłada się na spadek liczby potrzebnej do zaszczepienia (NNV) o jedną czwartą (z 84 do 64).
Ze sposobu prowadzenia badań i prezentacji wyników można wyciągnąć wiele wniosków. Przy stosowaniu wyłącznie wartości względnego zmniejszenia ryzyka (RRR), a pomijaniu bezwzględnego zmniejszenia ryzyka (ARR), wprowadza się stronniczość w raportowaniu, co wpływa na interpretację skuteczności szczepionki[10].
Przy przekazywaniu doniesień na temat skuteczności szczepionek, szczególnie w przypadku decyzji dotyczących zdrowia publicznego, takich jak wybór rodzaju szczepionek, które należy zakupić i wdrożyć, ważne jest posiadanie pełnego obrazu tego, co faktycznie pokazują dane, a także upewnienie się, że porównania są oparte na łącznych dowodach, które umieszczają wyniki badań szczepionek w kontekście, a nie tylko patrzą na jedną sumaryczną miarę. Decyzje takie powinny być podejmowane w oparciu o szczegółowe zrozumienie wyników badań, co wymaga dostępu do pełnych zestawów danych oraz niezależnych badań i analiz.
Niestety, porównywanie szczepionek na podstawie obecnie dostępnych danych z badań (wstępnych) jest jeszcze trudniejsze ze względu na rozbieżne protokoły badań, w tym pierwotne punkty końcowe (takie jak to, co jest uważane za przypadek COVID-19 i kiedy jest to oceniane), rodzaje placebo, badane populacje, ryzyko tła COVID-19 podczas badania, czas trwania ekspozycji oraz różne definicje populacji do analiz zarówno w ramach badań, jak i między badaniami, a także definicje punktów końcowych i metod statystycznych dotyczących skuteczności. Co ważne, bez odpowiedzi pozostaje pytanie, czy szczepionka o danej skuteczności w badanej populacji będzie miała taką samą skuteczność w innej populacji o różnych poziomach ryzyka tła COVID-19. Nie jest to pytanie trywialne, ponieważ intensywność transmisji różni się w poszczególnych krajach, na co wpływają takie czynniki, jak interwencje w zakresie zdrowia publicznego i warianty wirusa. Jedynym doniesieniem o skuteczności szczepionki jest izraelska kampania masowych szczepień z użyciem produktu firmy Pfizer-BioNTech. Chociaż projekt i metodologia różnią się radykalnie od badań z randomizacją[2], Dagan i współpracownicy[11] podają względne zmniejszenie ryzyka (RRR) na poziomie 94%, które jest zasadniczo takie samo jak RRR w badaniu fazy 3 (95%), ale przy bezwzględnym zmniejszeniu ryzyka (ARR) wynoszącym 0,46%, co przekłada się na liczbę potrzebną do zaszczepienia (NNV) równą 217 (podczas gdy w badaniu fazy 3, ARR wynosiło 0,84%, a NNV 119). Oznacza to, że w warunkach rzeczywistych, aby zapobiec jednemu dodatkowemu przypadkowi zachorowania na COVID-19, należałoby zaszczepić 1,8 razy więcej osób niż przewidywano w badaniu klinicznym, które wykorzystano do uzyskania zezwolenia.
Nieskoordynowane badania fazy 3 nie spełniają wymogów zdrowia publicznego; badania platformowe zaprojektowane w celu odpowiedzi na pytania istotne dla zdrowia publicznego, ze wspólnym protokołem, pozwolą na podjęcie decyzji opartych na wspólnych kryteriach i jednolitej ocenie. Te rozważania na temat skuteczności i efektywności opierają się na badaniach mierzących zapobieganie łagodnym lub umiarkowanym zakażeniom COVID-19; nie zostały one zaprojektowane, aby wyciągnąć wnioski dotyczące zapobiegania hospitalizacji, ciężkiej choroby lub śmierci, lub zapobiegania zakażeniom i możliwości transmisji. Ocena przydatności szczepionek musi uwzględniać wszystkie wskaźniki, a także bezpieczeństwo, możliwość zastosowania, dostępność i koszty.
Zobacz na: Jak obliczać ryzyko
Bezwzględna redukcja ryzyka: Twoja tajna broń w ocenie literatury medycznej – Prof. Brandon Dyson
Redukcja ryzyka względnego na przykładzie 95% skuteczności szczepionek na C-19 – dr Thomas Cowan
Badania kliniczne szczepionek na Covid-19 pokazują, że protokoły opracowane są tak, żeby zakończyły się sukcesem. – prof. William A. Haseltine
Jak skuteczna jest szczepionka na COVID-19?
Definicja przypadku COVID w badaniach Pfizera i Moderny
W USA rejestruje się mniej niż 1% NOPów – Harvard Pilgrim Health Care
Anafilaksja po szczepieniu, VAERS wyłapuje w okolicach 1%
Czego nie wiemy o szczepionce na COVID-19 [FDA -17 grudnia 2020]
Skorygowana ocena związku przyczynowo-skutkowego między szczepieniami a zdarzeniami niepożądanymi dokonana przez Światową Organizację Zdrowia (WHO) – analiza krytyczna
Szczepionka mRNA przeciw COVID-19 a neurodegeneracyjne choroby prionowe.
Potencjalne problemy autoimmunologiczne i neurodegeneracyjne szczepionek na Covid-19 – Dr Christopher Shaw
Przypisy:
1. Zimmer C Corum J Wee S-L Covid-19 Vaccine Tracker. https://www.nytimes.com/interactive/2020/science/coronavirus-vaccine-tracker.html Date accessed: March 10, 2021
2. Polack FP Thomas SJ Kitchin N et al. Safety and efficacy of the BNT162b2 mRNA COVID-19 Vaccine. N Engl J Med. 2020; 383: 2603-2615
3. Baden LR El Sahly HM Essink B et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med. 2021; 384: 403-416
4. Voysey M Clemens SAC Madhi SA et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet. 2021; 397: 99-111
5. Logunov DY Dolzhikova IV Shcheblyakov DV et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet. 2021; 397: 671-681
6. US Food and Drug Administration, Vaccines and Related Biological Products Advisory Committee meeting: FDA briefing document.
https://www.fda.gov/advisory-committees/advisory-committee-calendar/vaccines-and-related-biological-products-advisory-committee-december-10-2020-meeting-announcement
Date: Dec 10, 2020. Date accessed: March 10, 2021
7. US Food and Drug Administration, Vaccines and Related Biological Products Advisory Committee meeting: FDA briefing document.
https://www.fda.gov/advisory-committees/advisory-committee-calendar/vaccines-and-related-biological-products-advisory-committee-december-17-2020-meeting-announcement
Date: Dec 17, 2020. Date accessed: March 10, 2021
8. US Food and Drug Administration, Vaccines and Related Biological Products Advisory Committee meeting: FDA briefing document.
https://www.fda.gov/advisory-committees/advisory-committee-calendar/vaccines-and-related-biological-products-advisory-committee-february-26-2021-meeting-announcement
Date: Feb 26, 2021. Date accessed: March 10, 2021
9. Olliaro P What does 95% COVID-19 vaccine efficacy really mean?. Lancet Infect Dis. 2021; (published online Feb 17.)
https://doi.org/10.1016/S1473-3099(21)00075-X
10. Brown RB Outcome reporting bias in COVID-19 mRNA vaccine clinical trials. Medicina (Kaunas). 2021; 57: 199
11. Dagan N Barda N Kepten E et al. BNT162b2 mRNA COVID-19 vaccine in a nationwide mass vaccination setting. N Engl J Med. 2021; (published online Feb 24.)

Pfizer ogłasza koniec badań nad szczepionką 6 kwietnia 2023
https://clinicaltrials.gov/ct2/show/NCT04368728
Moderna koniec badań nad szczepionką przewiduje na 27 październik 2022
https://clinicaltrials.gov/ct2/show/NCT04470427
Astra Zeneca koniec badań nad szczepionka przewiduje na 14 lutego 2023
https://clinicaltrials.gov/ct2/show/NCT04516746
J&J koniec badań nad szczepionka przewiduje na 2 styczna 2023
https://clinicaltrials.gov/ct2/show/NCT04505722
Długo żyjące komórki plazmatyczne szpiku kostnego (BMPC) są trwałym i niezbędnym źródłem przeciwciał ochronnych[1-7]. U osób, które przeszły rekonwalescencję po zakażeniu SARS-CoV-2, ryzyko ponownego zakażenia jest znacznie niższe[[8-10]. Mimo to donoszono, że przeciwciała surowicy przeciwko SARS-CoV-2 szybko zanikają w ciągu pierwszych kilku miesięcy po zakażeniu, co budzi obawy, że długo żyjące komórki plazmatyczne szpiku kostnego mogą nie być generowane, a odporność humoralna przeciwko temu wirusowi może być krótkotrwała[11-113]. Wykazujemy w tej publikacji, że u pacjentów, którzy doświadczyli łagodnych infekcji (n=77), miano przeciwciał anty-SARS-CoV-2 (S) w surowicy spada gwałtownie w ciągu pierwszych 4 miesięcy po zakażeniu, a następnie bardziej stopniowo w ciągu następnych 7 miesięcy, pozostając wykrywalne przez co najmniej 11 miesięcy po zakażeniu. Miana przeciwciał anty-białko kolcowe (S) korelowały z częstością występowania swoistych dla białka kolcowego długo żyjących komórek plazmatycznych szpiku kostnego uzyskanych od potencjalnych dawców szpiku kostnego 18 pacjentów, którzy przeszli infekcje SARS-CoV-2, od 7 do 8 miesięcy po zakażeniu. S-specyficzne długo żyjące komórki plazmatyczne szpiku kostnego nie zostały wykryte u potencjalnych kandydatów, 11 zdrowych osób bez historii zakażenia SARS-CoV-2. Wykazaliśmy, że długo żyjące komórki plazmatyczne szpiku kostnego wiążące białko kolcowe (S) są w stanie spoczynku, co wskazuje, że są one częścią długo żyjącego zasobu [odpornościowego]. Konsekwentnie, krążące limfocyty B pamięci w stanie spoczynku skierowane przeciwko białku kolcowemu (S) zostały wykryte u ozdrowieńców. Ogólnie rzecz biorąc, wykazujemy, że infekcja SARS-CoV-2 indukuje silną, specyficzną dla antygenu, długotrwałą humoralną odpowiedź immunologiczną u ludzi.” – Nature. 2021 May 24; SARS-CoV-2 infection induces long-lived bone marrow plasma cells in humans https://www.nature.com/articles/s41586-021-03647-4