Szczepienia dzieci a przewlekłe choroby | Henry Ford Health System
Wpływ szczepień dziecięcych na krótkoterminowe i długoterminowe przewlekłe wyniki zdrowotne u dzieci: badanie kohorty urodzeniowej – dr Lois Lamerato, mgr. Abigail Chatfield, dr Amy Tang, dr Marcus Zervos.
https://www.hsgac.senate.gov/wp-content/uploads/Entered-into-hearing-record-Impact-of-Childhood-Vaccination-on-Short-and-Long-Term-Chronic-Health-Outcomes-in-Children-A-Birth-Cohort-Study.pdf
Henry Ford Health System, Detroit, MI
Wydział Nauk o Zdrowiu Publicznym
Wydział Chorób Zakaźnych
Wydział Medyczny Uniwersytetu Stanowego Wayne’a, Detroit, MI
Cel: Porównanie krótko- i długoterminowych wyników zdrowotnych, w środowisku płatnika, dzieci narażonych na jedną lub więcej szczepionek z dziećmi nienarażonymi.
Projekt: Badanie kohortowe urodzeniowe
Miejsce: Zintegrowany system opieki zdrowotnej w stanie Michigan.
Uczestnicy: 18.468 dzieci urodzonych w latach 2000–2016 objętych ubezpieczeniem zdrowotnym.
Główne parametry wyniku: Rozwój przewlekłej choroby w czasie.
Wyniki: Łącznie 18.468 kolejnych uczestników spełniło kryteria kwalifikacji do badania, z czego 1957 nie miało żadnej ekspozycji na szczepienia, a 16.511 otrzymało przynajmniej jedną szczepionkę w trakcie swojego uczestnictwa w badanym okresie, przy zróżnicowanym poziomie ekspozycji. Po uwzględnieniu wielu zmiennych, analiza ryzyka proporcjonalnego Coxa wykazała, że ekspozycja na szczepienia była niezależnie związana ze zwiększonym ryzykiem rozwoju przewlekłej choroby (HR 2,53; CI 2,16–2,96).
Spośród analizowanych chorób przewlekłych ekspozycja na szczepienia była niezależnie powiązana ze zwiększonym ryzykiem wystąpienia: astmy (HR 4,25; CI 3,23–5,59), chorób autoimmunologicznych (HR 4,79; CI 1,36–16,94), chorób atopowych (HR 3,03; CI 2,01–4,57), egzemy (HR 1,31; CI 1,13–1,52) oraz zaburzeń neurorozwojowych (HR 5,53; CI 2,91–10,51). W grupie nieszczepionej nie odnotowano zwiększonego ryzyka dla żadnej z chorób przewlekłych.
Ogólne prawdopodobieństwo pozostania wolnym od choroby przewlekłej po dziesięciu latach obserwacji wyniosło 43 % w grupie szczepionej i 83 % w grupie nieszczepionej.
Wnioski: Badanie wykazało, że ekspozycja na szczepienia była niezależnie związana z 2,5-krotnym wzrostem prawdopodobieństwa rozwoju choroby przewlekłej w porównaniu z dziećmi nieszczepionymi. Zależność ta wynikała głównie z przypadków astmy, chorób atopowych, egzemy, chorób autoimmunologicznych oraz zaburzeń neurorozwojowych. Wyniki te sugerują, że u niektórych dzieci ekspozycja na szczepienia może zwiększać prawdopodobieństwo rozwoju choroby przewlekłej, zwłaszcza jednej z wymienionych powyżej.
Dr Paul Thomas – zawieszone prawo wykonywania zawodu za badanie szczepionek.
Akademicka Wojna z dr Paulem Marikiem
Immunogenność i bezpieczeństwo szczepionki przeciwko odrze, śwince i różyczce podawanej jako pierwsza dawka dzieciom w wieku od 12 do 15 miesięcy: badanie zgodności partii szczepionki z randomizacją typu non-inferiority [Nie-Niższe] fazy III
Wstęp
W ciągu ostatnich 30 lat częstość występowania chorób przewlekłych u dzieci wzrosła.[¹] Zgodnie z badaniem z 2011 roku, około 43% dzieci w Stanach Zjednoczonych (32 miliony) cierpi na co najmniej jedną z 20 przewlekłych chorób uwzględnionych w analizie.² Mimo to brakuje opublikowanych danych pozwalających określić czynniki przyczyniające się do tego zjawiska.
Szczepienia doprowadziły do zmniejszenia częstości występowania niektórych zachorowań wieku dziecięcego oraz związanej z nimi zachorowalności i śmiertelności.[³] Niemniej jednak, sceptycyzm wobec szczepień (tzw. vaccine hesitancy) nadal stanowi istotną przeszkodę w utrzymaniu i zwiększaniu odsetka osób wyszczepionych, a liczba rodziców rezygnujących ze wszystkich szczepień systematycznie rośnie.[4,5] Najczęstsze obawy rodziców dotyczą rozszerzania się kalendarza szczepień, podawania wielu szczepionek jednocześnie oraz potencjalnych długofalowych negatywnych skutków zdrowotnych szczepień.[6-9]
Badania odnoszące się do tych kwestii bezpieczeństwa mogą pomóc klinicystom w rozmowach z pacjentami oraz służyć uspokojeniu rodziców co do ogólnego poziomu bezpieczeństwa szczepień.[10]
Okres obserwacji bezpieczeństwa w badaniach klinicznych przed rejestracyjnych jest zazwyczaj zbyt krótki (mniej niż 30 dni), aby ocenić wpływ szczepionki na długoterminowe wyniki zdrowotne.[11] Jednakże szereg badań obserwacyjnych przeprowadzonych po wprowadzeniu szczepionek do obrotu analizowało — z różnymi wynikami — czy niektóre szczepienia mogą być związane z rozwojem określonych schorzeń.[12-16]
Istotnym ograniczeniem tych badań, na które zwrócił uwagę raport Instytutu Medycyny (IOM) The Childhood Immunization Schedule and Safety,[10] jest to, że „większość badań dotyczących szczepionek koncentruje się na skutkach pojedynczych szczepień lub ich kombinacji podawanych podczas jednej wizyty”, zamiast porównywać populacje całkowicie nieszczepione z tymi, które otrzymały jedną lub więcej szczepionek. Doprowadziło to Instytut Medycyny do rekomendacji przeprowadzania badań retrospektywnych oceniających wyniki zdrowotne populacji szczepionych w porównaniu z nieszczepionymi [w ogóle].
W związku z tym niniejsze badanie porównywało krótkoterminowe i długoterminowe wyniki zdrowotne — w ramach jednego środowiska ubezpieczeniowego — u dzieci nieszczepionych oraz u tych, które były narażone na jedną lub więcej szczepionek. Zajęcie się tą istotną luką w danych mogłoby rozwiać obawy rodziców i wzmocnić zaufanie do szczepień.
Metody
Miejsce badania
Henry Ford Health System (HFHS) to duży, pionowo zintegrowany system opieki zdrowotnej oferujący podstawowe, pediatryczne, ostre oraz specjalistyczne usługi medyczne na obszarze metropolii Detroit, obsługujący rocznie 4,2 miliona wizyt ambulatoryjnych.
Health Alliance Plan (HAP), organizacja non-profit typu HMO (Health Maintenance Organization – organizacja opieki zdrowotnej) i spółka zależna HFHS, obejmuje opieką około 570.000 zarejestrowanych członków, z których około jedna trzecia korzysta z usług HFHS.
Zróżnicowana populacja pacjentów w ramach Henry Ford Health System (HFHS), bogate zasoby kliniczne oraz zaawansowane systemy informatyczne czynią ten ośrodek wyjątkowo odpowiednim do przeprowadzenia niniejszego badania.
Projekt badania
To retrospektywne badanie oceniało wyniki zdrowotne kohorty dzieci urodzonych w latach 2000–2016 i objętych ubezpieczeniem w ramach Health Alliance Plan (HAP). Kohortę tę zidentyfikowano przy użyciu administracyjnych baz danych HAP oraz HFHS.
Uczestnicy byli obserwowani od momentu urodzenia aż do wcześniejszego z dwóch momentów: rezygnacji z planu ubezpieczeniowego lub 31 grudnia 2017 roku.
Źródła danych dla tego badania obejmowały dokumentację medyczną, kliniczną i ubezpieczeniową z HFHS i HAP, uzupełnioną o dane ze stanowego rejestru szczepień stanu Michigan.
Tabele danych zawierały informacje o wizytach (ambulatoryjnych i na izbach przyjęć), hospitalizacjach, diagnozach, procedurach oraz dane rozliczeniowe dotyczące wszystkich usług.
Analizowane szczepienia obejmowały wszystkie pozycje z harmonogramu szczepień zalecanego przez Centrum Kontroli i Prewencji Chorób (Centers for Disease Control and Prevention – CDC) — Recommended Child and Adolescent Immunization Schedule (Zalecany Kalendarz Szczepień Dzieci i Młodzieży).
Dane dotyczące zgonów uzyskano z elektronicznej dokumentacji medycznej HFHS oraz ze stanowego systemu rejestracji aktów zgonu stanu Michigan (Vital Records System). Przeprowadzono ręczny przegląd dokumentacji medycznej w celu ustalenia przyczyny zgonu uczestników, którzy zmarli w trakcie uczestnictwa w planie ubezpieczeniowym.
Wszyscy pacjenci HFHS otrzymują indywidualny, dożywotni numer zapisu medycznego, który umożliwia powiązanie danych w różnych tabelach.
Badanie zostało przeanalizowane i zatwierdzone przez Komisję Etyczną HFHS (Institutional Review Board) oraz przeprowadzone zgodnie z wytycznymi Międzynarodowego Towarzystwa Farmakoepidemiologii (International Society for Pharmacoepidemiology’s Guidelines for Good Pharmacoepidemiology Practices). (https://www.pharmacoepi.org/resources/guidelines_08027.cfm)
Populacja badania
Kryteria włączenia: Dzieci urodzone i zapisane do programu HAP na okres dłuższy niż 60 dni między 1 stycznia 2000 r. a 31 grudnia 2016 r., w Henry Ford Health System (HFHS) wyznaczonym jako podstawowy system opieki zdrowotnej.
Kryteria wykluczenia: Nieprawidłowości chromosomalne, porażenie mózgowe, mukowiscydoza, rozszczep kręgosłupa, wrodzone wady serca oraz schorzenia mózgu, układu nerwowego lub inne wady wrodzone obecne lub wykryte po urodzeniu. Wyłączenia te są zgodne z celem badania, którym było ocenienie długoterminowych wyników zdrowotnych w ogólnie zdrowej kohorcie urodzeniowej.
Definicje i ocena wyników
Głównym wynikiem badania był złożony wskaźnik przewlekłych schorzeń zdrowotnych (chronic health composite outcome), obejmujący choroby zidentyfikowane przez Child and Adolescent Health Measurement Initiative (Inicjatywa na rzecz Pomiaru Zdrowia Dzieci i Młodzieży)[2] oraz rozszerzony o schorzenia uznane za istotne społecznie lub mające znaczenie dla zdrowia publicznego w Białej Księdze CDC dotyczącej badań nad bezpieczeństwem dziecięcego programu szczepień (CDC’s White Paper on Studying the Safety of the Childhood Immunization Schedule)[17]. Złożony wskaźnik obejmował: cukrzycę, astmę, alergię pokarmową, nowotwory, dysfunkcję mózgu, choroby atopowe i autoimmunologiczne, a także zaburzenia neurologiczne, neurorozwojowe, napadowe i psychiczne. Uczestnik z jednym lub więcej z tych schorzeń był klasyfikowany jako osoba z przewlekłym problemem zdrowotnym. Inne oceniane schorzenia, które nie wchodziły w skład złożonego wskaźnika, obejmowały: napad astmy lub skurcz oskrzeli, anafilaksję, egzemę (ostre i przewlekłe postacie), infekcje ucha (ostre i przewlekłe) oraz alergię na orzeszki ziemne.
Zidentyfikowano odpowiednie kody diagnoz według Międzynarodowej Klasyfikacji Chorób, 9. i 10. rewizji (ICD-9-CM i ICD-10-CM), na podstawie danych z wizyt medycznych w trakcie okresu uczestnictwa w planie, dotyczących analizowanych schorzeń. Uczestników klasyfikowano według ekspozycji na szczepienia przed wystąpieniem danego schorzenia (ekspozycja vs brak ekspozycji), a następnie porównywano w zależności od statusu ekspozycji.
Dysfunkcja mózgu była definiowana jako encefalopatia lub zapalenie mózgu (encefalitis). Zaburzenia neurorozwojowe obejmowały: autyzm, tiki, ADD/ADHD, opóźnienie rozwoju, zaburzenia mowy, zaburzenia uczenia się, motoryki, intelektu, zachowania oraz inne upośledzenia psychologiczne.
Zaburzenia psychiczne obejmowały: lęk, depresję, chorobę afektywną dwubiegunową, fobie, zaburzenia emocjonalne, psychozy, zaburzenia somatoformiczne i odżywiania, maniakalne, psychiczne, nastroju, obsesyjno-kompulsywne, osobowości oraz stresowo-adaptacyjne.
Do analizy zaburzeń neurorozwojowych i psychicznych włączono wyłącznie dzieci w wieku 2 lat i starsze. Przewlekła egzema była definiowana jako co najmniej jeden nawrót w ciągu 60 dni lub więcej po pierwszym epizodzie. Przewlekła infekcja ucha była definiowana jako co najmniej dwa nawroty w ciągu roku po pierwszym epizodzie.
Analiza statystyczna
Charakterystyki opisowe przedstawiono jako procenty, średnie wartości ± odchylenia standardowe lub wartości median z przedziałami międzykwartylowymi (IQR). Do porównania różnic w cechach wyjściowych między dziećmi zaszczepionymi a nieszczepionymi przy urodzeniu zastosowano testy chi-kwadrat (Chi-square tests). Dla każdego wyniku obliczono liczbę zdarzeń oraz wskaźnik zapadalności na 1.000.000 osobolat (patient-years). Wskaźniki zapadalności względnej (incidence-rate ratios), wyliczone przy użyciu modeli regresji Poissona, przedstawiono wraz z odpowiadającymi im 95% przedziałami ufności. Do oceny związku między wynikami zdrowotnymi a statusem szczepienia zastosowano jednoczynnikowe i wieloczynnikowe modele proporcjonalnego ryzyka Coxa (univariate and multivariate Cox proportional-hazards models). Metodą Kaplana-Meiera oszacowano skumulowane 10-letnie ryzyko wystąpienia przewlekłej choroby zdrowotnej od urodzenia do pierwszego epizodu schorzenia, klasyfikując uczestników według wcześniejszej ekspozycji na szczepienia (eksponowani vs nieeksponowani). Grupy porównano za pomocą testu log-rank.
Wartość P < 0,05 uznano za statystycznie istotną. Ponieważ czas uczestnictwa w badaniu był ogólnie krótszy w grupie nieszczepionej, przeprowadzono analizy wrażliwości, powtarzając powyższe analizy dla uczestników zapisanych do programu przez co najmniej 1 rok, 3 lata i 5 lat. Dodatkowo, aby zminimalizować potencjalne zaburzenie wyników związane z mniejszym wykorzystaniem opieki zdrowotnej przez niektórych uczestników, przeprowadzono kolejną analizę wrażliwości — powtarzając wcześniejsze obliczenia wyłącznie dla osób, które miały co najmniej jeden kontakt z HFHS w trakcie uczestnictwa w programie ubezpieczeniowym.
Wyniki
Populacja badania
Łącznie 18.468 kolejnych uczestników spełniło kryteria kwalifikacyjne, z czego 1957 było nieeksponowanych (nieszczepionych), a 16.511 było eksponowanych na co najmniej jedną szczepionkę, zob. Tabela 1. W grupie eksponowanej [szczepionej] mediana liczby szczepień wynosiła 18 (IQR 2–28). Cechy częściej występujące w grupie eksponowanej to: płeć żeńska, rasa afroamerykańska, niska masa urodzeniowa, wcześniactwo, zespół zaburzeń oddechowych, uraz okołoporodowy.
Mediana czasu obserwacji wynosiła: 904 dni (IQR 392–1954) dla wszystkich uczestników, 970 dni (IQR 430–2093) dla uczestników eksponowanych, 461 dni (IQR 196–1081) dla uczestników nieeksponowanych. Okres uczestnictwa sięgał maksymalnie 6575 dni w grupie eksponowanej oraz 6386 dni w grupie nieeksponowanej.
Wyniki kliniczne
Wskaźniki zapadalności (incidence rate ratios – IRR), obliczone na podstawie statusu ekspozycji przed wystąpieniem danego schorzenia, przedstawiono w Tabeli 2. Ogólnie, rozwój przewlekłej choroby występował znacznie częściej w grupie eksponowanej na szczepienia w porównaniu z grupą nieeksponowaną (277 vs. 112 przypadków na milion osobolat, p < 0,0001), a częstość była wyraźnie wyższa wśród osób zaszczepionych (IRR 2,48, 95% CI 2,12–2,91).
Stwierdzono statystycznie istotny związek między szczepieniem a występowaniem astmy, chorób atopowych i autoimmunologicznych, a także zaburzeń zdrowia psychicznego i rozwojowych, w tym opóźnienia rozwoju i zaburzeń mowy.
Nie stwierdzono natomiast istotnego statystycznie związku między ekspozycją na szczepionki a częstością występowania nowotworów, alergii pokarmowych, autyzmu, niepełnosprawności ruchowej ani zaburzeń neurologicznych lub napadowych (padaczkowych).
Inne schorzenia, które występowały częściej wśród osób zaszczepionych, obejmowały: infekcje ucha (IRR 6,63; CI 5,73–7,66), przewlekłe infekcje ucha (IRR 5,67; CI 4,37–7,37), anafilaksję (IRR 8,88; CI 1,24–63,47), atak astmy lub skurcz oskrzeli (IRR 6,30; CI 3,85–10,31).
Ekspozycja na szczepionki nie była związana ze zwiększoną częstością występowania egzemy (IRR 1,06; CI 0,91–1,23), przewlekłej egzemy (IRR 0,94; CI 0,74–1,20) ani alergii na orzeszki ziemne (IRR 6,80; CI 0,95–48,69).
Po zastosowaniu wieloczynnikowej korekty, analiza modelu proporcjonalnego ryzyka Coxa wykazała, że ekspozycja na szczepienia była niezależnie związana ze zwiększonym ryzykiem rozwoju przewlekłej choroby (HR 2,54; CI 2,16–2,97), zob. Tabela 3. Szczepienie było niezależnie powiązane ze zwiększonym ryzykiem rozwoju astmy, egzemy, chorób atopowych i autoimmunologicznych, a także zaburzeń rozwojowych (w tym opóźnienia rozwoju i zaburzeń mowy).
Inne zmienne w modelu, które były niezależnie związane ze zwiększonym ryzykiem rozwoju przewlekłej choroby, obejmowały: płeć męską (HR 1,33; CI 1,26–1,41), rasę afroamerykańską (HR 1,11; CI 1,04–1,18), niską masę urodzeniową (HR 1,20; CI 1,01–1,42), bardzo niską masę urodzeniową (HR 1,48; CI 1,14–1,91), wcześniactwo (HR 1,24; CI 1,09–1,41).
Ekspozycja na szczepienia nie była istotnie związana ze zwiększonym ryzykiem nowotworów, alergii pokarmowych, autyzmu, niepełnosprawności ruchowej, ani zaburzeń neurologicznych, napadowych czy psychicznych. Nie było możliwe obliczenie wskaźników zapadalności (IRR) ani współczynników ryzyka (HR) dla: dysfunkcji mózgu, cukrzycy, ADHD, tików oraz zaburzeń behawioralnych, intelektualnych, uczenia się i innych zaburzeń psychologicznych, ponieważ wszystkie przypadki wystąpiły wyłącznie w grupie eksponowanej, a żaden w grupie nieeksponowanej.
Ekspozycja na szczepienia była również niezależnie związana ze zwiększonym ryzykiem rozwoju innych schorzeń, w tym: infekcji ucha (HR 7,00; CI 6,05–8,10), przewlekłej infekcji ucha (HR 7,89; CI 6,08–10,24), anafilaksji (HR 5,64; CI 1,11–28,74), ataku astmy lub skurczu oskrzeli (HR 5,82; CI 3,58–9,47), egzemy (HR 1,31; CI 1,13–1,52). Ekspozycja na szczepienia nie była związana z przewlekłą egzemą (HR 1,26; CI 0,98–1,60) ani alergią na orzeszki ziemne (HR 6,31; CI 0,88–45,37).
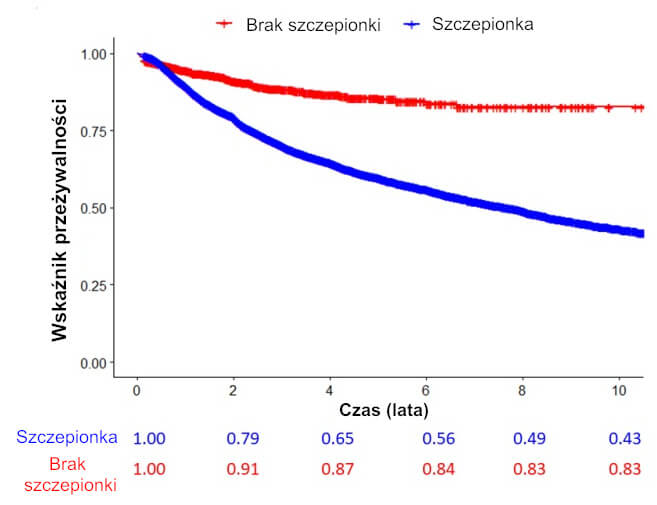
Analiza czasu do zdarzenia wykazała, że ogólne prawdopodobieństwo pozostania wolnym od przewlekłej choroby po 10 latach obserwacji wynosiło 43% w grupie eksponowanej oraz 83% w grupie nieeksponowanej (test log-rank, p < 0,0001), zob. Rycina 1.
W trakcie trwania badania odnotowano sześć zgonów wśród uczestników. Po ręcznym przeglądzie dokumentacji medycznej, w tym akt zgonu, gdy były dostępne, ustalono przyczyny zgonu: skomplikowany przebieg kliniczny od urodzenia (2 przypadki eksponowane, 1 nieeksponowany), uraz mózgu (1 eksponowany), przyczyna nieznana (2 eksponowanych).
Analizy wrażliwości
Ponieważ mediana czasu uczestnictwa w planie zdrowotnym była krótsza w grupie nieeksponowanej, przeprowadzono analizę wrażliwości dla ryzyka rozwoju przewlekłej choroby u uczestników zapisanych w planie przez co najmniej 1 rok, 3 lata i 5 lat, która wykazała spójne wyniki.
Ekspozycja na szczepienia wiązała się z wyższą częstością występowania przewlekłej choroby dla uczestników zapisanych co najmniej: 1 rok (IRR 2,75; CI 2,31–3,28), 3 lata (IRR 3,38; CI 2,67–4,30), 5 lat (IRR 4,09; CI 2,84–5,90), oraz z wyższym ryzykiem rozwoju przewlekłej choroby dla uczestników zapisanych co najmniej: 1 rok (HR 2,84; CI 2,38–3,38), 3 lata (HR 3,48; CI 2,74–4,42), 5 lat (HR 4,05; CI 2,82–5,83).
Aby uwzględnić potencjalny błąd wynikający z różnego poziomu korzystania z opieki zdrowotnej, przeprowadzono dodatkową analizę wrażliwości, powtarzając powyższe analizy wyłącznie wśród uczestników, którzy mieli przynajmniej jedną wizytę w trakcie uczestnictwa. W tej grupie ekspozycja na szczepienia również wiązała się z wyższą częstością występowania przewlekłej choroby (IRR 1,83; CI 1,56–2,14) oraz z wyższym ryzykiem rozwoju przewlekłej choroby (HR 1,87; CI 1,60–2,19).
Dyskusja
Główne wnioski
To badanie stanowi kompleksową analizę, mającą na celu ustalenie, czy ekspozycja na szczepienia jest związana z rozwojem jakiejkolwiek przewlekłej choroby u dzieci, lub czy wyniki są podobne bądź lepsze niż w grupie nieeksponowanej. Nie stwierdzono żadnego statystycznego związku między ekspozycją na szczepienia a występowaniem nowotworów, alergii pokarmowych, autyzmu, zaburzeń napadowych ani niektórych innych schorzeń. Porównań statystycznych nie przeprowadzono dla niektórych warunków, takich jak cukrzyca i ADHD, ponieważ nie wystąpiły żadne przypadki w grupie nieeksponowanej.
Mimo tego, i w sprzeczności z naszymi oczekiwaniami, stwierdzono, że ekspozycja na szczepienia była niezależnie związana z ogólnym 2,5-krotnym wzrostem prawdopodobieństwa rozwoju przewlekłej choroby, w porównaniu z dziećmi nieeksponowanymi na szczepienia. Ten związek był głównie napędzany zwiększonym ryzykiem wystąpienia astmy, atopii, egzemy, chorób autoimmunologicznych oraz zaburzeń rozwojowych. Ogólnie, wyniki sugerują, że u niektórych dzieci ekspozycja na szczepienia może zwiększać prawdopodobieństwo rozwoju przewlekłej choroby, szczególnie w przypadku jednej z wymienionych chorób.
Interpretacja i porównanie z wcześniejszymi badaniami
Szczepionki przyczyniły się do zmniejszenia liczby wielu celowanych infekcji oraz związanej z nimi zachorowalności i śmiertelności oraz są uznawane za jedno z ważniejszych osiągnięć w dziedzinie zdrowia publicznego XX wieku.[18] Kalendarz Szczepień CDC ewoluował z pięciu szczepionek w 1994 roku do 15 w 2020 roku. Pomimo tych postępów, istnieje niedobór danych oceniających wpływ szczepień na długoterminowe skutki zdrowotne, zarówno korzystne, jak i szkodliwe, szczególnie w przypadku schorzeń związanych z układem odpornościowym.
Ograniczone przez wytyczne etyczne, badania kliniczne przeprowadzane przed i po dopuszczeniu szczepionek rzadko obejmują grupę kontrolną nieeksponowaną na szczepienia. Te badania zazwyczaj mają również krótki okres przeglądu bezpieczeństwa ( mnie niż 30 dni), co ogranicza ich zdolność do oceny długoterminowych skutków zdrowotnych. Badania obserwacyjne mogą wypełnić te luki w danych, jednak do tej pory wyniki są sprzeczne.
Niektóre badania wykazały związek między szczepieniami a zwiększonym ryzykiem astmy, atopii, egzemy, chorób autoimmunologicznych i zaburzeń rozwojowych, podobnie jak w niniejszym badaniu.[13,14,19-28] Inne badania nie wykazały żadnego związku.[12,15,29-38] Częstym i istotnym ograniczeniem tych badań jest to, że prawie wszystkie nie mają rzeczywistej grupy nieeksponowanej, takiej jak w tym badaniu, i zazwyczaj oceniają jedynie otrzymanie jednej szczepionki (szczepieni) w porównaniu z jej nieotrzymaniem (niezaszczepieni) w grupie, która otrzymała większość innych szczepień (czyli w rzeczywistości prawie wszyscy są częściowo zaszczepieni).
Na przykład jedno badanie przeprowadzone w Niemczech, zaprojektowane do oceny związku między statusem szczepień (jedna lub więcej vs. Brak podania szczepionki) a długoterminowymi skutkami zdrowotnymi u dzieci, było badaniem ankietowym w populacji rodziców.[31] Mimo ograniczeń wynikających z błędu selekcji i pamięci rodzicielskiej, nie wykazało statystycznego związku między szczepieniami a atopią, egzemą ani astmą.[31] Jednakże miara szczepień była ograniczona do wybranych szczepionek, a bardzo mała grupa nieeksponowana mogła w rzeczywistości otrzymać inne szczepienia, takie jak na ospę wietrzną, rotawirusa, pneumokoki, meningokoki, grypa i/lub inne.
Według raportu Instytutu Medycyny (2013), niewiele badań oceniło cały Kalendarz Szczepień lub jego warianty w kontekście skutków zdrowotnych, i żadne nie porównywało różnic między całkowicie niezaszczepionymi a w pełni lub częściowo zaszczepionymi populacjami.[10] Nasze badanie, według naszej wiedzy, jest pierwszym, które porównuje wiele wyników klinicznych w czasie między dziećmi zaszczepionymi (przynajmniej jedną szczepionką) a całkowicie nieeksponowanymi, w ramach zamkniętego systemu ubezpieczeniowego, wykorzystując diagnozy i status szczepień z dokumentacji medycznej.
Słowa Alergia i Anafilaksja zostały utworzone, aby opisać szkody po szczepionkach
Aluminium jest stosowane do tworzenia alergii na modelach zwierzęcych
Mechanizmy biologiczne wyjaśniające, w jaki sposób ekspozycja na szczepionki u niektórych osób może zwiększać ryzyko zdrowotne, nie są jasne i wykraczają poza zakres tego badania, ale prawdopodobnie różnią się w zależności od choroby, szczepionki i cech odbiorcy [klienta]. Wspólnym motywem w literaturze jest to, że szczepienie może wywołać podatność genetyczną i/lub immunologiczną.[39,40]
Szczepionki mają na celu stymulację swoistej odpowiedzi immunologicznej na antygen, jednak istnieją znaczne luki w zrozumieniu złożonych mechanizmów immunologicznych, a także wzbudzono obawy o potencjalne niepożądane lub niecelowe efekty immunologiczne u podatnych odbiorców.[41,42]
Niespecyficzne skutki szczepień cz.1 – dr Suzanne Humphries
Niespecyficzne skutki szczepień cz.2 – dr Suzanne Humphries
Jak działają szczepionki? W dużej mierze nie mamy pojęcia. – Dr Peter Aaby
Koncepcja Pól Zdrowia Marca Lalonde’a
Według raportu Instytutu Medycyny, badania epidemiologiczne i mechanistyczne sugerują, że większość osób, które doświadczają niepożądanej reakcji na szczepionkę, ma wstępną podatność wynikającą z wariantów genetycznych (DNA człowieka lub mikrobiomu), narażeń środowiskowych, zachowań, chorób pośrednich, etapu rozwojowego lub innych czynników.[43] Postrzegane jako narażenie środowiskowe, oprócz antygenów, szczepionki zawierają również niewielkie ilości konserwantów, adiuwantów, dodatków i pozostałości z procesu produkcji.[44] Choć to badanie nie może dokładnie określić wpływu epigenetyki ani konkretnego składnika szczepionki, grupa nieeksponowana nie miała kontaktu ze składnikami szczepionki, natomiast grupa eksponowana otrzymała jedną lub więcej szczepionek.
Epigenetyka to rozwijająca się dziedzina badań, która bada, jak środowisko może wpływać na ekspresję genów bez zmiany sekwencji DNA. Badania wykazały, że epigenetyka może odgrywać rolę w patogenezie wielu chorób, w tym astmy, atopii, egzemy, chorób autoimmunologicznych i zaburzeń rozwojowych, choć dokładne przyczyny różnią się i pozostają w dużej mierze nieznane.[45-50] Wykazano również, że indywidualne, genetycznie uwarunkowane różnice w immunogenności i reaktywności na szczepionki istnieją.[51,52] Dziedzina zwana „Adwersomiką Szczepionkową”, choć w początkowej fazie rozwoju, stara się wprowadzić podejście medycyny precyzyjnej do praktyki szczepień, wykorzystując zaawansowane techniki genomowe, epigenetyczne i biostatystyczne, aby lepiej identyfikować osoby podatne na niepożądany skutek szczepionki i zapobiegać lub minimalizować skutki uboczne.[52-53] Jest to istotne, ponieważ, jak podkreśla CDC, szczepionki są generalnie podawane osobom zdrowym profilaktycznie, a ze względu na szerokie stosowanie, każde zagrożenie dla bezpieczeństwa, nawet rzadkie, może dotknąć dużą liczbę ludzi.[54] Wyniki tego badania, choć wstępne, sugerują, że obecnie niedooszacowujemy grupę osób podatnych na niepożądany efekt szczepionki.
W USA rejestruje się mniej niż 1% NOPów – Harvard Pilgrim Health Care
Skorygowana ocena związku przyczynowo-skutkowego między szczepieniami a zdarzeniami niepożądanymi dokonana przez Światową Organizację Zdrowia (WHO) – analiza krytyczna
Stwierdziliśmy 6-krotnie wyższe ryzyko chorób autoimmunologicznych w grupie eksponowanej na szczepionki. Niektóre szczepionki lub adiuwanty były powiązane z chorobami autoimmunologicznymi, takimi jak plamica małopłytkowa, reumatoidalne zapalenie stawów, toczeń rumieniowaty układowy, stwardnienie rozsiane i zespół Guillain-Barré.[10,23,24,55] Spektrum autoimmunologii obejmuje około 80 schorzeń, z których większość uznaje się za rzadkie, ale łącznie mają szacowaną częstość w populacji od 4,5% do 9,4%.[56,57] Choć mechanizmy patogenne chorób autoimmunologicznych nie są dobrze poznane ogólnie, a tym bardziej w przypadku powikłań autoimmunologicznych po szczepieniu, współczesne poglądy skłaniają się ku czynnikom środowiskowym wywołującym reakcje autoimmunologiczne u osób genetycznie podatnych, obejmując regulację epigenetyczną.[45] Proponowane mechanizmy, dzięki którym szczepionki mogą przyczyniać się do reakcji autoimmunologicznych, to mimikra molekularna (strukturalne podobieństwo między składnikiem szczepionki a własnym antygenem organizmu) oraz aktywacja przyboczna/bierna (czynniki mikrobiologiczne aktywują wcześniej uaktywnione autoreaktywne komórki odpornościowe).[40]
Niektóre badania wykazały, że szczepienia i choroby atopowe, takie jak astma, egzema i inne alergie, są ze sobą powiązane, podczas gdy inne tego nie potwierdziły.[12,13,20,22,28] Infekcje wieku dziecięcego wydają się zapewniać istotną ochronę przed atopią, a sugerowano, że szczepienia mogą przyczyniać się do atopii przez wywołanie nierównowagi między dwoma klasami limfocytów Th (Th1 i Th2) u osób genetycznie podatnych.[58,59] Stwierdziliśmy ponad 4-krotnie wyższe ryzyko astmy i ponad 6-krotnie wyższe ryzyko ataku astmy u osób eksponowanych na szczepienia. To odkrycie jest zgodne z wynikami Odenta i wsp., którzy stwierdzili, że otrzymanie szczepionki DTP, w porównaniu z jej brakiem, wiązało się ze zwiększonym ryzykiem astmy (RR=5,43; CI=1,93-15,30).[20] W tym badaniu ponad połowa grupy nieotrzymującej DTP była eksponowana na inne szczepionki, a grupa o najniższej częstości astmy nie była eksponowana na żadną szczepionkę (10,7% w grupie DTP wobec 1,1% w grupie niezaszczepionej), choć mała liczebność tej ostatniej grupy ograniczała możliwości porównań statystycznych.
Większość badań nad szczepieniami a wynikami rozwojowymi oceniała ekspozycję na szczepionkę MMR[35,36] lub tiomersal[26,37,60] oraz autyzm[61]. Te badania zazwyczaj nie wykazały związku, co jest zgodne z wynikami tego badania, choć liczba przypadków autyzmu w tym badaniu była niewielka. Nieliczne badania oceniające potencjalne powiązania między szczepieniami a zaburzeniami rozwojowymi poza autyzmem korzystały zazwyczaj z małego zestawu danych ocen neuropsychiatrycznych w wieku 7–10 lat z lat 90., w którym wszyscy uczestnicy otrzymali wszystkie szczepionki z pierwszego roku życia.[38,62] Badania te przyniosły sprzeczne wyniki[38,62]. Niedawne badanie pilotażowe, wykorzystujące dane z roszczeń ubezpieczeniowych, stwierdziło związek czasowy między szczepieniami a wystąpieniem niektórych zaburzeń neuropsychiatrycznych.[27]
Badania kliniczne nie były zaprojektowane, aby wykluczyć autyzm – dr Kathryn Edwards
Ciąża, Odporność, Schizofrenia i Autyzm – dr Paul Patterson
Chociaż przyczyny wzrostu występowania zaburzeń rozwojowych u dzieci z 9,5% w 2009 r. do 16,9%[63] były bardzo słabo badane, obecne poglądy wskazują na wieloczynnikowe przyczyny, w tym układ odpornościowy, który jest niezbędny dla prawidłowego rozwoju mózgu i bierze udział w patogenezie kilku zaburzeń neurorozwojowych.[64-66] Badania epigenetyczne analizują złożone relacje między genetyczną ekspresją regulowaną rozwojowo a współdziałaniem prenatalnych i dziecięcych czynników ryzyka środowiskowego i ekspozycji[47], a także takich czynników jak status społeczno-ekonomiczny, wcześniactwo i waga urodzeniowa.[67]
Badanie Iqbala i wsp. nie wykazało związku między liczbą antygenów szczepionkowych a wynikami neuropsychologicznymi.[68] Jednak niedawne badanie oceniło możliwość analizy nieantygenowych składników szczepionek i stwierdziło, że spośród 34 składników tylko ekspozycję na aluminium można było konsekwentnie zmierzyć, ale nie oceniono później wpływu aluminium na klinicznie istotne wyniki.[69] My stwierdziliśmy silny związek między ekspozycją na szczepionki (w porównaniu z brakiem ekspozycji) a rozwojem zaburzeń neurorozwojowych (HR 5,84, CI 3,02-11,27), nawet po kontrolowaniu płci, rasy, wagi urodzeniowej, wcześniactwa i innych czynników. To zwiększone ryzyko było głównie napędzane zaburzeniami mowy, opóźnieniami rozwojowymi, tikami, ADHD oraz zaburzeniami behawioralnymi i motorycznymi. Etiologia tego związku jest niejasna, ale sugeruje, że szczepienia mogą działać jako czynnik środowiskowy u dzieci podatnych.
Mocne strony tego badania
Główne mocne strony tego badania to fakt, że oceniono zamkniętą populację, zarejestrowano kolejną kohortę urodzeniową, oceniano pacjentów tylko w czasie ich uczestnictwa w planie, opierano się wyłącznie na dokumentacji medycznej w celu ustalenia diagnoz, kontaktów i podanych szczepionek (w przeciwieństwie do wcześniejszych badań, które często polegały na wspomnieniach rodziców i danych z ankiet), mieliśmy kompletnie nieeksponowaną kohortę oraz stosowano grupowanie stanów zdrowotnych, co pozwala ujawnić związki, które nie są widoczne przy ocenie pojedynczych, rzadkich zaburzeń.
Chociaż niektóre wyniki były nieoczekiwane, inne są zgodne z wnioskami wcześniejszych przeglądów systematycznych, w tym przez Instytut Medycyny [IOM], takie jak uznany związek przyczynowy między szczepieniami a anafilaksją, który zaobserwowaliśmy, lub odrzucenie związku przyczynowego między szczepieniami a rakiem albo MMR a autyzmem.[43,70] To wzmacnia wewnętrzną wiarygodność wyników tego badania.
To badanie minimalizowało także ryzyko błędnej klasyfikacji ekspozycji na szczepionki. Po pierwsze, badania wykazały dobrą zgodność między elektronicznymi zapisami szczepień a dokumentacją medyczną, zarówno z wspomnieniami rodziców, jak i ręcznym przeglądem dokumentacji medycznej, szczególnie w przypadku osób nieeksponowanych na szczepienia.[71,71] Po drugie, każdy Elektroniczny Zapis Medyczny (EHR) pacjenta zawierał dane o podanych szczepionkach z HFHS i stanowego rejestru szczepień, co zapewniało pełne uchwycenie wszystkich szczepień. W Michigan wszyscy świadczeniodawcy są zobowiązani do zgłaszania szczepień do stanowego rejestru w ciągu 72 godzin od ich podania. Według naszej wiedzy, to badanie obejmuje największą kohortę dzieci całkowicie nieeksponowanych na szczepienia, z obserwacją niektórych osób sięgającą 18 lat.
Długotrwały wpływ na zdrowie szczepień wieloma antygenami – Odtajniony Raport armii USA [1980 rok]
Ograniczenia tego badania
Badanie ma ograniczenia. Ponieważ jest retrospektywne, nie możemy wykluczyć możliwości niezidentyfikowanych czynników zakłócających. Jednak obawa ta jest łagodzona przez stwierdzenie istotnych statystycznie związków między szczepieniami a określonymi wynikami zdrowotnymi, przy czym niektóre współczynniki ryzyka wynoszą od 2,5 do 6 razy większe ryzyko. Nie posiadaliśmy informacji o statusie społeczno-ekonomicznym ani o potencjalnie istotnych czynnikach po urodzeniu, takich jak dieta czy styl życia, ale dokonano korekty dla kilku istotnych czynników bazowych, takich jak płeć, pochodzenie etniczne, wiek ciążowy i waga urodzeniowa. Aby wykryć potencjalne niekontrolowane czynniki zakłócające, literatura sugeruje ocenę chorób, dla których nie oczekuje się związku przyczynowego ze szczepieniem, jako wynik kontrolny, np. urazy lub rak.[17] W tym kontekście nie stwierdziliśmy związku między ekspozycją na szczepionki a rakiem. Dodatkowo, opieraliśmy się na kodach diagnostycznych w danych administracyjnych, co jest powszechnie stosowane w badaniach epidemiologicznych, ale ma pewne wbudowane ograniczenia.
Dzieci niezaszczepione korzystają ogólnie z mniejszej liczby usług opieki zdrowotnej.[73] Wizyty kontrolne zbiegają się z kalendarzem szczepień i dają więcej okazji do oceny i diagnozy wśród dzieci otrzymujących szczepienia, w porównaniu z dziećmi niezaszczepionymi, co może wprowadzać błąd wykrywalności (ascertainment bias). W tym badaniu dzieci eksponowane miały średnio 7 wizyt rocznie, niezależnie od tego, czy miały przewlekłą chorobę. Dzieci nieeksponowane miały średnio 2 wizyty rocznie, ale średnio prawie 5 wizyt rocznie, jeśli zdiagnozowano u nich przewlekłą chorobę. Prawdopodobnie pokazuje to, że gdy dziecko miało stan chorobowy, rodzice szukali opieki medycznej. W rzeczywistości wiele ocenianych w tym badaniu stanów jest poważnych i nie można ich leczyć samodzielnie, takich jak astma, cukrzyca, wstrząs anafilaktyczny czy atak astmy, wymagając pilnej interwencji medycznej.
Niemniej jednak przeprowadziliśmy kilka analiz wrażliwości, aby zbadać wpływ wykorzystania opieki zdrowotnej w celu poprawy wewnętrznej wiarygodności badania i minimalizacji potencjalnego błędu wykrywalności. Aby upewnić się, że krótszy czas obserwacji grupy nieeksponowanej nie wpłynął na wyniki, powtórzyliśmy analizę proporcjonalnego ryzyka Cox dla złożonego wyniku przewlekłego stanu zdrowia dla osób zapisanych w planie na jeden, trzy i pięć lat, oraz dla tych, którzy odbyli przynajmniej jedną wizytę w placówce służby zdrowia, co wykazało wyniki zgodne z ogólnymi ustaleniami. Związek między szczepieniem a rozwojem przewlekłej choroby zdrowotnej był niezależny od tych czynników. Dlatego nasze ustalenia nie wydają się wynikać z różnic w korzystaniu z zasobów opieki zdrowotnej.
Nasze badanie oceniło wyłącznie, czy szczepienie wiąże się z klinicznie istotnymi wynikami, czyli stanami, które obecnie przyczyniają się do rosnącego obciążenia przewlekłymi chorobami zdrowotnymi u dzieci. Nie ocenialiśmy wpływu związków czasowych, poszczególnych szczepionek ani liczby szczepień, co ogranicza to badanie, ale jednocześnie minimalizuje potencjał odwrotnej przyczynowości (reverse causality).
Wnioski
W tym badaniu stwierdziliśmy, że ekspozycja dzieci na szczepienia była związana ze zwiększonym ryzykiem rozwoju przewlekłej choroby. Związek ten był przede wszystkim napędzany zwiększonym ryzykiem astmy, atopii, egzemy, chorób autoimmunologicznych oraz zaburzeń neuro‑rozwojowych. Sugeruje to, że u niektórych podatnych dzieci ekspozycja na szczepienia może zwiększać prawdopodobieństwo rozwoju przewlekłego stanu chorobowego, szczególnie w odniesieniu do jednej z tych chorób. Nasze wstępne ustalenia nie dowodzą przyczynowości i wymagają dalszych badań.
RYCINY I TABELE
Tabela 1. Charakterystyka urodzeń i dane demograficzne podzielone według statusu ekspozycji na szczepionki
| Demografia | Populacja badania (n=18468) | Brak szczepionki (n=1957) | Jakakolwiek szczepionka (n=16511) | Wartość p |
| Mężczyzna | 9,395 (51%) | 1,077 (55%) | 8,318 (50%) | <0.001 |
| Rasa | <0.001 | |||
| Biały | 6,858 (37%) | 900 (46%) | 5,958 (36%) | |
| Afroamerykanin | 6,625 (36%) | 453 (23%) | 6,172 (37%) | |
| Azjata | 1,131 (6%) | 87 (4%) | 1,044 (6%) | |
| Latynos | 503 (3%) | 31 (2%) | 472 (3%) | |
| Inne | 3,351 (18%) | 486 (25%) | 2,865 (17%) | |
| Masa urodzeniowa | <0.001 | |||
| Normalna | 17,701 (96%) | 1,907 (97%) | 15,794 (96%) | |
| Niska | 539 (3%) | 21 (1%) | 518 (3%) | |
| Bardzo niska | 228 (1%) | 29 (2%) | 199 (1.2%) | |
| Wcześniactwo | 1,063 (6%) | 34 (2%) | 1,029 (6%) | <0.001 |
| Zaburzenia oddechowe przy urodzeniu | 685 (4%) | 26 (1%) | 659 (4%) | <0.001 |
| Uraz porodowy | 200 (1%) | 4 (0%) | 196 (1%) | <0.001 |
| Iniekcje szczepionkowe | ||||
| 0 | 1,958 (10.6%) | |||
| 1-10 | 3,330 (18.0%) | |||
| 11-20 | 7,476 (40.5%) | |||
| 21-30 | 4,981 (27.0%) | |||
| >30 | 724 (3.9%) |
Definicje: Masa urodzeniowa (prawidłowa > 2500 g; niska masa urodzeniowa = poniżej 2500 g; bardzo niska masa urodzeniowa = poniżej 1500 g)
Ekspozycja na szczepionkę w celu porównania cech wyjściowych obejmowała otrzymanie jakiejkolwiek szczepionki w trakcie uczestnictwa w planie.
Tabela 2. Częstość występowania przewlekłych schorzeń w podziale na status ekspozycji na szczepionkę*
| Wynik | Ekspozycja na jakąkolwiek szczepionkę N
(Zapadalność na 1.000.000 pacjentolat) |
Brak ekspozycji na szczepionkę N
(Zapadalność na 1.000.000 pacjentolat) |
IRR (95% CI) | P |
| Przewlekłe schorzenie zdrowotne | 4,732 (277.3) | 160 (111.7) | 2.48 (2.12-2.91) | <0.0001 |
| Astma | 2,867 (145.6) | 52 (35.6) | 4.09 (3.11-5.38) | <0.0001 |
| Choroba atopowa | 946 (41.2) | 23 (15.6) | 2.64 (1.74-3.99) | <0.0001 |
| Choroba autoimmunologiczna | 201 (8.4) | 2 (1.4) | 6.16 (1.53-24.79) | 0.01 |
| Dysfunkcja mózgu | 8 (0.3) | 0 (0.0) | ∞ | |
| Rak | 169 (7.0) | 13 (8.8) | 0.79 (0.45-1.39) | 0.42 |
| Cukrzyca | 42 (1.7) | 0 (0.0) | ∞ | |
| Alergia pokarmowa | 577 (24.3) | 30 (20.5) | 1.19 (0.82-1.71) | 0.36 |
| Zaburzenie zdrowia psychicznego | 341 (15.9) | 5 (4.5) | 3.50 (1.45-8.46) | <0.01 |
| Zaburzenie neurorozwojowe | 1,029 (50.2) | 9 (8.2) | 6.15 (3.19-11.86) | <0.0001 |
| ADHD | 262 (12.1) | 0 (0.0) | ∞ | |
| Autyzm | 23 (1.1) | 1 (0.9) | 1.16 (0.16-8.62) | 0.88 |
| Niepełnosprawność behawioralna | 165 (7.6) | 0 (0.0) | ∞ | |
| Opóźnienie rozwojowe | 219 (10.1) | 3 (2.7) | 3.74 (1.20-11.68) | 0.02 |
| Niepełnosprawność w uczeniu się | 65 (3.0) | 0 (0.0) | ∞ | |
| Niepełnosprawność intelektualna | 5 (0.2) | 0 (0.0) | ∞ | |
| Zaburzenie mowy | 463 (21.8) | 6 (5.4) | 4.02 (1.80-9.00) | <0.001 |
| Niepełnosprawność motoryczna | 150 (6.9) | 2 (1.8) | 3.83 (0.95-15.47) | 0.06 |
| Tiki | 46 (2.1) | 0 (0.0) | ∞ | |
| Inna niepełnosprawność psychologiczna | 9 (0.4) | 0 (0.0) | ∞ | |
| Zaburzenie neurologiczne | 127 (5.2) | 12 (8.1) | 0.64 (0.35-1.16) | 0.14 |
| Zaburzenie napadów padaczkowych | 319 (13.3) | 12 (8.2) | 1.63 (0.92-2.91) | 0.09 |
* Nie można było obliczyć współczynników zapadalności w przypadku dysfunkcji mózgu, cukrzycy, ADHD, tików ani niepełnosprawności behawioralnej, intelektualnej, związanej z uczeniem się lub innej niepełnosprawności psychologicznej, ponieważ wszystkie przypadki wystąpiły w grupie poddanej szczepieniu, a w grupie niepoddanej szczepieniu nie wystąpił żaden przypadek.
Tabela 3. Analiza regresji proporcjonalnych zagrożeń Coxa dla ekspozycji na szczepionkę i rozwoju przewlekłego schorzenia*
| Wynik | Nie_skorygowany HR (95% CI) | P | Skorygowany HR (95% CI) | P |
| Przewlekłe schorzenie zdrowotne | 2.59 (2.21-3.03) | <0.0001 | 2.54 (2.16-2.97) | <0.0001 |
| Astma | 4.50 (3.42-5.93) | <0.0001 | 4.29 (3.26-5.65) | <0.0001 |
| Choroba atopowa | 3.11 (2.06-4.71) | <0.0001 | 3.03 (2.01-4.57) | <0.0001 |
| Choroba autoimmunologiczna | 6.12 (1.52-24.67) | 0.01 | 5.96 (1.48-24.11) | 0.02 |
| Dysfunkcja mózgu | ∞ | ∞ | ||
| Rak | 0.86 (0.49-1.52) | 0.61 | 0.90 (0.51-1.59) | 0.72 |
| Cukrzyca | ∞ | ∞ | ||
| Alergia pokarmowa | 1.38 (0.96-2.00) | 0.08 | 1.40 (0.97-2.02) | 0.07 |
| Zaburzenie zdrowia psychicznego | 1.69 (0.70-4.09) | 0.25 | 1.63 (0.69-3.82) | 0.26 |
| Zaburzenie neurorozwojowe | 5.61 (2.91-10.82) | <0.0001 | 5.53 (2.91-10.51) | <0.0001 |
| ADHD | ∞ | ∞ | ||
| Autyzm | 1.01 (0.13-7.55) | 0.99 | 0.62 (0.10-3.69) | 0.60 |
| Niepełnosprawność behawioralna | ∞ | ∞ | ||
| Opóźnienie rozwojowe | 3.87 (1.24-12.10) | 0.02 | 3.28 (1.13-9.55) | 0.03 |
| Niepełnosprawność intelektualna | ∞ | ∞ | ||
| Niepełnosprawność w uczeniu się | ∞ | ∞ | ||
| Niepełnosprawność motoryczna | 3.33 (0.82-13.48) | 0.09 | 2.92 (0.82-10.40) | 0.10 |
| Zaburzenie mowy | 4.84 (2.16-10.84) | 0.0001 | 4.47 (2.05-9.74) | <0.001 |
| Tiki | ∞ | ∞ | ||
| Inna niepełnosprawność psychologiczna | ∞ | ∞ | ||
| Zaburzenie neurologiczne | 0.75 (0.41-1.36) | 0.34 | 0.83 (0.46-1.51) | 0.55 |
| Zaburzenie napadów padaczkowych | 2.01 (1.13-3.59) | 0.02 | 1.66 (0.94-2.94) | 0.08 |
* Nie można było obliczyć współczynników zapadalności w przypadku dysfunkcji mózgu, cukrzycy, ADHD, tików ani niepełnosprawności behawioralnej, intelektualnej, związanej z uczeniem się lub innej niepełnosprawności psychologicznej, ponieważ wszystkie przypadki wystąpiły w grupie poddanej szczepieniu, a w grupie niepoddanej szczepieniu nie wystąpił żaden przypadek.
Rycina 1. Krzywa Kaplana-Meiera: 10-letnie przeżycie bez przewlekłej choroby w zależności od narażenia na szczepionkę
Niewygodne Badanie [z ukrytej kamery] | Henry Ford Health
https://rumble.com/v708z9y-niewygodne-badanie.html
Robert: Obecnie jesteśmy najbardziej schorowanym społeczeństwem krajem na świecie.
Del Bigtree: Szacuje się, że już ponad 54% naszych dzieci cierpi na przewlekłą, nieuleczalną chorobę. Czy nie powinniśmy dokładniej przyjrzeć się temu jednemu produktowi, który ma zmieniać nasz układ odpornościowy na całe życie? Można by przeprowadzić jedno proste badanie aby to wykluczyć. Badanie porównujące zaszczepionych z [w ogóle] niezaszczepionymi.
Aaron: Przypadek sprawił, że Dell spotkał z Marcusem Zervosem.
Del: Zgodził się przeprowadzić badanie zaszczepionych w porównaniu z badaniem dzieci niezaszczepionych.
– Dzieci które są zaszczepione, nie wygląda najlepiej.
– 4,47 razy więcej przypadków.
– Ryzyko większe o 5 i pół raza.
– Sześciokrotny wzrost.
– Wśród niezaszczepionych w tej grupie nie odnotowano żadnych przypadków.
– Jeśli to się potwierdzi, to będzie miało katastrofalne skutki.
– To powinno zostać opublikowane.
Sen. Ron Johnson: To są informacje, które społeczeństwo powinno było znać już w 2020 roku. A ja doprowadziłem do tego.
– Widzisz, jak Ford zareagował? Powiedzieli, że ten raport [publikacja] nie został opublikowany, ponieważ nie spełniał rygorystycznych wymagań naukowych, które stawiamy jako czołowa instytucja badawcza w dziedzinie medycyny. Zostaliśmy zmuszeni do działania.
– Będziemy musieli pokazać im nagranie.
– Zamierzam zabrać ze sobą ukryte kamery oraz sprzęt do nagrywania, żeby niezależnie od tego, co się wydarzy podczas kolacji, mógł udowodnić, że to miało miejsce.
Del: Jak się masz, Mark?
Dr Marcus Zervos: Miło cię widzieć.
Co sądzisz o tym badaniu, które przeprowadziliście?
Dr Marcus Zervos: Myślę, że to dobre badanie, choć ma swoje ograniczenia.
Del: Czy widzisz jakieś błędy w tym badaniu? Czy istnieje sposób by przeprowadzić to badanie lepiej?
Dr Marcus Zervos: Nic mi o tym nie wiadomo. Przedstawiłem je dokładnie tak, jak wygląda. Nie chcę mówić, że to nie jest właściwe postępowanie.
To właściwe postępowanie, ale po prostu nie chcę… Ktoś na pewno wyskoczy i powie, wiesz, „To badanie jest obarczone błędami.”
Dr Jake Scott: Nieopublikowana analiza przeprowadzona przez Henry Ford Health, jest zasadniczo nieprawidłowa.
Dr Marcus Zervos: Może warto spojrzeć na to, jako na istotną informację naukową, która może pomóc określić, jak właściwie należy przeprowadzić takie badanie. Jednak nie zostanie to tak potraktowane. A dlaczego miałbym to powiedzieć? Bo kryje się za tym polityczny interes.
Del: Czy to, co pokazuje twoje badanie… czy jest to istotne?
Dr Marcus Zervos: Tak, to jest istotne. Po prostu tego nie zrobię… Nie zrobię tego.
Del: Jeśli nie uda mi się opublikować tego badania, to jaka jest nadzieja dla wszystkich dzieci w przyszłości?
Powiedziałem ci: „Jeśli przeprowadzisz to badanie, spotkasz się z ostrą krytyką.” Odpowiedziałeś: „Nie obchodzi mnie o tym. Liczą się dla mnie tylko dane, a poza tym i tak niedługo przechodzę na emeryturę.” Dokładnie to powiedziałeś. Więc twoje nastawienie zdecydowanie się w tej kwestii zmieniło.
Dr Marcus Zervos: Nastawienie się zmienia. Opublikowanie czegoś takiego… po czymś takim mógłbym równie dobrze przejść na emeryturę. To byłby mój koniec [zawodowy].
To badanie jest niewygodne dla całej polityki szczepień.
Bibliografia:
REFERENCES
1. Van Cleave J, Gortmaker SL, Perrin JM. Dynamics of obesity and chronic health conditions among children and youth. JAMA 2010;303(7):623-30. doi: 10.1001/jama.2010.104 [published Online First: 2010/02/18]
2. Bethell CD, Kogan MD, Strickland BB, et al. A national and state profile of leading health problems and health care quality for US children: key insurance disparities and across-state variations. Acad Pediatr 2011;11(3 Suppl):S22-33. doi: 10.1016/j.acap.2010.08.011 [published Online First: 2011/05/21]
3. Hinman AR, Orenstein WA, Schuchat A, et al. Vaccine-preventable diseases, immunizations, and MMWR–1961-2011. MMWR Suppl 2011;60(4):49-57. [published Online First: 2011/10/07]
4. Schuster M, Eskola J, Duclos P, et al. Review of vaccine hesitancy: Rationale, remit and methods. Vaccine 2015;33(34):4157-60. doi: 10.1016/j.vaccine.2015.04.035 [published Online First: 2015/04/22]
5. Hill HA, Elam-Evans LD, Yankey D, et al. Vaccination Coverage Among Children Aged 19-35 Months – United States, 2017. MMWR Morb Mortal Wkly Rep 2018;67(40):1123-28. doi: 10.15585/mmwr.mm6740a4 [published Online First: 2018/10/12]
6. Chen RT, DeStefano F, Pless R, et al. Challenges and controversies in immunization safety. Infect Dis Clin North Am 2001;15(1):21-39, viii. [published Online First: 2001/04/17]
7. Saada A, Lieu TA, Morain SR, et al. Parents’ choices and rationales for alternative vaccination schedules: a qualitative study. Clin Pediatr (Phila) 2015;54(3):236-43. doi: 10.1177/0009922814548838 [published Online First: 2014/09/10]
8. Kennedy A, Basket M, Sheedy K. Vaccine attitudes, concerns, and information sources reported by parents of young children: results from the 2009 HealthStyles survey. Pediatrics 2011;127 Suppl 1:S92-9. doi: 10.1542/peds.2010-1722N [published Online First: 2011/04/20]
9. Gellin BG, Maibach EW, Marcuse EK. Do parents understand immunizations? A national telephone survey. Pediatrics 2000;106(5):1097-102. doi: 10.1542/peds.106.5.1097 [published Online First: 2000/11/04]
10. . The Childhood Immunization Schedule and Safety: Stakeholder Concerns, Scientific Evidence, and Future Studies. Washington (DC)2013.
11. Chen R. Safety of Vaccines. Philadelphia: WB Saunders 1999:1144-1163.
12. DeStefano F, Gu D, Kramarz P, et al. Childhood vaccinations and risk of asthma. Pediatr Infect Dis J 2002;21(6):498-504. doi: 10.1097/00006454-200206000-00004 [published Online First: 2002/08/17]
13. McDonald KL, Huq SI, Lix LM, et al. Delay in diphtheria, pertussis, tetanus vaccination is associated with a reduced risk of childhood asthma. J Allergy Clin Immunol 2008;121(3):626-31. doi: 10.1016/j.jaci.2007.11.034 [published Online First: 2008/01/22]
14. Hurwitz EL, Morgenstern H. Effects of diphtheria-tetanus-pertussis or tetanus vaccination on allergies and allergy-related respiratory symptoms among children and adolescents in the United States. J Manipulative Physiol Ther 2000;23(2):81-90. [published Online First: 2000/03/14]
15. Nilsson L, Kjellman NI, Bjorksten B. A randomized controlled trial of the effect of pertussis vaccines on atopic disease. Arch Pediatr Adolesc Med 1998;152(8):734-8. doi: 10.1001/archpedi.152.8.734 [published Online First: 1998/08/13]
16. DeStefano F, Price CS, Weintraub ES. Increasing exposure to antibody-stimulating proteins and polysaccharides in vaccines is not associated with risk of autism. J Pediatr 2013;163(2):561-7. doi: 10.1016/j.jpeds.2013.02.001 [published Online First: 2013/04/03]
17. Glanz JM, Newcomer SR, Jackson ML, et al. White Paper on studying the safety of the childhood immunization schedule in the Vaccine Safety Datalink. Vaccine 2016;34 Suppl 1:A1-A29. doi: 10.1016/j.vaccine.2015.10.082 [published Online First: 2016/02/03]
18. Centers for Disease C, Prevention. Ten great public health achievements–United States, 1900-1999. MMWR Morb Mortal Wkly Rep 1999;48(12):241-3. [published Online First: 1999/04/29]
19. Kemp T, Pearce N, Fitzharris P, et al. Is infant immunization a risk factor for childhood asthma or allergy? Epidemiology 1997;8(6):678-80. doi: 10.1097/00001648-199710000-00011 [published Online First: 1997/11/05]
20. Odent MR, Culpin EE, Kimmel T. Pertussis vaccination and asthma: is there a link? JAMA 1994;272(8):592-3. [published Online First: 1994/08/24]
21. Kiraly N, Koplin JJ, Crawford NW, et al. Timing of routine infant vaccinations and risk of food allergy and eczema at one year of age. Allergy 2016;71(4):541-9. doi: 10.1111/all.12830 [published Online First: 2015/12/29]
22. McKeever TM, Lewis SA, Smith C, et al. Vaccination and allergic disease: a birth cohort study. Am J Public Health 2004;94(6):985-9. doi: 10.2105/ajph.94.6.985 [published Online First: 2004/07/14]
23. Chen RT, Pless R, Destefano F. Epidemiology of autoimmune reactions induced by vaccination. J Autoimmun 2001;16(3):309-18. doi: 10.1006/jaut.2000.0491 [published Online First: 2001/05/04]
24. Karussis D, Petrou P. The spectrum of post-vaccination inflammatory CNS demyelinating syndromes. Autoimmun Rev 2014;13(3):215-24. doi: 10.1016/j.autrev.2013.10.003 [published Online First: 2014/02/12]
25. Miller E, Waight P, Farrington CP, et al. Idiopathic thrombocytopenic purpura and MMR vaccine. Arch Dis Child 2001;84(3):227-9. doi: 10.1136/adc.84.3.227 [published Online First: 2001/02/24]
26. Gallagher CM, Goodman MS. Hepatitis B vaccination of male neonates and autism diagnosis, NHIS 1997-2002. J Toxicol Environ Health A 2010;73(24):1665-77. doi: 10.1080/15287394.2010.519317 [published Online First: 2010/11/09]
27. Leslie DL, Kobre RA, Richmand BJ, et al. Temporal Association of Certain Neuropsychiatric Disorders Following Vaccination of Children and Adolescents: A Pilot Case-Control Study. Front Psychiatry 2017;8:3. doi: 10.3389/fpsyt.2017.00003 [published Online First: 2017/02/06]
28. Alm JS, Swartz J, Lilja G, et al. Atopy in children of families with an anthroposophic lifestyle. Lancet 1999;353(9163):1485-8. doi: 10.1016/S0140-6736(98)09344-1 [published Online First: 1999/05/08]
29. Mohrenschlager M, Haberl VM, Kramer U, et al. Early BCG and pertussis vaccination and atopic diseases in 5- to 7-year-old preschool children from Augsburg, Germany: results from the MIRIAM study. Pediatr Allergy Immunol 2007;18(1):5-9. doi: 10.1111/j.1399-3038.2006.00485.x [published Online First: 2007/02/14]
30. Matheson MC, Haydn Walters E, Burgess JA, et al. Childhood immunization and atopic disease into middle-age–a prospective cohort study. Pediatr Allergy Immunol 2010;21(2 Pt 1):301-6. doi: 10.1111/j.1399-3038.2009.00950.x [published Online First: 2009/12/17]
31. Schmitz R, Poethko-Muller C, Reiter S, et al. Vaccination status and health in children and adolescents: findings of the German Health Interview and Examination Survey for Children and Adolescents (KiGGS). Dtsch Arztebl Int 2011;108(7):99-104. doi: 10.3238/arztebl.2011.0099 [published Online First: 2011/03/18]
32. Grimaldi-Bensouda L, Le Guern V, Kone-Paut I, et al. The risk of systemic lupus erythematosus associated with vaccines: an international case-control study. Arthritis Rheumatol 2014;66(6):1559-67. doi: 10.1002/art.38429 [published Online First: 2014/03/05]
33. DeStefano F, Mullooly JP, Okoro CA, et al. Childhood vaccinations, vaccination timing, and risk of type 1 diabetes mellitus. Pediatrics 2001;108(6):E112. doi: 10.1542/peds.108.6.e112 [published Online First: 2001/12/04]
34. Baxter R, Bakshi N, Fireman B, et al. Lack of association of Guillain-Barre syndrome with vaccinations. Clin Infect Dis 2013;57(2):197-204. doi: 10.1093/cid/cit222 [published Online First: 2013/04/13]
35. Jain A, Marshall J, Buikema A, et al. Autism occurrence by MMR vaccine status among US children with older siblings with and without autism. JAMA 2015;313(15):1534-40. doi: 10.1001/jama.2015.3077 [published Online First: 2015/04/22]
36. DeStefano F, Bhasin TK, Thompson WW, et al. Age at first measles-mumps-rubella vaccination in children with autism and school-matched control subjects: a population-based study in metropolitan atlanta. Pediatrics 2004;113(2):259-66. doi: 10.1542/peds.113.2.259 [published Online First: 2004/02/03]
37. Price CS, Thompson WW, Goodson B, et al. Prenatal and infant exposure to thimerosal from vaccines and immunoglobulins and risk of autism. Pediatrics 2010;126(4):656-64. doi: 10.1542/peds.2010-0309 [published Online First: 2010/09/15]
38. Barile JP, Kuperminc GP, Weintraub ES, et al. Thimerosal exposure in early life and neuropsychological outcomes 7-10 years later. J Pediatr Psychol 2012;37(1): 106-18. doi: 10.1093/jpepsy/jsr048 [published Online First: 2011/07/26]
39. Sibilia J, Maillefert JF. Vaccination and rheumatoid arthritis. Ann Rheum Dis 2002;61(7):575-6. doi: 10.1136/ard.61.7.575 [published Online First: 2002/06/25]
40. Vadala M, Poddighe D, Laurino C, et al. Vaccination and autoimmune diseases: is prevention of adverse health effects on the horizon? EPMA J 2017;8(3):295-311. doi: 10.1007/s13167-017- 0101-y [published Online First: 2017/10/13]
41. Pulendran B, Ahmed R. Immunological mechanisms of vaccination. Nat Immunol 2011;12(6):509-17. [published Online First: 2011/07/09]
42. Kandasamy R, Voysey M, McQuaid F, et al. Non-specific immunological effects of selected routine childhood immunisations: systematic review. BMJ 2016;355:i5225. doi: 10.1136/bmj.i5225 [published Online First: 2016/10/16]
43. . In: Stratton K, Ford A, Rusch E, et al., eds. Adverse Effects of Vaccines: Evidence and Causality. Washington (DC)2011.
44. Offit PA, Jew RK. Addressing parents’ concerns: do vaccines contain harmful preservatives, adjuvants, additives, or residuals? Pediatrics 2003;112(6 Pt 1):1394-7. doi: 10.1542/peds.112.6.1394 [published Online First: 2003/12/05]
45. Costenbader KH, Gay S, Alarcon-Riquelme ME, et al. Genes, epigenetic regulation and environmental factors: which is the most relevant in developing autoimmune diseases? Autoimmun Rev 2012;11(8):604-9. doi: 10.1016/j.autrev.2011.10.022 [published Online First: 2011/11/02]
46. Gomez JL. Epigenetics in Asthma. Curr Allergy Asthma Rep 2019;19(12):56. doi: 10.1007/s11882-019-0886-y [published Online First: 2019/11/30]
47. Millan MJ. An epigenetic framework for neurodevelopmental disorders: from pathogenesis to potential therapy. Neuropharmacology 2013;68:2-82. doi: 10.1016/j.neuropharm.2012.11.015 [published Online First: 2012/12/19]
48. Bollati V, Baccarelli A. Environmental epigenetics. Heredity (Edinb) 2010;105(1):105-12. doi: 10.1038/hdy.2010.2 [published Online First: 2010/02/25]
49. Kuriakose JS, Miller RL. Environmental epigenetics and allergic diseases: recent advances. Clin Exp Allergy 2010;40(11):1602-10. doi: 10.1111/j.1365-2222.2010.03599.x [published Online First: 2010/08/20]
50. Mervis JS, McGee JS. DNA methylation and inflammatory skin diseases. Arch Dermatol Res 2019 doi: 10.1007/s00403-019-02005-9 [published Online First: 2019/11/07]
51. Poland GA, Ovsyannikova IG, Jacobson RM. Vaccine immunogenetics: bedside to bench to population. Vaccine 2008;26(49):6183-8. doi: 10.1016/j.vaccine.2008.06.057 [published Online First: 2008/07/05]
52. Poland GA, Ovsyannikova IG, Jacobson RM. Adversomics: the emerging field of vaccine adverse event immunogenetics. Pediatr Infect Dis J 2009;28(5):431-2. doi:
10.1097/INF.0b013e3181a6a511 [published Online First: 2009/04/28]
53. Whitaker JA, Ovsyannikova IG, Poland GA. Adversomics: a new paradigm for vaccine safety and design. Expert Rev Vaccines 2015;14(7):935-47. doi: 10.1586/14760584.2015.1038249 [published Online First: 2015/05/06]
54. Centers for Disease C. Epidemiology and Prevention of Vaccine-Preventable Diseases [Available from: https://www.cdc.gov/vaccines/pubs/pinkbook/safety.html accessed 10/25/2019 2019.
55. Shoenfeld Y, Aron-Maor A. Vaccination and autoimmunity-’vaccinosis’: a dangerous liaison? J Autoimmun 2000;14(1):1-10. doi: 10.1006/jaut.1999.0346 [published Online First: 2000/01/29]
56. Hayter SM, Cook MC. Updated assessment of the prevalence, spectrum and case definition of autoimmune disease. Autoimmun Rev 2012;11(10):754-65. doi: 10.1016/j.autrev.2012.02.001 [published Online First: 2012/03/06]
57. Cooper GS, Bynum ML, Somers EC. Recent insights in the epidemiology of autoimmune diseases: improved prevalence estimates and understanding of clustering of diseases. J Autoimmun 2009;33(3-4):197-207. doi: 10.1016/j.jaut.2009.09.008 [published Online First: 2009/10/13]
58. von Hertzen LC, Haahtela T. Could the risk of asthma and atopy be reduced by a vaccine that induces a strong T-helper type 1 response? Am J Respir Cell Mol Biol 2000;22(2):139-42. doi: 10.1165/ajrcmb.22.2.3753 [published Online First: 2000/02/05]
59. Strachan DP. Hay fever, hygiene, and household size. BMJ 1989;299(6710):1259-60. doi: 10.1136/bmj.299.6710.1259 [published Online First: 1989/11/18]
60. Verstraeten T, Davis RL, DeStefano F, et al. Safety of thimerosal-containing vaccines: a two-phased study of computerized health maintenance organization databases. Pediatrics 2003;112(5):1039- 48. [published Online First: 2003/11/05]
61. Taylor LE, Swerdfeger AL, Eslick GD. Vaccines are not associated with autism: an evidence-based meta-analysis of case-control and cohort studies. Vaccine 2014;32(29):3623-9. doi: 10.1016/j.vaccine.2014.04.085 [published Online First: 2014/05/13]
62. Smith MJ, Woods CR. On-time vaccine receipt in the first year does not adversely affect neuropsychological outcomes. Pediatrics 2010;125(6):1134-41. doi: 10.1542/peds.2009-2489 [published Online First: 2010/05/26]
63. Zablotsky B, Black LI, Maenner MJ, et al. Prevalence and Trends of Developmental Disabilities among Children in the United States: 2009-2017. Pediatrics 2019 doi: 10.1542/peds.2019-0811 [published Online First: 2019/09/29]
64. Verlaet AA, Noriega DB, Hermans N, et al. Nutrition, immunological mechanisms and dietary immunomodulation in ADHD. Eur Child Adolesc Psychiatry 2014;23(7):519-29. doi: 10.1007/s00787-014-0522-2 [published Online First: 2014/02/05]
65. Martino D, Zis P, Buttiglione M. The role of immune mechanisms in Tourette syndrome. Brain Res 2015;1617:126-43. doi: 10.1016/j.brainres.2014.04.027 [published Online First: 2014/05/23]
66. Knuesel I, Chicha L, Britschgi M, et al. Maternal immune activation and abnormal brain development across CNS disorders. Nat Rev Neurol 2014;10(11):643-60. doi: 10.1038/nrneurol.2014.187 [published Online First: 2014/10/15]
67. United States. Environmental Protection Agency. America’s children and the environment. Third edition. ed. Washington, D.C.: United States Environmental Protection Agency 2013.
68. Iqbal S, Barile JP, Thompson WW, et al. Number of antigens in early childhood vaccines and neuropsychological outcomes at age 7-10 years. Pharmacoepidemiol Drug Saf 2013;22(12):1263-70. doi: 10.1002/pds.3482 [published Online First: 2013/07/13]
69. Glanz JM, Newcomer SR, Daley MF, et al. Cumulative and episodic vaccine aluminum exposure in a population-based cohort of young children. Vaccine 2015;33(48):6736-44. doi: 10.1016/j.vaccine.2015.10.076 [published Online First: 2015/11/01]
70. Maglione MA, Das L, Raaen L, et al. Safety of vaccines used for routine immunization of U.S. children: a systematic review. Pediatrics 2014;134(2):325-37. doi: 10.1542/peds.2014-1079 [published Online First: 2014/08/03]
71. Mullooly J, Drew L, DeStefano F, et al. Quality of HMO vaccination databases used to monitor childhood vaccine safety. Vaccine Safety DataLink Team. Am J Epidemiol 1999;149(2):186-94. doi: 10.1093/oxfordjournals.aje.a009785 [published Online First: 1999/01/28]
72. Daley MF, Shoup JA, Newcomer SR, et al. Assessing Potential Confounding and Misclassification Bias When Studying the Safety of the Childhood Immunization Schedule. Acad Pediatr 2018;18(7):754-62. doi: 10.1016/j.acap.2018.03.007 [published Online First: 2018/04/01]
73. Wei F, Mullooly JP, Goodman M, et al. Identification and characteristics of vaccine refusers. BMC Pediatr 2009;9:18. doi: 10.1186/1471-2431-9-18 [published Online First: 2009/03/06]