Immunogenność i bezpieczeństwo szczepionki MMR przeciwko odrze, śwince i różyczce podawanej jako pierwsza dawka dzieciom w wieku od 12 do 15 miesięcy: badanie zgodności partii szczepionki z randomizacją typu non-inferiority [Nie-Niższe] fazy III
Źródło: J Pediatric Infect Dis Soc. 2020 Apr 30;9(2):194-201; Immunogenicity and Safety of a Measles-Mumps-Rubella Vaccine Administered as a First Dose to Children Aged 12 to 15 Months: A Phase III, Randomized, Noninferiority, Lot-to-Lot Consistency Study

Zanim przejdziemy do treści artykułu podam kilka cytatów i streszczenie tej publikacji i kontekst. Koncern GSK chcąc wejśc na rynek w USA, porównał swoją szczepionkę MMR ze szczepionką MMR koncernu Merck. Zamiast przeprowadzić randomizowane badanie z wykorzystaniem grupy kontrolnej placebo, zastosowano badania typu non-inferiority [Nie-Niższe], co w zasadzie oznacza, że porównamy naszą [nową] szczepionkę do innej szczepionki i jeżeli nie będzie bardziej beznadziejna niż ta starsza to w końcu badanie typu non-inferiority [Nie-Niższe], że nie jest gorsza. Jeśli jest tak samo beznadziejna lub w podobnym stopniu, wówczas ją zatwierdzimy. Jest jednak ogromny pozytyw tego badania przeprowadzonego na zlecenie koncernu produkującego szczepionki, a mianowicie obnaża to jak zaniżone są oficjalne statystyki NOPów przez służbę zdrowia. W Polsce co roku rodzi się około 400 tysięcy dzieci.
Urodzenia żywe w latach 1946-2018-wyże i niże demograficzne
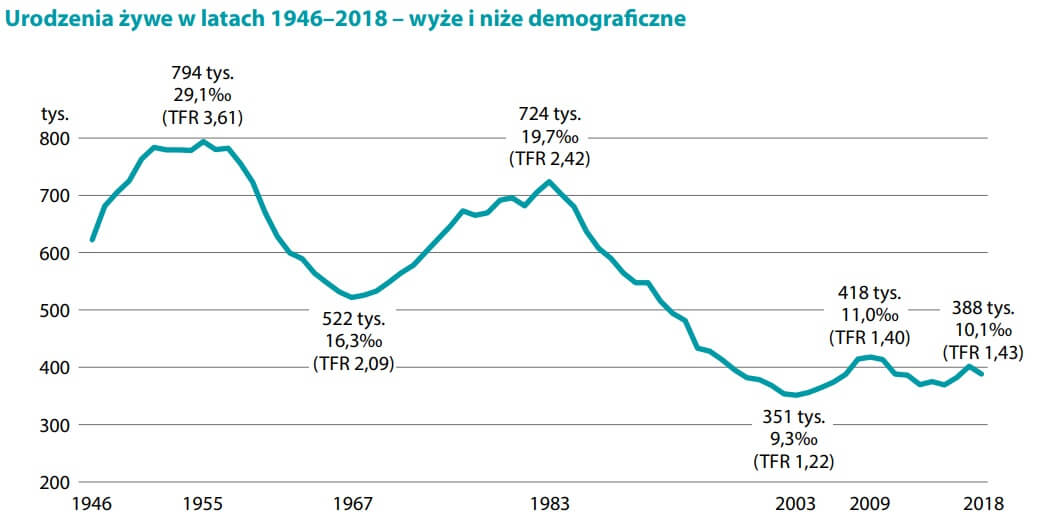
Źródło: Obserwator Gospodarczy
Na stronie Państwowego Instytutu Higieny w artykule pt. „Jak często NOP występują w Polsce i gdzie można to sprawdzić?” czytamy:
-
Populacja poddawana szczepieniom w Polsce jest liczna, dlatego każdego roku rejestrowanych jest 2000- 3000 niepożądanych odczynów poszczepiennych (NOP);
-
Jeden NOP występuje średnio raz na 10.000 podanych dawek szczepionki;
-
Częstość występowania NOP zależy od rodzaju szczepionki;
-
Ciężkie NOP występują niezwykle rzadko,tzn. ok. 0,1% w odniesieniu do zgłoszonych NOP w danym roku;
Oraz
Przykłady częstości występowania NOP:
-
Reakcje miejscowe po podaniu szczepionki MMR (przeciw odrze, śwince i różyczce) występują z częstością 1 na 10 podanych dawek;
Z kolei w artykule pt. „Ryzyko związane ze szczepieniami i chorobami, którym zapobiegają – cz. 6: odra, świnka i różyczka” na stronie Medycyna Praktyczna czytamy:
| Tabela 8. Częstość zdarzeń i reakcji niepożądanych po szczepieniu MMR | |
| Gorączka | 16,67/100 dawek |
| gorączka >39°C | 5–15/100 dawek |
| osutka skórna odropodobna | 5/100 dawek |
| przemijający ból stawów | do 25/100 daweka |
| objawy zapalenia stawów | 10–12/100 daweka |
| obrzęk ślinianki przyusznej | 1–1,33/100 dawek |
| Małopłytkowość | 2,6/100 000 dawek |
| drgawki gorączkowe | 0,33/1000 dawek |
| ciężkie reakcja alergiczne | ok. 1/1 000 000 dawek |
| drgawki bez gorączki | nie zwiększa ryzyka |
| Padaczka | nie zwiększa ryzyka |
| encefalopatia, zapalenie mózgu | nie zwiększa ryzyka |
| Autyzm | nie zwiększa ryzyka |
| SSPE | nie zwiększa ryzyka |
| zespół Guillaina i Barrégo | nie zwiększa ryzyka |
| nieswoiste zapalenie jelit | nie zwiększa ryzyka |
| a głównie u młodych kobiet SSPE – podostre stwardniające zapalenie mózgu |
|
Podsumowanie ilości NOPów zarejestrowanych w tym badaniu:
*50% i 47.9% [1 na 2 klientów] badanych zgłosiło wystąpienie działań niepożądanych.
*Z takich ciekawszych NOPów, to 6.1% i 6.6% [1 na 16 klientów] badanych klientów doświadczyło działań niepożądanych 3 stopnia w ciągu 42 dni.
*2.1% i 1.9% [1 na 50 klientów] dzieci doświadczyło wystąpienia poważnej niepożądanej reakcji [SAE].
*10% [1 na 10 klientów] dzieci, które dostały nową szczepionkę MMR wylądowało na szpitalnej izbie przyjęć.
*3.4% i 3.7% [1 na 28 klientów] dzieci skończyło Nowym Przypadkiem Choroby Przewlekłej. W ciągu 180 dni pojawiały się Nowe Przypadki Choroby Przewlekłej (New Onset Chronic Disease). Nowe przypadki choroby przewlekłej, co oznacza, że to konkretne dziecko nie chorowało wcześniej na tę chorobę przewlekłą. Zatem nie są to nawet poważne działania niepożądane [SAE], to są dzieci, które od teraz będą cierpiały na chorobę przewlekłą, która prawdopodobnie będzie im towarzyszyła do końca ich życia.
Autorzy tej publikacji piszą, że „wyników nie można uogólnić na dzieci, które nie spełniały kryteriów włączenia do badania”, i mają racje, bo do badań wybiera się takie ludzkie szczury laboratoryjne, żeby nie psuły wyników, a w realnym świecie przeciwskazania do szczepienia praktycznie nie występują, więc odsetek poszkodowanych w populacji ogólnej będzie jeszcze większy.
Szokujące wyniki badań szczepionki MMR. Powoduje chorobę górnych dróg oddechowych i przewodu pokarmowego – Del Bigtree [1978]
W USA rejestruje się mniej niż 1% NOPów – Harvard Pilgrim Health Care
Wytyczne Dotyczące Przedklinicznych Badań Farmakologicznych i Toksykologicznych Szczepionek – EMA
Czy na pewno szczepionki to najlepiej przebadane produkty firm farmaceutycznych? Sprawdźmy.
Immunogenność i bezpieczeństwo szczepionki przeciwko odrze, śwince i różyczce podawanej jako pierwsza dawka dzieciom w wieku od 12 do 15 miesięcy: badanie zgodności partii szczepionki z randomizacją typu non-inferiority [Nie-Niższe] fazy III
Streszczenie
Tło: MMR II (M-M-R II [Merck & Co, Inc.]) jest obecnie jedyną szczepionką przeciwko odrze, śwince i różyczce (MMR) licencjonowaną w Stanach Zjednoczonych. Druga szczepionka MMR zminimalizowałaby potencjalne ryzyko niedoboru lub opóźnień w dostawach szczepionki. W niniejszym badaniu oceniliśmy immunogenność i bezpieczeństwo innej szczepionki MMR (MMR-RIT [Priorix, GlaxoSmithKline]) w porównaniu z immunogennością i bezpieczeństwem szczepionki MMR II u dzieci w wieku od 12 do 15 miesięcy, które otrzymały pierwszą dawkę tej szczepionki.
Metody: W omawianym badaniu klinicznym zgodności partii szczepionek z zastosowaniem metody ślepej próby wobec obserwatora typu non-inferiority fazy III (ClinicalTrials.govidentifier NCT01702428) 5.003 zdrowych dzieci zostało losowo wyznaczonych do otrzymania pierwszej dawki szczepionki MMR-RIT (1 z 3 partii produkcyjnych) lub MMR II wraz z innymi rutynowymi szczepionkami zalecanymi dla dzieci w tym wieku. Dokonaliśmy oceny immunogenności wszystkich szczepionek pod względem stężenia przeciwciał (za pomocą testu immunoenzymatycznego bądź stosując elektrochemiluminescencję) i/lub wskaźników odpowiedzi serologicznej 43 dni po zaszczepieniu. Oceniliśmy także reaktogenność i bezpieczeństwo tych szczepionek.
Wyniki: Odpowiedź immunologiczna po zaszczepieniu szczepionką MMR-RIT była zdecydowana i równoważna względem odpowiedzi immunologicznej w następstwie podania szczepionki MMR II. Immunogenność tych 3 partii produkcyjnych szczepionki MMR-RIT była stała; u ponad 97% dzieci wystąpiła odpowiedź serologiczna na składniki szczepionki MMR. Szczepionki podane jednocześnie wywołały podobną odpowiedź immunologiczną zarówno w grupie zaszczepionej MMR-RIT, jak i w tej, która otrzymała szczepionkę MMR II. Obie szczepionki przyniosły skutek w postaci porównywalnych profilów reaktogenności, przy czym nie zaobserwowano żadnych problemów związanych z bezpieczeństwem.
Wnioski: Gdyby szczepionka MMR-RIT uzyskała licencję, mogłaby stanowić ważną alternatywną metodę zapobiegania odrze, śwince i różyczce u dzieci w Stanach Zjednoczonych i zredukowałaby potencjalne ryzyko niedoboru zapasów szczepionki.
Jedyną szczepionką skojarzoną przeciwko odrze, śwince i różyczce (MMR) dostępną obecnie w Stanach Zjednoczonych jest MMR II (M-M-R, Merck & Co, Inc.)[1]. Rutynowe szczepienie dwiema dawkami szczepionki MMR II doprowadziło do eliminacji endemicznej odry i różyczki oraz spadku liczby przypadków świnki o >99% w porównaniu z liczbą zachorowań w epoce przedszczepionkowej[2-4]. Jednak choroby te są nadal obecne w populacji, na co wskazuje rosnąca liczba epidemii odry i świnki w ostatnich latach[4, 5]. Dysponowanie jeszcze jedną licencjonowaną szczepionką w Stanach Zjednoczonych zmniejszyłoby ryzyko dla zdrowia publicznego związane z potencjalnymi przerwami w dostawach szczepionki MMR II.
Szczepionka MMR-RIT (Priorix, GlaxoSmithKline [GSK]) to skojarzona szczepionka MMR, która po raz pierwszy uzyskała licencję w latach 90-tych poza Stanami Zjednoczonymi i jest obecnie dostępna w ponad 100 krajach, gdzie ma wskazanie do stosowania i podaje się ją według podobnego zalecanego schematu, co szczepionkę MMR II[6]. Wymogi regulacyjne w Stanach Zjednoczonych różnią się obecnie od obowiązujących w czasie, kiedy szczepionka MMR-RIT uzyskała licencję po raz pierwszy, zaś pełny program rozwoju na rzecz nadania licencji szczepionce MMR-RIT w Stanach Zjednoczonych jest w toku.
W ramach wspomnianego programu przeprowadziliśmy badanie fazy III, aby ocenić immunogenność i bezpieczeństwo szczepionki MMR-RIT w porównaniu ze zdolnością szczepionki MMR do wywołania odpowiedzi immunologicznej, kiedy podaje się ją jako pierwszą dawkę dzieciom w wieku od 12 do 15 miesięcy. Celem omawianego badania była również ocena spójności 3 partii produkcyjnych szczepionki MMR-RIT, jak też odpowiedzi immunologicznej na rutynowe szczepionki podawane jednocześnie zgodnie z amerykańskim programem szczepień.
Metody
Typ badania i uczestnicy
Niniejsze badanie było badaniem zgodoności partii szczepionki typu non-inferiority fazy IIIa, z zastosowaniem metody ślepej próby wobec obserwatora, z randomizacją, kontrolowanym (ClinicalTrials.gov NCT01702428), prowadzonym od listopada 2012 do kwietnia 2015 roku w 92 ośrodkach w Estonii, Finlandii, Meksyku, Hiszpanii i Stanach Zjednoczonych.
Losowo wyznaczyliśmy dzieci w wieku od 12 do 15 miesięcy w stosunku 3:1 do otrzymania 1 dawki bądź to 1 z 3 partii produkcyjnych szczepionki MMR-RIT bądź 1 z 2 partii produktu handlowego szczepionki kontrolnej MMR II (Rycina Dodatkowa 1). Wszystkie dzieci otrzymały jako szczepionkę towarzyszącą pierwszą dawkę szczepionki przeciwko wirusowemu zapaleniu wątroby typu A (HAV [Havrix, GSK]) oraz szczepionkę przeciwko ospie wietrznej (VV [Varivax, GSK]), przy czym dzieci w Stanach Zjednoczonych otrzymały ponadto czwartą dawkę trzynastowalentnej skoniugowanej szczepionki przeciwko pneumokokom (PCV13 [Prevnar 13, Pfizer, Inc.]). Badanie obejmowało wizyty osobiste w dniu 0 (D0) i D42 oraz rozmowę telefoniczną w D180. Podaliśmy szczepionki w D0 i pobraliśmy próbki krwi (5 mL na dziecko i wizytę), aby ocenić odpowiedzi przeciwciał w D0 i D42.
Deklaracja Helsińska. Etyczne zasady prowadzenia eksperymentów medycznych z udziałem ludzi
Przeprowadziliśmy badanie zgodnie z Deklaracją Helsińską i wytycznymi Międzynarodowej Konferencji ds. Harmonizacji: Dobra Praktyka Kliniczna. Protokół badawczy został zweryfikowany i zatwierdzony przez niezależne komisje etyczne lub instytucjonalną komisję rewizyjną w zależności od wymogów. Rodzice lub przedstawiciel prawny dostarczyli pisemną świadomą zgodę na udział dziecka w badaniu przed zapisaniem go do badania.
Zakwalifikowaliśmy dzieci w wieku od 12 do 15 miesięcy o stabilnym stanie zdrowia. Wyłączyliśmy dzieci z historią mówiącą o, znanym narażeniem na lub wcześniej zaszczepione przeciwko odrze, śwince, różyczce, ospie wietrznej, półpaścowi i/lub wirusowemu zapaleniu wątroby typu A, z historią mówiącą o alergii bądź reakcjach alergicznych lub też cierpiących na chorobę o ostrym przebiegu (Patrz “Inne krytetria dopuszczenia do badania” w części Metody Dodatkowe w Materiałach Uzupełniających).
Randomizacja i ślepe próby
Stratyfikowaliśmy algorytm randomizacji według kraju oraz zastosowaliśmy procedurę minimalizacji dla zapewnienia prawidłowej równowagi w grupach leczenia w każdym ośrodku. Dokonaliśmy przydziału leczenia w każdym ośrodku wykorzystując centralny system randomizacyjny w Internecie.
Badanie prowadzone było metodą podwójnej ślepej próby w celu oceny zgodności partii szczepionki MMR-RIT oraz metodą ślepej próby wobec obserwatora w celu porównania szczepionek MMR-RIT i MMR II. Ze względu na potencjalne różnice koloru pomiędzy rekonstruowaną szczepionką MMR-RIT i MMR II, pracownicy zajmujący się tymi szczepionkami nie uczestniczyli w ocenie punktów końcowych badania.
Szczepionki uwzględnione w badaniu
Skład wykorzystanych szczepionek MMR został przedstawiony w Tabeli Dodatkowej 1. Skład szczepionek HAV, VV i PCV13 został przedstawiony wcześniej[7-9]. Szczepionki MMR wstrzyknięto podskórnie w lewy triceps; VV podskórnie w prawy triceps; HAV domięśniowo w prawe przednio-boczne udo; zaś PCV13 (wyłącznie dzieciom w Stanach Zjednoczonych) domięśniowo w lewe przednio-boczne udo.
Ocena immunogenności
Oceniliśmy przeciwciała immunoglobuliny G (IgG) przeciwko odrze, śwince, różyczce, wirusowemu zapaleniu wątroby typu A oraz wirusowi półpaśca (VZV) wykorzystując komercyjne zestawy testów immunoenzymatycznych (Patrz “Ocena immunogenności” w części Metody Dodatkowe w Materiałach Uzupełniających). Wyliczyliśmy przeciwciała IgG przeciwko serotypom Streptococcus pneumoniae 1, 3,4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F i 23F za pomocą własnego testu elektrochemiluminescencyjnego (GSK, Wavre, Belgia, dane dotyczące walidacji, dane nieopublikowane).
Określiliśmy odpowiedź serologiczną jako stężenie przeciwciał w D42 ≥ 200 mIU/mL przeciwko odrze, ≥10 modułów testu immunoenzymatycznego (EU)/mL dla przeciwciał przeciwko śwince (wykorzystane w poprzednich badaniach [10]), ≥ 10IU/mL dla przeciwciał przeciwko różyczce i ≥ 75 mIU/mL dla przeciwciał przeciwko VZV u dzieci, które były seronegatywne w D0 (Progi seronegatywności przedstawiono w “Ocenie immunogenności” w części Metody Dodatkowe w Materiałach Uzupełniających). Odpowiedź serologiczna na wirusa zapalenia wątroby typu A została zdefiniowana jako stężenie przeciwciał przeciwko wirusowi zapalenia wątroby typu A w D42 ≥15 mIU/mL u dzieci ze stężeniem przeciwciał <15 mIU/mL w D0 lub przeciwnie ≥dwukrotnemu wzrostowi stężenia przeciwciał w D42. W celu określenia odpowiedzi serologicznych zastosowaliśmy progi stężenia przeciwciał zaakceptowane przez Agencję Żywności i Leków (ang. Food and Drug Administration, FDA) jako punkty końcowe definiujące znaczącą klinicznie zmianę w mianie przeciwciał; dla przeciwciał przeciwko VZV FDA przyjęła próg stosowany zwykle we wcześniejszych badaniach[11]. Próg odpowiedzi serologicznej dla odry oparto na porównaniu z mianami w II i III Międzynarodowym Standardzie Światowej Organizacji Zdrowia. W kontekście badania nad szczepionkami typu head-to-head opracowanego w celu wykazania równoważności, FDA uznała wyżej wymienione progi za możliwe do przyjęcia poziomy odpowiedzi immunologicznej.
Reaktogenność i ocena bezpieczeństwa
Zarejestrowaliśmy wytypowane miejscowe zdarzenia niepożądane (ang. adverse events, AEs) takie jak ból, zaczerwienienie i opuchlizna w miejscu iniekcji szczepionki MMR od D0 do D3 (Rycina Dodatkowa 1). Ustaliliśmy wytypowane ogólne AEs takie jak senność, utrata apetytu oraz rozdrażnienie od D0 do D14, jak też gorączkę (temperaturę ≥38.0°C), wysypkę, opuchliznę ślinianki przyusznej/gruczołów ślinowych, drgawki gorączkowe lub objawy podrażnienia opon mózgowych od D0 do D42.
Udokumentowaliśmy zgłaszane spontanicznie AEs od D0 do D42 oraz AEs, które były powodem wizyty na oddziale ratunkowym, poważne AEs (ang. serious AEs, SAEs) i nowo rozpoznane choroby przewlekłe (ang. new-onset chronic disease, NOCD) (Tabela Dodatkowa 6) w ciągu całego okresu badania (D0-D180).
Sklasyfikowaliśmy intensywność wszystkich wytypowanych AEs od 0 do 3 (Definicje AEs poziomu 3 znajdują się w przypisie do Ryciny Dodatkowej 2). Uznaliśmy wszystkie wytypowane miejscowe AEs jako związane przyczynowo ze szczepieniem, zaś badający ocenił przyczynowość innych AEs.
Analizy statystyczne
Planowaliśmy zarejestrować 5.000 dzieci, aby zagwarantować randomizację 1.250 dzieci w każdej grupie, która otrzymała szczepionkę MMR-RIT i 625 dzieci w każdej grupie, która otrzymała szczepionkę MMR II. Zakładając 20-procentowy wskaźnik niemożliwy do oceny w kohorcie zgodnej z protokołem (ang. according to protocol, ATP) pod względem immunogenności, oszacowaliśmy, że 4.000 dzieci (1.000 w każdej grupie, którą zaszczepiono MMR-RIT i 500 w każdej grupie zaszczepionej MMR II) będzie można ocenić. Dane dla dwóch partii MMR II zostały połączone dla wszystkich analiz.
Badanie miało 5 głównych celów. Pierwszym i drugim głównym celem było wykazanie zgodności 3 partii szczepionki MMR-RIT pod względem wskaźników odpowiedzi serologicznej (ang. seroresponse rates, SRRs) (cel 1) oraz dostosowanie geometrycznych średnich stężeń przeciwciał (ang. geometric mean concentrations, GMCs) (cel 2) dla odry, świnki i różyczki w D42 (kryteria powodzenia, przedział ufności o wartości 95% [ang. confidence interval, CI] dla różnicy w SRRs między partiami mieścił się [-5%;5%] w określonym wcześniej marginesie, zaś 95-procentowy CI dla współczynnika GMC między patiami mieścił się [0,67; 1.5] w określonym wcześniej marginesie dla wszystkich 3 antygenów). Trzecim i czwartym głównym celem było wykazanie równoważności szczepionki MMR-RIT (połączone partie) z MMR II pod względem SRRs (cel 3) oraz przeciwciała GMCs (cel 4) dla odry, świnki i różyczki w D42 (kryteria powodzenia, dolna granica [ang. lower limit, LL] 95-procentowego CI dla różnicy między grupami w SRRs [połączone szczepionki MMR-RIT – MMR II] wynosiła -5% lub więcej, zaś LL 95-procentowego CI dla dostosowanego współczynnika GMC [szczepionki MR-RIT/MMR II] wynosiła ≥0,67 dla wszystkich 3 antygenów). Piątym głównym celem było wykazanie akceptowalnej odpowiedzi immunologicznej na szczepionkę MMR-RIT pod względem SRR na odrę, świnkę i różyczkę w D42 (kryterium powodzenia, LL 95-procentowego CI dla SRR w grupie połączonych szczepionek MMR-RIT wynosiła ≥90% dla wszystkich 3 antygenów).
Drugorzędne cele niniejszego badania uwzględniały ocenę immunogenności podawanych jednocześnie szczepionek HAV, VV i PCV13 pod względem SRRs i/lub GMCs oraz ocenę bezpieczeństwa i reaktogenności szczepionek MMR-RIT i MMR II (Tabele Dodatkowe 3-6 oraz Rycina 2). Wszystkie cele związane z immunogennością miały dużą siłę statystyczną z wyjątkiem oceny immunogenności szczepionki HAV pod względem SRRs.
Wszystkie badania immunogenności szczepionki MMR zostały przeprowadzone na kohorcie ATP dla immunogenności obejmującej dzieci, dla których dostępne były wyniki serologii dla co najmniej 1 antygenu przed szczepieniem i po szczepieniu, które miały steżęnie przed szczepieniem poniżej limitu badania dla co najmniej 1 z antygenów szczepionki MMR, które nie spełniały kryteriów eliminacji do D42 i które przestrzegały procedur określonych w protokole. Zbadaliśmy immunogenność szczepionek podawanych jednocześnie w podgrupach dzieci w kohorcie ATP pod względem immunogenności (Patrz “Analizy statystyczne” w części Metody Dodatkowe w Materiałach Uzupełniających).
Dla każdej z 3 oddzielnych partii szczepionki MMR-RIT, dla połączonych partii szczepionki MMR-RIT oraz dla grupy zaszczepionej MMR II podsumowaliśmy GMCs przeciwciał przeciwko odrze, śwince i różyczce w D42 wraz z ich 95-procentowymi CIs oraz SRRs (określonymi jako procent dzieci wykazujących odpowiedź serologiczną na te przeciwciała w D42) z ich dokładnie 95-procentowymi CIs. Następnie zestawiliśmy w tabeli, dla każdego antygenu, różnicę w SRRs pomiędzy grupami (połączone szczepionki MMR-RIT – MMR II) z ich standaryzowanymi asymptotycznymi 95-procentowymi CIs oraz dostosowane wskaźniki GMC między grupami (połączone szczepionki MMR-RIT/MMR II) wraz z ich 95-procentowymi CIs. Aby ocenić zgodność 3 partii MMR-RIT, obliczyliśmy różnice w SRRs (np. partia szczepionki MMR-RIT 1 – partia szczepionki MMR-RIT 2) wraz z ich standardyzowanymi asymptotycznymi 95-procentowymi CIs. Aby ocenić odpowiedzi immunologiczne wywołane przez szczepionki podawane jednocześnie, obliczyliśmy GMCs dla przeciwciał przeciwko VZV, wirusowi zapalenia wątroby typu A oraz serotypy S pneumonia 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F i 23F w D42 wraz z ich 95-procentowymi CIs. Obliczyliśmy SRRs na VZV i wirus zapalenia wątroby typu A w D42 wraz z ich dokładnymi 95-procentowymi CIs. W celu sprawdzenia określonych uprzednio kryteriów równoważności obliczyliśmy dostosowane wskaźniki GMC pomiędzy grupami (szczepionki MMR-RIT/MMR II) wraz z ich 95-procentowymi CIs dla wszystkich szczepionek podawanych jednocześnie oraz różnicę w SRRs między grupami (połączone szczepionki MMR-RIT/MMR II) wraz z ich asymptotycznymi standardyzowanymi 95-procentowymi CIs dla przeciwciał przeciwko VZV.
Badania dotyczące bezpieczeństwa i reaktogenności przeprowadzono na całej zaszczepionej kohorcie, która obejmowała wszystkie dzieci z ≥1 udokumentowanym przyjęciem szczepionki MMR-RIT albo MMR II. Zestawiliśmy w tabeli liczbę i procent dzieci (z dokładnymi 95-procentowymi CIs) zgłaszających każdą poddawaną ocenie zmienną dotyczącą bezpieczeństwa i reaktogenności.
Analizy statystyczne zostały wykonane z wykorzystaniem programu SAS wersja 9.3 (SAS, Inc, Cary, North Carolina) w systemie SAS Drug Development wersja 4.3 (Patrz “Analizy statystyczne” w części Metody Dodatkowe w Materiałach Uzupełniających).
Wyniki
Uczestnicy badania i charakterystyka demograficzna
Zapisaliśmy 5016 dzieci, z których 5003 zostało wyznaczonych losowo i otrzymało pojedynczą dawkę z partii szczepionki MMR-RIT 1 (n = 1239), partii szczepionki MMR-RIT 2 (n = 1232) lub partii szczepionki MMR-RIT 3 (n = 1243) bądź MMR II (n = 1289) (Rycina 1). W sumie badanie zakończyło 4759 dzieci; głównymi powodami przerwania uczestnictwa były utrata możliwości dalszego kontaktu i zgoda na wycofanie się niespowodowana AE. Ogólnie właściwości demograficzne były podobna u dzieci, które otrzymały szczepionki MMR-RIT i MMR II (Tabela 1).
Tabela 1. Właściwości demograficzna uczestników badania (cała zaszczepiona kohorta)
| Właściwość | Grupa zaszczepiona MMR-RIT (n = 3714) | Grupa zaszczepiona MMR II (n = 1289) |
| Wiek w chwili przyjęcia 1.dawki (średni [odchylenie standardowe, ang. standard deviation, SD]) (w miesiącach) | 12,3 (0,7) | 12,3 (0,7) |
| Płeć (n [%])a | ||
| Żeńska | 1816 (48,9) | 618 (47,9) |
| Pochodzenie geograficzne (n [%]) | ||
| Rasa biała kaukaska/europejskie | 2814 (75,8) | 970 (75,3) |
| Rasa afrykańska/afro-amerykańska | 169 (4,6) | 70 (5,4) |
| Rasa azjatycka | 127 (3,4) | 46 (3,6) |
| Indianin amerykański lub rodowity mieszkaniec Alaski | 95 (2,6) | 31 (2,4) |
| Inne | 509 (13,7) | 172 (13,3) |
Skrót: SD, odchylenie standardowe.
aPodane procenty dotyczą dzieci w tej kategorii.
Rycina 1.
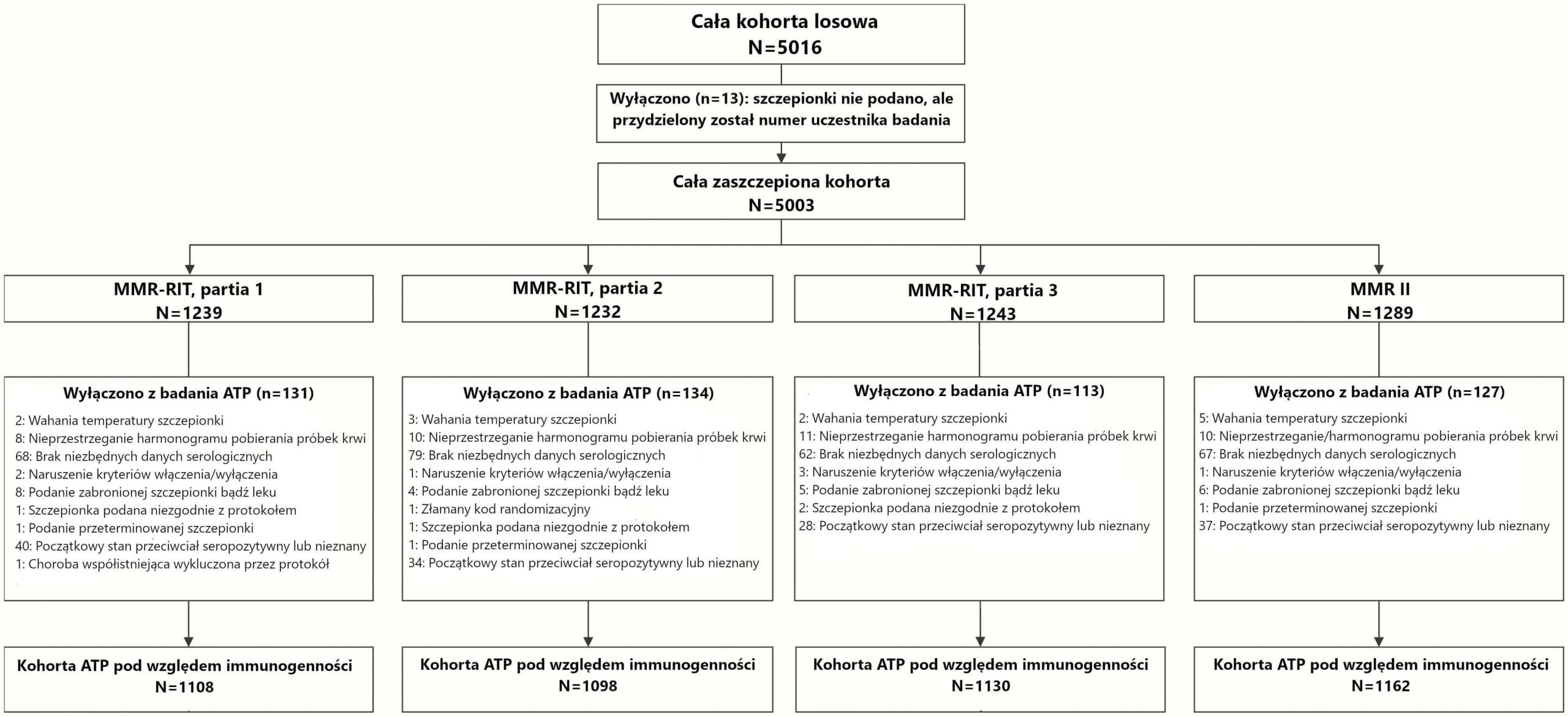
Schemat blokowy uczestników badania. Skróty: ATP, zgodny z protokołem; N, liczba dzieci; n, liczba dzieci w danej kategorii.
Oceny immunogenności
Równoważność odpowiedzi immunologicznej na MMR-RIT z odpowiedzią immunologiczną na MMR II
W D24, SRRs grupy zaszczepionej MMR-RIT (połączone partie) wynosiły 92,2% dla przeciwciał przeciwko odrze, 98,4% dla przeciwciał przeciwko śwince oraz 97,3% dla przeciwciał przeciwko różyczce (Tabela 2). SRRs na składniki szczepionki MMR zaobserwowane po zaszczepieniu MMR-RIT zostały uznane za akceptowalne odpowiedzi immunologiczne i były równoważne z SRRs w grupie zaszczepionej MMR II (kryteria spełnione; szczegóły znajdują się w “Analizach Statystycznych”) (Tabela 2).
Tabela 2.
Równoważność szczepionki MMR-RIT (połączone partie) z MMR II pod względem SRRs przeciwko odrze, śwince i różyczce oraz dostosowanych GMCs i możliwych do przyjęcia odpowiedzi immunologicznych na szczepionkę MMR-RIT (połączone partie) w Dniu 42 (kohorta zgodna z protokołem pod względem immunogenności)a
| Kryterium | MMR-RITb | MMR II | Różnica w SRRs (SRR dla połączonych partii MMR-RIT – MMR II)c lub dostosowanym współczynniku GMC (GMC dla połączonych partii MMR-RIT/MMR II)d |
| SRR (% [95% CI]) | |||
| przeciwko odrze | 98,2 (97,6 do 98,6) | 98,0 (97,0 do 98,7) | 0,18 (-0,68 do 1,25) |
| przeciwko śwince | 98,4 (97,9 do 98,8) | 97,6 (96,5 do 98,4) | 0,81 (-0,10 do 1,96) |
| przeciwko różyczce | 97,3 (96,7 do 96,9) | 98,5 (97,6 do 99,1) | -1,15 (-2,00 do –0,15) |
| Dostosowane GMCs (95% CI) | |||
| przeciwko odrze | 3165,2 | 3215,4 | 0,98 (0,93 do 1,05) |
| przeciwko śwince | 76,4 | 73,0 | 1,05 (0,99 do 1,11) |
| przeciwko różyczce | 52,5 | 60,0 | 0,87 (0,83 do 0,92) |
Skróty: CI, przedział ufności; SRR, wskaźnik odpowiedzi serologicznej (określony jako procent pacjentów początkowo seronegatywnych ze stężeniem powyżej odpowiedzi serologicznej)
aDostosowane GMC to geometryczne średnie stężenie przeciwciał z analizy modelu wariancji stężeń przetworzonych logarytmicznie z grupą badaną i krajem jako czynnikami; próg dla każdego przeciwciała wynosił 200 mIU/mL dla przeciwciał przeciwko odrze, 10 EU/mL dla przeciwciał przeciwko śwince i 10 IU/mL dla przeciwciał przeciwko różyczce. Liczba pacjentów, dla których dostępne były zarówno wyniki dotyczące okresu przed szczepieniem, jak i po szczepieniu wynosiła 3.248 (szczepionka MMR-RIT) i 1.137 (szczepionka MMR II) dla przeciwciał przeciwko odrze, 3.187 (MMR-RIT), 1.107 (MMR II) dla przeciwciał przeciwko śwince oraz 3.245 (MMR-RIT) i 1.135 (MMR II) dla przeciwciał przeciwko różyczce.
bOdpowiedź immunologiczną na szczepionkę MMR-RIT uznawano za akceptowalną, jeśli dolna granica 95-procentowego CI dla SRR w grupie zaszczepionej MMR-RIT (połączone partie) była ≥90% dla przeciwciał przeciwko odrze, śwince i różyczce.
cStandaryzowane asymptotyczne 95-procentowe CI.
d95-procentowe CI dla dostosowanego współczynnika GMC (analiza modelu wariancji: dostosowanie dla kraju – wariancja zbiorcza w ˃2 grupach). Wartości zapisane pogrubionym drukiem wskazują, że spełnione zostały kryteria równoważności: dolna granica 95-procentowego CI dla różnicy w SRRs (połączone partie MMR-RIT – MMR II) wynosiła -5% lub więcej, zaś dolna granica dla 95-procentowego CI dla dostosowanego współczynnika GMC (połączone partie MMR-RIT – MMR II) była ≥0,67.
GMCs przeciwciał przeciwko składnikom szczepionki MMR były podobne w grupach zaszczepionych szczepionkami MMR-RIT i MMR II (Tabela 2). Szczepienie MMR-RIT było równoważne z podaniem MMR II pod względem GMCs przeciwciał przeciwko odrze, śwince i różyczce (spełnione kryterium: szczegóły znajdują się w Analizach statystycznych).
Zgodność partii szczepionki MMR-RIT
Dzieci w 3 grupach zaszczepionych szczepionką MMR-RIT miały wysokie SRRs; przeciwciała przeciwko odrze wahały się od 97,8% do 98,6%, przeciwko śwince od 98,0% do 98,6%, zaś przeciwko różyczce od 97,1% do 97,7%. Te 3 partie były zgodne pod względem SRRs i GMCs dla wszystkich składników szczepionki MMR i spełniały ustalone wcześniej kryteria (Tabela Dodatkowa 2).
Odpowiedzi immunologiczne na szczepionki podawane jednocześnie
Poddaliśmy ocenie immunogenność szczepionki VZV u 2.120 dzieci zapisanych do badania w Stanach Zjednoczonych (podgrupa zaszczepiona szczepionką VZV). Dodatkowo przeanalizowaliśmy także immunogenność szczepionki HAV u 1.081 spośród tych 2.120 dzieci (podgrupa zaszczepiona HAV) oraz immunogenność szczepionki PCV13 u pozostałych 1.039 dzieci (podgrupa zaszczepiona PCV13).
W D42 ≥90,2% dzieci/tych dzieci miało odpowiedź serologiczną przeciwko szczepionce VV (Tabela Dodatkowa 3). SRR na szczepionkę VV w grupie zaszczepionej MMR-RIT była równoważna z odpowiedzią serologiczną w grupie zaszczepionej MMR II. Stężenia przeciwciał przeciwko szczepionce VZV były również podobne w badanych grupach, zaś GMCs przeciwko szczepionce VZV, porównując grupy zaszczepione MMR-RIT i MMR II, były równoważne (Tabela Dodatkowa 3).
SRRs na szczepionkę HAV wynosiły 88,8% w grupie zaszczepionej szczepionką MMR-RIT oraz 87,1% w grupie zaszczepionej MMR II (Tabela Dodatkowa 3). GMCs przeciwciał przeciwko wirusowi wirusowego zapalenia wątroby typu A były zbliżone w grupach poddanych badaniu, zaś stężenia przeciwciał w grupie zaszczepionej MMR-RIT były równoważne ze stężeniami w grupie MMR II, której podano MMR II (Tabela Dodatkowa 3).
Stężenia przeciwciał przeciwko składnikom szczepionki PCV13 były porównywalne w badanych grupach, zaś GMCs w grupie zaszczepionej MMR-RIT były równoważne z GMCs w grupie, która przyjęła MMR II (Tabela Dodatkowa 4).
Reaktogenność i bezpieczeństwo
Częstotliwość zgłaszanych wytypowanych miejscowych i ogólnych AEs była podobna u dzieci w połączonych grupach zaszczepionych szczepionkami MMR-RIT i MMR II. Najczęściej zgłaszanym wytypowanym miejscowym zdarzeniem niepożądanym [AE] w obu grupach był ból w miejscu iniekcji (25,9% w grupie zaszczepionej MMR-RIT i 28,1% w grupie zaszczepionej MMR II), a w następnej kolejności zaczerwienienie (24,5% w grupie zaszczepionej MMR-RIT i 25,2% w grupie zaszczepionej MMR II)(Tabela Dodatkowa 2).
Rozdrażnienie było najczęściej zgłaszanym wytypowanym ogólnym AE (63,3% w grupie zaszczepionej MMR-RIT i 65,9% w grupie zaszczepionej MMR II).(Tabela Dodatkowa 2).
Najwięcej przypadków gorączki zgłoszono w okresie od D5 do D12 (Rycina 2) i były one porównywalne w grupach (19,7% w grupie zaszczepionej MMR-RIT i 18,2% w grupie zaszczepionej MMR II) (Rycina Dodatkowa 2); u ≤13,9% dzieci wystąpiła gorączka uznana za przyczynowo związaną ze szczepieniem, zaś u ≤1,4% miało gorączkę stopnia 3. Częstość występowania gorączki w okresie od D0 do D42 wynosiła 34,7% w grupie zaszczepionej szczepionką MMR-RIT i 33,1% w grupie zaszczepionej MMR II; gorączkę uznano za związaną przyczynowo ze szczepieniem u ≤18,9% dzieci, zaś ≤2,9% dzieci miało gorączkę stopnia 3. Dzienne występowanie oraz wysokość temperatury w ciągu 43 dni po szczepieniu były podobne we wszystkich 3 grupach zaszczepionych poszczególnymi partiami szczepionki MMR-RIT i w grupie, której podano MMR II (Rycina 2).
Rycina 2.
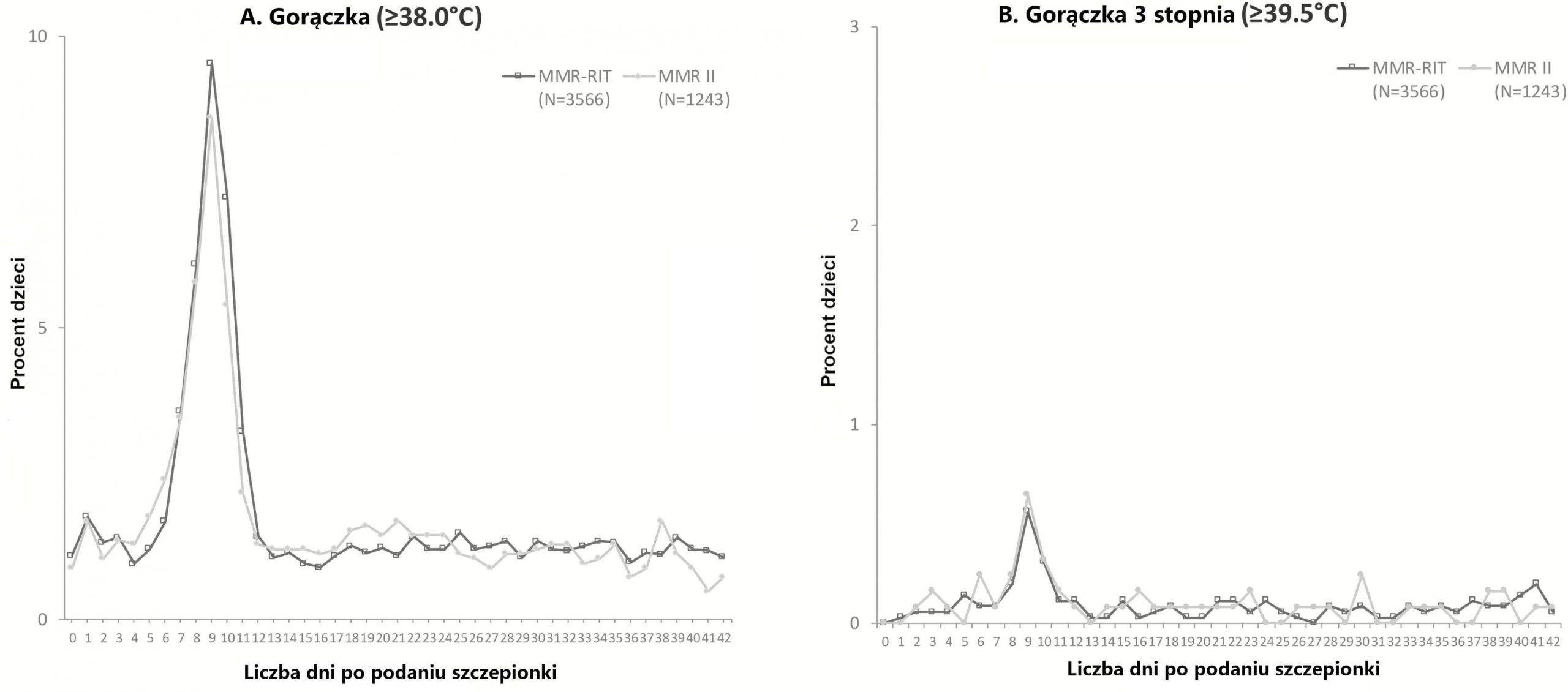
Występowanie gorączki od dnia 0 do dnia 42 po zaszczepieniu (cała zaszczepiona kohorta). Dla celów wizualizacji skala osi y jest inna na każdym wykresie. Miejscową i uogólnioną wysypkę zgłaszano z taką samą częstotliwością w obu badanych grupach (Tabela Dodatkowa 5). Wysypka przypominająca odrę/różyczkę wystąpiła u ≤6,6% dzieci, natomiast wysypka przypominająca ospę wietrzną pojawiła się u ≤7% dzieci. Od D0 do D42, dla 10 (0,3%) dzieci z grupy zaszczepionej szczepionką MMR-RIT oraz 3 (0,2%) dzieci z grupy, która przyjęła MMR II, udokumentowano drgawki gorączkowe lub objawy podrażnienia oponowego (Tabela Dodatkowa 5); 4 przypadki drgawek gorączkowych lub wystąpienia objawów podrażnienia oponowego w grupie zaszczepionej MMR-RIT i 2 w grupie zaszczepionej MMR II wystąpiły w okresie od D5 do D12 po szczepieniu i zostały uznane za związane ze szczepieniem. Po poradę lekarską zgłoszono się w 10 przypadkach drgawek gorączkowych/objawów podrażnienia oponowego. W omawianym badaniu nie odnotowaliśmy żadnych epizodów obrzęku ślinianek przyusznych i gruczołów ślinowych.
Ustaliliśmy podobne przypadki wystąpienia niesprowokowanych AEs, SAEs, AEs, które doprowadziły do wizyty na ostrym dyżurze, a także nowo rozpoznane choroby przewlekłe [NOCDs] w grupie zaszczepionej szczepionką MMR-RIT i szczepionką MMR II (Tabela Dodatkowa 6). Niesprowokowane zdarzenia niepożądane stopnia 3 zgłoszono u ≤6,6% dzieci, poważne zdarzenia niepożądane [SAEs] u ≤2,1%. Nowo rozpoznane choroby przewlekłe [NOCDs] udokumentowano u 3,4% dzieci, które otrzymały szczepionkę MMR-RIT i u 3,7% dzieci, które otrzymały szczepionkę MMR II; najczęstszymi nowo rozpoznanymi chorobami przewlekłymi [NOCDs] były atopowe zapalenie skóry (0,7% w grupie zaszczepionej MMR-RIT, 0,5% w grupie zaszczepionej MMR II) i egzema (0,4% w grupie zaszczepionej MMR-RIT i 0,8% w grupie, która przyjęła MMR II). W omawianym badaniu nie wystąpił żaden przypadek zgonu.
Tabela uzupełniająca 6.
Częstość występowania niepożądanych odczynów (dzień 0–42), poważnych zdarzeń niepożądanych, zdarzeń niepożądanych skutkujących wizytami na izbie przyjęć oraz nowo rozpoznanymi chorobami przewlekłymi [NOCD] (dzień 0–180) (całkowita kohorta zaszczepiona).
| n (%) | MMR-RIT (N=3714) |
MMR II (N=1289) |
| Niepożądane AEs (≥1 objaw) | 1857 (50.0) | 618 (47.9) |
| 3 stopień | 225 (6.1) | 85 (6.6) |
| SAEs (jakiekolwiek, ≥1 SAE) | 77 (2.1) | 25 (1.9) |
| AEs skutkujące Pogowiem [ER] | 375 (10.1) | 134 (10.4) |
| NOCDs (jakiekolwiek, ≥1 NOCD) | 128 (3.4) | 48 (3.7) |
| AE – zdarzenie niepożądane; ER – ostry dyżur, pogotowie ratunkowe; N – liczba dzieci z udokumentowaną dawką; n (%), liczba (procent) dzieci zgłaszających zdarzenie niepożądane przynajmniej raz; NOCD – nowo pojawiające się choroby przewlekłe (patrz definicja w Pacjenci i metody); SAE – poważne AE.
Nieoczekiwany AE 3 stopnia to te, które uniemożliwiają normalne, codzienne czynności. |
||
Dyskusja
W analizowanym badaniu ustaliliśmy, że szczepienie szczepionką MMR-RIT wywołało silne odpowiedzi immunologiczne, które były równoważne z odpowiedziami immunologicznymi po zaszczepieniu szczepionką MMR II dzieci w wieku od 12 do 15 miesięcy. U ponad 97% spośród tych dzieci wystąpiła odpowiedź serologiczna przeciwko trzem składnikom szczepionki MMR-RIT. Ustaliliśmy również, że 3 partie MMR-RIT były zgodne pod względem SRRs i GMCs. Mimo że oszacowania punktowe dla odpowiedzi na składnik różyczki szczepionki MMR-RIT były nieco niższe niż w przypadku MMR II, dolna granica 95-procentowego CI była powyżej określonego wcześniej poziomu, GMC dla przeciwciał przeciwko różyczce było pięciokrotnie wyższe niż próg wynoszący 10IU/mL, zaś odpowiedź na różyczkę w przypadku MMR-RIT wykazywała statystyczną równoważność ze szczepionką MMR II. Dodatkowo ustaliliśmy, że odpowiedzi immunologiczne na szczepionki podawane jednocześnie (VV, HAV i PCV13) były podobne w dwóch grupach zaszczepionych MMR (MMR-RIT i MMR II). Mówiąc ogólnie, wyniki te pokazują, że MMR-RIT spełniała określone wcześniej kryteria dotyczące równoważności względem MMR II.
Uzyskane przez nas wyniki dotyczące immunogenności są zbliżone do wyników wcześniejszych badań uwzgledniających pierwszą dawkę tej szczepionki w odniesieniu do odpowiedzi serologicznych na 3 składniki szczepionki MMR[12, 13] oraz pod względem SRRs i GMCs[14, 15].
Profile reaktogenności tych dwóch szczepionek MMR były porównywalne i nie wykryliśmy żadnych nowych problemów związanych z bezpieczeństwem. Wartość szczytowa gorączki w okresie od D5 do D12 po zaszczepieniu była zgodna z wartością podawaną w wielu wcześniejszych sprawozdaniach[13, 16-19], a przypisuje się ją replikacji składnika odry w szczepionkach MMR. Szczepy wirusa odry w MMR-RIT i MMRII są różne; MMR-RIT zawiera szczep Schwarz, zaś MMR II szczep Edmonston-Enders (Moraten). Jednak szczepy te są identyczne na poziomie nukleotydów[20, 21], co jest zgodne z podobnymi profilami gorączki obserwowanymi w obu naszych zaszczepionych grupach. Szczep wirusa świnki w MMR-RIT to RIT 4385 wywodzący się ze szczepu Jeryl Lynn B użytego w szczepionce MMR II. Składnik Jeryl Lynn 1 jest identyczny w obu szczepach świnki na poziomie białek; istnieje tylko jedna cicha mutacja na poziomie nukleotydów[22]. Z tego powodu profile reaktogenności obu szczepów świnki są porównywalne, jak wykazano w niniejszym badaniu oraz w badaniach wcześniejszych[23-25]. Ponadto, MMR-RIT i MMR II zawierają ten sam szczep różyczki (Wistar RA27/3).
W omawianym badaniu ustaliliśmy, że u około 13% dzieci wystąpiła wysypka związana ze szczepieniem, co było wartością nieco wyższą niż częstość występowania podawana w innych badaniach szczepionek MMR[13, 24, 25].
W niniejszym badaniu rodzice i przedstawiciele prawni zostali wyczerpująco poinstruowani odnośnie do wykrywania i zgłaszania różnego rodzaju wysypek, co mogło spowodować wzrost liczby zgłoszeń. Jednakże przypadki wysypki związanej ze szczepieniem zgłaszano z podobną częstotliwością w obu zaszczepionych grupach.
Ograniczeniem niniejszego badania jest to, że uzyskanych przez nas wyników nie można uogólnić na dzieci, które nie spełniały kryteriów włączenia do badania, ale które mimo to zostałyby zaszczepione w praktyce klinicznej (np. dzieci z wcześniejszym kontaktem z jednym z trzech wirusów zawartych w szczepionce MMR).
Podsumowując, wyniki niniejszego badania wskazują, że odpowiedzi immunologiczne po pierwszej dawce szczepionki MMR-RIT były równoważne względem odpowiedzi immunologicznych wywołanych przez zarejestrowaną w Stanach Zjednoczonych szczepionkę MMR II. Wyniki te sugerują, że uzasadnione byłoby stosowanie MMR-RIT jako alternatywy w zapobieganiu odrze, śwince i różyczce u dzieci w Stanach Zjednoczonych i że szczepionka ta dawałaby gwarancję, iż Stany Zjednoczone dysponują drugą szczepionką MMR, która byłaby dostępna w przypadku potencjalnego braku szczepionki MMR.
Dla wygody pracowników służby zdrowia, na Rycinie 3 przedstawiono zestawienie umieszczające w kontekście wyniki omawianego badania.
Rycina 3.
Pacjent w centrum uwagi. Zestawienie umieszczające w kontekście wyniki badania dla wygody pracowników służby zdrowia.

Choroba
Odra, świnka i różyczka występują zazwyczaj u dzieci i są wysoce zakaźne. Mogą powodować poważne powikłanie takie jak uszkodzenie mózgu, bezpłodność, a nawet zgon. Aby chronić dzieci i dorosłych, w wieku około jednego roku i czterech lat podaje się dwie dawki szczepionki skojarzonej przeciwko odrze, śwince i różyczce (szczepionka MMR).
Na czym polega innowacja?
MMR II jest jedyną szczepionką MMR dostępną obecnie w Stanach Zjednoczonych (M-M-RII, Merck & Co., Inc.). Rutynowy program szczepień dwiema dawkami szczepionki MMR doprowadził do wyeliminowania odry i różyczki oraz zredukował powszechność występowania świnki w Stanach Zjednoczonych. Aby zapobiec potencjalnym brakom w zapasach szczepionki lub opóźnieniom w dostawach szczepionki MMR i tym samym zapewnić maksymalną ochronę indywidualną i grupową (jako że wybuchy epidemii wspomnianych chorób nadal się zdarzają), wskazane byłoby dysponowanie drugą szczepionką MMR, która byłaby dostępna w Stanach Zjednoczonych. Szczepionka MMR firmy GSK (Priorix nazywana tu MMR-RIT) uzyskała licencję w ponad 100 krajach poza Stanami Zjednoczonymi. W niniejszym badaniu oceniliśmy czy pierwsza dawka szczepionki MMR-RIT jest imunogenna i dobrze tolerowana w porównaniu ze szczepionką MMR dostępną obecnie w Stanach Zjednoczonych. Przeprowadzone przez nas badanie uwzględniało wymogi Agencji Żywności i Leków dotyczące zatwierdzenia stosowania szczepionki MMR-RIT w Stanach Zjednoczonych. Podaliśmy pierwszą dawkę MMR-RIT lub MMR II ponad pięciu tysiącom dzieci w wieku jednego roku wraz z zalecanymi dla tego wieku szczepionkami przeciwko ospie wietrznej i wirusowemu zapaleniu wątroby typu A oraz skoniugowaną szczepionką przeciwko pneumokokom. Dzieci, które otrzymały szczepionkę MMR-RIT wykazywały silne odpowiedzi immunologiczne na szczepionkę, które były zbliżone do odpowiedzi immunologicznych u dzieci zaszczepionych szczepionką MMR II. Szczepionki podawane jednocześnie wywoływały zdecydowane odpowiedzi immunologiczne niezależnie od tego którą szczepionkę MMR podano dziecku. Częstotliwość reakcji na szczepionki MMR-RIT i MMR II była podobna i pokrywała się z historycznymi danymi dotyczącymi bezpieczeństwa tych szczepionek.
Jaki ma to wpływ?
Niniejsze badanie pokazuje, że szczepionka MMR-RIT jest imunogenna i dobrze tolerowana jako pierwsza dawka podawana dzieciom w wieku jednego roku. Przyznanie licencji tej szczepionce w Stanach Zjednoczonych dałoby możliwość korzystania z opcji, która jest równoważna ze szczepionką MMR II oraz zwiększyłoby zapasy szczepionek.
Uwagi
Podziękowania. Dziękujemy dzieciom, które uczestniczyły w badaniu i ich rodzinom, a także naukowcom, pielęgniarkom i innym osobom pracującym w obiektach wykorzystanych w badaniu, które wniosły wkład w niniejsze badanie. Dziękujemy dr Sarze Rubio i dr Urszuli Miecielicy (obie pracują dla XPE Pharma & Science, Wavre, Belgia, pod adresem GSK), za świadczenie usług w zakresie literatury medycznej oraz dr. Adrianowi Kremerowi (XPE Pharma & Science, Wavre, Belgia, pod adresem GSK) za kierowanie publikacją.
Wsparcie finansowe. Omawiane badanie uzyskało wsparcie finansowe od firmy GlaxoSmithKline Biologicals SA (GSK), która zapewniała źródło finansowania i była zaangażowana we wszystkie etapy prowadzenia i analizy badania. GlaxoSmithKline Biologicals SA wzięła również odpowiedzialność za wszelkie koszty związane z opracowaniem i publikacją niniejszego artykułu.
Potencjalne konflikty interesów. N. P. K., L. W., J. A. F., M. C. i C. P. zgłaszają, że otrzymali granty z grupy spółek należących do GSK. N. P. K. również zgłasza uzyskanie dotacji od Merck & Co, Pfizer, Inc, Sanofi Pasteur, Novartis (obecnie w grupie spółek należących do GSK). Protein Science (obecnie Sanofi Pasteur) i MedImmune. L. W. także zgłasza otrzymanie darowizm od Merck & Co i Novartis oraz honorarium od Sanofi Pasteur za usługi konsultingowe. M. C. również zgłasza otrzymanie dotacji od Narodowego Instytutu Alergii i Chorób Zakaźnych na badania kliniczne. C. P. także zgłasza otrzymanie darowizn od Sanofi Pasteur i Regeneron. R. A.-E., M. P., P. G., S. C. i O. H. są pracownikami grupy spółek GSK. R. A.-E., P. G., S. C. i O. H. posiadają akcje w grupie spółek GSK w ramach wynagrodzenia za pracę. M. M. P. zgłasza otrzymanie grantu, honorarium dla prelegenta i wynagrodzenia za usługi konsultingowe od Novartis i Sanofi Pasteur. J. D.-D. zgłasza otrzymanie dotacji, honorarium dla prelegenta i wynagrodzenia za usługi konsultingowe od grupy spółek GSK, MSD i SPMSD. G. S. M. jest doradcą naukowym i badaczem w grupie spółek GSK, Merck & Co, Novartis, Pfizer, Inc, Sanofi Pasteur oraz Seqirus i zgłasza otrzymanie honorariów dla prelegenta od Pfizer, Inc i Sanofi Pasteur. K. P. R. zgłasza otrzymanie wsparcia finansowego dla badania od Novartis i dotacji na badanie od grupy spółek GSK. I. M. dla grupy spółek GSK pełniła funkcję rewidenta w ośrodku, w którym przeprowadzano badanie i otrzymała finansowanie w ramach swojego zaangażowania; jest ona pracownikiem Pfizer, Inc. T. V. deklaruje otrzymanie zapłaty za przeprowadzone wykłady od grupy spółek GSK. C. B. i A. C. byli pracownikami grupy spółek GSK w czasie, kiedy przeprowadzano badanie. Wszyscy pozostali autorzy: Brak zgłoszonych konfliktów interesów. Wszyscy autorzy złożyli deklarację ICMJE Form for Disclosure of Potential Conflicts of Interest. Ujawnione zostały konflikty, które wydawcy uznali za istotne dla treści rękopisu.