RSFIEDLLFNKV… czy mamy do czynienia z amyloidozą jako bronią?
A co z prionami? Artykuł objaśniający.
Po pierwsze, muszę wam powiedzieć, że liczba zgłoszeń choroby Creutzfeldta-Jacoba (CJD)/choroby prionowej w VAERS od czasu wprowadzenia eksperymentalnych zastrzyków na COVID-19 znacznie przekroczyła liczbę przypadków tła w Stanach Zjednoczonych w tym roku.
Zanim przejdę dalej, muszę przedstawić kilka ważnych informacji. Weźcie filiżankę kawy i rozsiądźcie się wygodnie. To będzie dłuższy artykuł. Uważam, że nie ma sensu starać się właściwie przekazać tych informacji, dopóki nie uwierzę, że moi czytelnicy naprawdę rozumieją niektóre z podstaw.
O białkach
Większość ludzi, słysząc słowo „białko”, np. myśląc o jajku albo kotlecie. Ja też tak myślałem. Ale białka to coś więcej niż kotlety. To duże biomolekuły – stabilne energetycznie, zwarte, złożone ciągi aminokwasów, których złożona struktura decyduje o ich funkcji. Robią dla nas wiele rzeczy, takich jak kataliza reakcji metabolicznych, replikacja DNA, tworzenie struktury komórkowej, transport molekularny i wiele innych! Można je również oczyszczać! Właśnie tym zajmowałem się podczas mojego ostatniego doktoryzowania się. Białka są absolutnie niezbędne do życia i funkcjonowania organizmów żywych. Krótkie ciągi aminokwasów zazwyczaj nie są nazywane białkami, lecz peptydami.
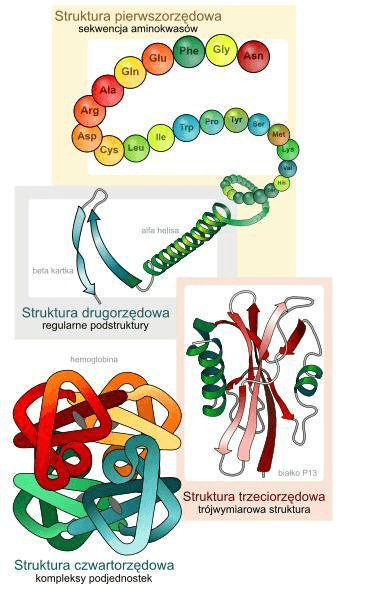
Rycina 1: Struktura białek.
O prionach
Wśród wielu, wielu białek (co najmniej 20.000)[1], które posiadamy my, ludzie, istnieją jeszcze białka prionowe. Białka prionowe lub komórkowe białka prionowe (PrPc) są typowe dla ludzi, znajdują się w naszych mózgach i cały czas się pojawiają. Kiedy te białka ulegają niewłaściwemu złożeniu, to Houston mamy problem.
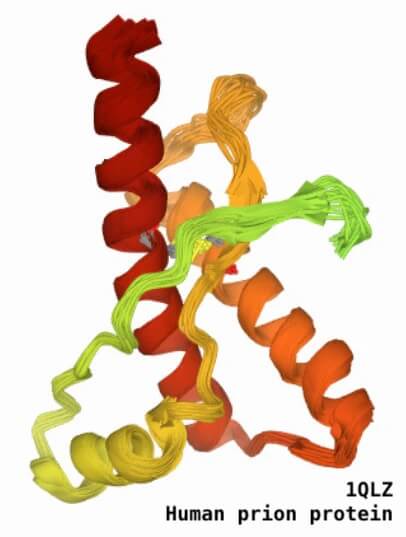
Ryc. 2: Ludzkie białko prionowe 1QLZ https://www.rcsb.org/structure/1QLZ
Te nieprawidłowo złożone białka są nazywane prionami (nieprawidłowo złożone białko prionowe (PrPSc – Sc oznacza Scrapie [trzęsawka][2,3])) i są związane z chorobami neurodegeneracyjnymi, takimi jak choroba Alzheimera. Wydaje się, że mogą one przekształcać lub „uczyć” inne białka prionowe nieprawidłowego składania (przenoszenia). Nie jest to raczej uczenie, ale raczej uniemożliwienie prawidłowego składania. To z kolei „umożliwia” autokatalityczną reakcję, w której PrPSc katalizuje nieprawidłowe składanie PrPc w celu wytworzenia większej ilości PrPSc, ponieważ priony są odporne na proteolizę – proces „usuwania” nieprawidłowo złożonych białek.
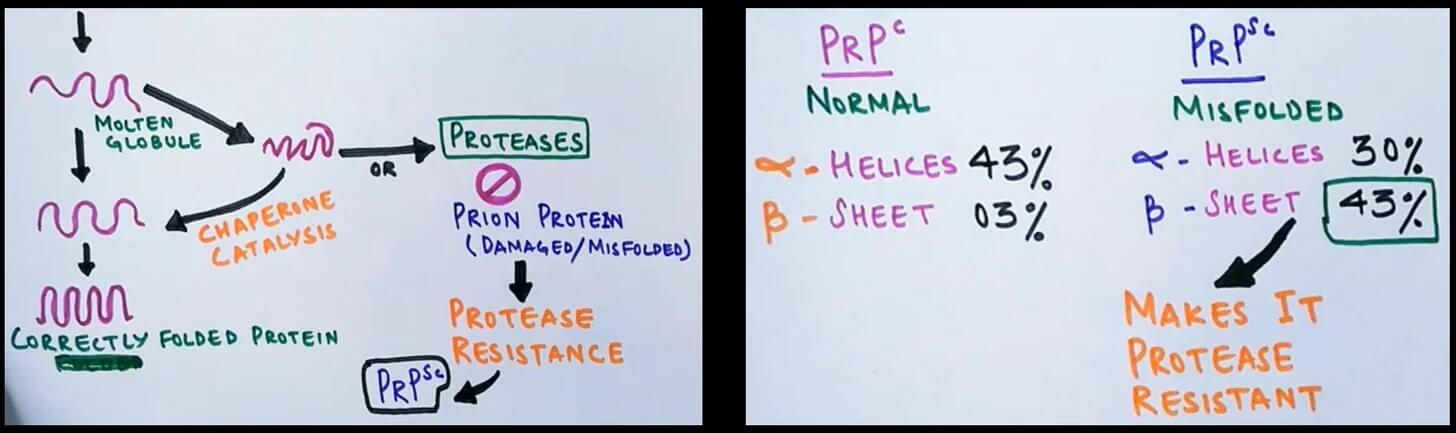
Ryc. 3: Zrzuty ekranu z filmu Priony – czym są? Protein Misfolding Mechanism autorstwa Hussain Biology.
Tylko białka prionowe mogą ulegać nieprawidłowemu fałdowaniu, tworząc priony, a ich wyjątkowość polega na tym, że są odporne na proteolizę. Należy zauważyć, że wszystkie białka przechodzą przez proces składania (jak pokazano po lewej stronie lewego zrzutu ekranu na rycinie 3), a jeśli dojdzie do błędnego złożenia, to albo białka opiekuńcze [chaperony …] doprowadzą je do ostatecznego prawidłowego złożenia, albo zostaną one wyeliminowane przez proteazy[4]. Błędnie złożonych białek jest mnóstwo! Mimo to ten mechanizm nie działa w przypadku białek prionowych. Zastanawiam się więc, po co w ogóle je mamy. Ale to już temat na inny dzień.
Wracając do bazy VAERS
Do dnia dzisiejszego (10 czerwca 2022 r.) w VAERS znajduje się 59 zgłoszeń dotyczących CJD i chorób prionowych. Jest to przerażające. Wskaźnik zachorowań na CJD w Stanach Zjednoczonych wynosi 1/1M rocznie. Ponieważ populacja Stanów Zjednoczonych w dniu 6 czerwca 2022 roku wynosi około 334 mln[5], można by się spodziewać, że zgłoszonych zostanie nie więcej niż 334 przypadków CJD w ciągu roku. Jeśli przyjmiemy wyjątkowo niski współczynnik niedoszacowania (URF)[6] wynoszący 6, to już przekroczyliśmy oczekiwaną liczbę przypadków o 20 zgłoszeń. Jeśli użyjemy obliczonego współczynnika URF wynoszącego 31, o którym mowa w (2), to do tej pory w Stanach Zjednoczonych odnotowano 1829 przypadków chorób prionowych (CJD). A to są tylko dane z VAERS. I to tylko w kontekście zastrzyków na COVID-19. Do dnia 6 czerwca 2022 r. w Stanach Zjednoczonych podano około 589 milionów[7] dawek zastrzyków na COVID-19 (Moderna, Pfizer i Jannsen). Oznacza to, że obserwujemy około 3,1 przypadków zachorowań na choroby prionowe/CJD na milion Amerykanów – 3 razy więcej niż wynosi wskaźnik tła. Już teraz.
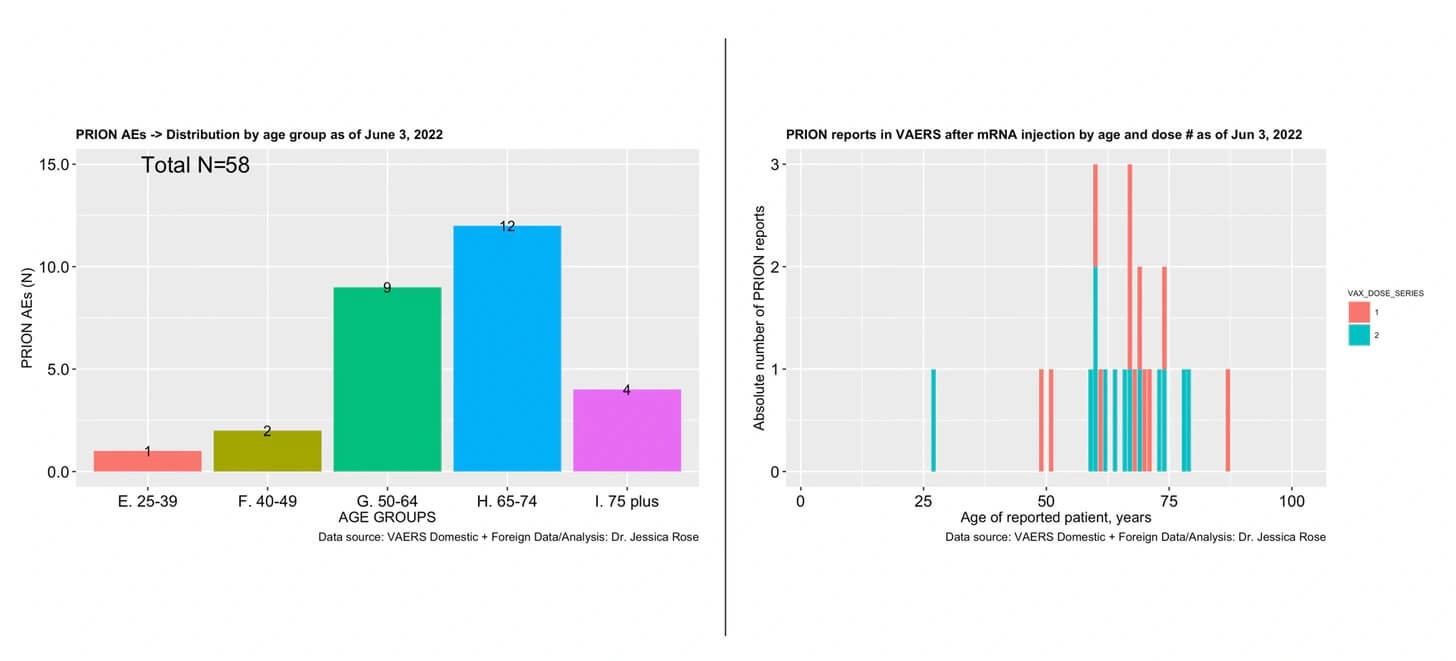
Ryc. 4: Wykresy słupkowe przedstawiające zgłoszenia VAERS dotyczące choroby Creutzfeldta-Jacoba i choroby prionowej w kontekście eksperymentalnych terapii genowych na COVID-19 firm Moderna, Janssen i Pfizer w podziale na grupy wiekowe (po lewej) i wiek/dawkę (po prawej).
Artykuł, który mnie przeraża
Spędziłam cały dzień, czytając prace, do których odsyła artykuł napisany przez użytkownika Walnut (Walter Chestnut), i są one fascynujące. Szczególnie jedna z nich przykuła moją uwagę. Podsumowując, chodzi o to, że konserwowany peptyd białka kolca koronawirusa tworzy nano-struktury amyloidowe i hydrożele w warunkach zależnych od pH (pH = 4) i że ma to zastosowanie w materiałoznawstwie do powolnego uwalniania leków.
„Wykazaliśmy, że zakonserwowany peptyd białka kolcowego koronawirusa tworzy struktury amyloidowe, różniące się od natywnej konformacji helikalnej i nieprzewidywane przez algorytmy agregacji amyloidów. Badamy konformację i agregację peptydu RSAIEDLLFDKV, który jest sekwencją wspólną dla wielu zwierzęcych i ludzkich koronawirusowych białek kolcowych. Sekwencja ta jest częścią natywnej α-helikalnej domeny glikoproteiny S2, znajdującej się w pobliżu i częściowo obejmującej sekwencję fuzyjną. Peptyd ten agreguje w struktury nanorurek amyloidowych typu arkusz [kartka] β bliskie obliczonemu pI = 4,2, ale tworzy nieuporządkowane monomery w wysokim i niskim pH. Konformacja β-arkusza, ujawniona za pomocą spektroskopii FTIR i dichroizmu kołowego (CD), prowadzi do powstania struktur w postaci nanorurek peptydowych, obrazowanych za pomocą transmisyjnej mikroskopii elektronowej (TEM) i badanych metodą małokątowego rozpraszania promieniowania rentgenowskiego (SAXS). Nanopaski składają się z dwuwarstw pokrytych argininą. Do badania agregacji peptydu w struktury amyloidowe zastosowano test UV-vis z użyciem barwnika czerwieni Kongo, co umożliwiło wyznaczenie krytycznego stężenia agregacji (CAC). Peptyd ten tworzy również hydrożele w ściśle określonych warunkach pH i stężenia, których właściwości reologiczne zostały zbadane. Obserwacja tworzenia amyloidu przez kolec koronawirusa ma związek ze stabilnością konformacji białka kolca (lub jego destabilizacją poprzez zmianę pH), a peptyd może mieć potencjalne zastosowanie jako materiał funkcjonalny. Hydrożele tworzone przez peptydy koronawirusowe mogą być również interesujące w przyszłości, m.in. przy opracowywaniu systemów powolnego uwalniania.” – ACS Nano 2022, 16, 2, 1857–1867; Amyloid and Hydrogel Formation of a Peptide Sequence from a Coronavirus Spike Protein https://pubs.acs.org/doi/10.1021/acsnano.1c10658
Rys. 5: https://pubs.acs.org/doi/10.1021/acsnano.1c10658. (Rysunek 1).
W poprzednim artykule, który napisałam, poruszyłam temat kolca SARS-nCoV-2 posiadającego amyloidogenne peptydy pochodzące od FKNIDGYFKIYSKHTPINLV (powtórz to 5 razy szybko). Ta praca jest taka sama, ale różni się od niej. Obie prace badają funkcjonalne aspekty peptydów kolcowych związane z tworzeniem amyloidu. Napisałem również artykuł o chorobach prionowych. Można ją przeczytać tutaj.
Proszę zapoznać się z pracą zatytułowaną: „Amyloid and Hydrogel Formation of a Peptide Sequence from a Coronavirus Spike Protein”, opublikowaną 4 stycznia 2022 r. w ACS Nano przez Hamleya i Castelletto [abstrakt powyżej]. Dla wszystkich zainteresowanych jest to praca z dziedziny materiałoznawstwa, ale dla mnie budzi ona poważne wątpliwości i ze zdziwienia robie unoszę brwi jak Nancy Pelosi.
Rycina 6: Brwi Nancy Pelosi.
Przeprowadzono serię eksperymentów z wykorzystaniem peptydu RSAIEDLLFDK(V) pochodzącego z kolców koronawirusa. Stwierdzono, że peptyd ten ma bardzo interesujące właściwości w określonych warunkach pH, które nie są przewidywane przez algorytmy agregacji amyloidu. Podobny sekwencyjnie peptyd, RSFIEDLLFNKV, znajduje się w białku kolca wirusa SARS-nCoV-2. Chciałabym więc wiedzieć: czy analogiczny peptyd w białku kolca SARS-nCoV-2 i/lub zmodyfikowany mRNA kodujący białko kolca w zastrzykach powoduje powstawanie nanorurek i amyloidów w określonych warunkach chemicznych/fizjologicznych?
Wizualizacja struktury białek w celu zrozumienia implikacji
Ważna jest wizualizacja struktury białek, na przykład za pomocą krystalografii rentgenowskiej lub mikroskopii krioelektronowej. Wizualizacja struktury białka i miejsca, w którym „przebywają” poszczególne sekwencje aminokwasów, może dać nam wgląd w funkcjonalne aspekty zarówno białka jako całości, jak i poszczególnych sekwencji aminokwasów w białku. Na przykład sekwencje na powierzchni białek są prawdopodobnie zlokalizowane w dostępnych miejscach, takich jak powierzchnia, ponieważ zawierają one miejsce wiązania dla jakiegoś białka. Poniższy schemat (Ryc. 7) przedstawia sekwencje aminokwasów na białku kolca SARS-nCoV-2, które tworzą domenę wiążącą receptor (RBD). Jest to trimer białka kolcowego SARS-CoV-2 z RBD w pozycji „UP” (pdb 6X2A), a żółta ramka zakreśla RBD, które jest „UP” i gotowe do wiązania ACE-2. Zaciemniłam 2 z 3 struktur trimerycznych, aby ułatwić ich oglądanie.
Rycina 7: Struktura glikoproteiny kolca SARS-CoV-2 z RBD w pozycji „UP”. https://www.rcsb.org/3d-view/6X2A/1
Jeśli chodzi o peptydy RSAIEDLLFNKV i RSFIEDLLFNKV, dodałam kilka żółtych kulek do struktur krystalicznych kolców świńskich i SARS-nCoV-2, aby zwizualizować, gdzie te sekwencje aminokwasów znajdują się w strukturach, jak pokazano na Rysunku 8. Zrobiłam to, wyrównując w programie Pymol kolce wieprzowe do kolców SARS-nCoV-2, a następnie zaznaczając sekwencje aminokwasów.
Ryc. 8: Białka kolców koronawirusa delta u świń (cyjan) i SARS-CoV-2 (zieleń). Żółte kule reprezentują sekwencje RSAIEDLLFNKV i RSFIEDLLFNKV.
Przejdźmy teraz do Rysunku 4 w ich pracy, gdzie pokazano obrazy z transmisyjnej mikroskopii elektronowej (TEM) peptydu RSAIEDLLFDK(V) (z białka kolca koronawirusa – dostarczonego przez firmę Peptide Synthetics) o różnym pH (3-12). pH, na wypadek gdybyście zapomnieli podstaw chemii (jak ja zawsze), to w zasadzie różnica w stężeniu jonów wodoru przedstawiona w skali logarytmicznej: większe stężenie wodoru = bardziej kwaśny odczyn (kwaśny od zasadowego). W pewnym kontekście, kwas akumulatorowy ma PH = 0, kwas żołądkowy ma pH = 1,5-2,0, sok pomidorowy, kwaśny deszcz i lizosomy mają PH = 4-4,5, czysta woda ma PH = 7, a płyn do czyszczenia kanalizacji ma PH = 14. Trzymaj się z dala od kwasu akumulatorowego i płynu do czyszczenia kanalizacji.
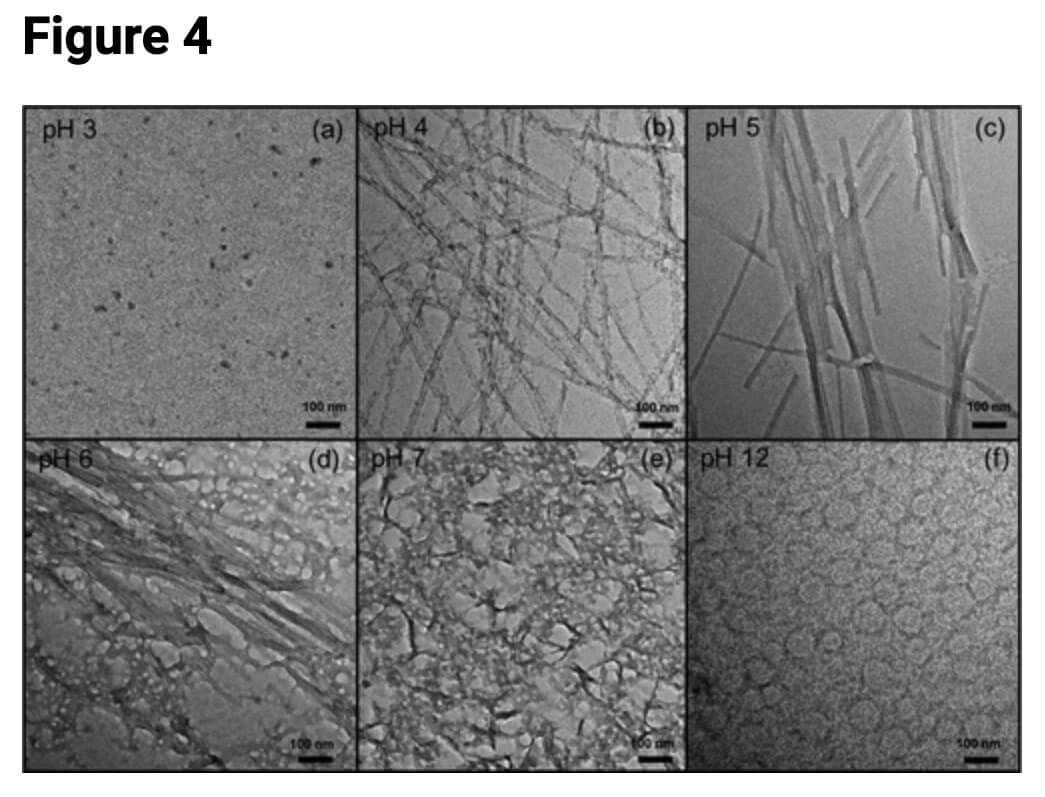
Rycina 9: Ryc. 4 z publikacji ACS Nano 2022, 16, 2, 1857-1867. Data publikacji: 4 stycznia 2022 r. https://doi.org/10.1021/acsnano.1c10658
Po rozpuszczeniu próbek peptydu (RSAIEDLLFDK) w kwaśnym roztworze (PH 3) nie zaobserwowano struktur fibrylarnych (u góry po lewej). Zamiast tego zaobserwowano coś, co nazwano „strukturami kulistymi”, które odpowiadają nieuporządkowanym monomerom (peptydu) w roztworze. Gdy zwiększono pH o 1 do pH = 4, zaobserwowano struktury amyloidowe lub fibryle. Struktury te określili jako wydłużone struktury amyloidowe lub nanorurki. Po zwiększeniu pH do 5 zaobserwowano, że peptyd samoistnie układa się „w szerokie nanorurki o grubości do 100 nm, które w niektórych miejscach rozdzielają się na nanorurki o grubości ∼ 20 nm”, jak pokazano w prawym górnym kwadracie. Krótko mówiąc, zwiększano stopniowo pH, aby sprawdzić, jaki wpływ ma to na tworzenie się włókien lub struktur nanorurek, i wyraźnie widać, że w pH = 4-5 jest punkt krytyczny dla tworzenia się nanorurek.
Cofnijmy się zatem. Już w pierwszym zdaniu pracy autorzy twierdzą, że:
„Sekwencja RSAIEDLLFDKV występuje w wielu koronawirusach, w tym w białku kolców ludzkiego koronawirusa przeziębienia, a także w białkach kolców innych koronawirusów pochodzących od innych zwierząt” – ACS Nano 2022, 16, 2, 1857–1867
Zastanawiałam się trochę nad konsekwencjami tego faktu. Ponownie, jest to praca z dziedziny materiałoznawstwa i naprawdę zależy im na potencjalnych zastosowaniach „żeli wyzwalanych przez pH i/lub do zastosowań o powolnym uwalnianiu”. Ale nadal nie wiem: czy zmodyfikowany mRNA w zastrzykach Pfizer i Moderna koduje peptydy amyloidogenne, które w pewnych warunkach chemicznych/fizjologicznych powodują tworzenie się nanorurek i amyloidów? A to prowadzi mnie z powrotem do jednego z najważniejszych pytań, które postawiłam ponad rok temu, a mianowicie: 'Jakie peptydy powstają ze zmodyfikowanego mRNA w wyniku translacji?’ (Podpowiadałam na ten temat (oczywiście) i można to przeczytać tutaj).
Jeśli zmodyfikowany mRNA kolców nie jest tłumaczony przez komórki gospodarza na swój pełny produkt, lecz na niekompletne „kawałki” lub peptydy, to czy któryś z tych peptydów jest amyloidogenny? Czy jest możliwe, że jednym z tych peptydów jest omawiany tutaj peptyd analogowy? Czy ten analogowy peptyd (konserwatywny peptyd białka kolców koronawirusa SARS-nCoV-2) tworzy nanostruktury amyloidowe i hydrożele w warunkach zależnych od pH (a dokładnie pH = 4)? Jeśli tak, to w jakim miejscu w organizmie mogłoby się to wydarzyć? Czy to możliwe? Kwas żołądkowy (pH = ~4)? Lizosomy (pH = ~4,5)[8]?
Dla jasności, w literaturze wielokrotnie wykazywano, że domeny lub peptydy prionopodobne występują w białku kolca wirusa SARS-nCoV-2 i są one specyficzne dla SARS-2[9]. A zatem, co z naszym zmodyfikowanym kolcem?
Jeszcze kilka przerażających faktów
Białka mogą przekształcać się z helis alfa w arkusze [kartki] beta, odsłaniając w ten sposób aminokwasy hydrofobowe, co sprzyja agregacji białek. Dla przypomnienia, helisy alfa i arkusze beta są strukturami drugorzędowymi w organizacji białek.
Co więcej, nierodzime struktury arkuszy beta są powszechne w fibrylach amyloidowych tworzonych przez różne patogenne, a nawet niepatogenne białka i peptydy. We wszystkich tych przypadkach powstanie helisy alfa poprzedza pojawienie się arkusza beta, co sugeruje, że przejście od prostszej, bardziej lokalnej struktury helisy do często bardziej zagmatwanej struktury arkusza podczas procesów fałdowania i patogennego błędnego składania może być jednoczącą zasadą o znaczeniu ogólnym.
Przepraszam, że to robię, ale zajrzałem na stronę Wikipedii poświęconej prionom (uaktualniona 2 tygodnie temu) i jest tam akapit o przystosowanie tego, aby zostało użyte jako broń. Oczywiście, że tak. Gdzie byliby ludzie, gdyby paranoiczni psychopaci nie przekształcali wszystkiego w broń.
Maynard James Keenan śpiewał “Silly monkeys, give them thumbs, they make a club and beat their brother down.” “Silly monkeys, give them thumbs, they forge a blade, and where there’s one, they’re bound to divide it.” [„Głupie małpy, daj im kciuki, to zrobią z nich maczugę i będą bić brata”. „Głupie małpy, dajcie im kciuki, a wykują ostrze, a gdzie jest jedno, tam na pewno je podzielą”]

Ryc. 10: https://en.wikipedia.org/wiki/Prion
Moje przemyślenia na zakończenie
Sprawa prionów to nie to samo co sprawa amyloidu, ale mogą one być ze sobą bardziej powiązane, niż nam się wydaje. Jeszcze nie wiem. Walnut wspomina o pojęciu „prioloidu” w swoim artykule. Jeszcze nie wiem, co o tym sądzę. Wiem tylko, że priony agregują się ze względu na wysoki stopień kompostowania arkuszy beta i są histochemicznie i ultrastrukturalnie identyczne z amyloidem[2].
Nadszedł czas, aby porozmawiać o rozwiązaniach. I Ty też powinieneś je przeczytać.[10,11,12,13]
Jeśli niektóre z peptydów w białku szpiku SARS-nCoV-2 są w stanie tworzyć blaszki amyloidowe, będziemy potrzebowali leczenia dla osób dotkniętych tą chorobą. Jeszcze bardziej przerażające jest to, że jeśli zmodyfikowany mRNA (który został zoptymalizowany pod względem kodonu) zawiera peptydy amyloidogenne, które są w stanie tworzyć blaszki amyloidowe, to osoby, którym wstrzyknięto białko, będą miały poważne kłopoty i będą potrzebowały jakiegoś rozwiązania. Cóż, wielu z nich już umiera – poważne kłopoty niestety już minęły. A propos, zespół nagłej śmierci u dorosłych (SADS)? Bez kitu. Naprawdę?
Poszukałam informacji o środkach fibrynolitycznych, ponieważ pewnego dnia pewien lekarz zapytał mnie, jak pomóc pacjentowi, u którego niedawno wykryto blaszki amyloidowe w mózgu. Nie miałam pojęcia, co mu powiedzieć. Jedna osoba zasugerowała w sekcji komentarzy na stronie z artykułem Walnuta, że warto przyjrzeć się lumbrokinazie i nattokinazie [Lumbrokinase, nattokinase]. Ale to może wymagać jedzenia brudu i robaków ziemnych[14].
Jeśli chcecie mojej rady, naprawdę dowiedzcie się, jak złe i nieodwracalne jest tworzenie się blaszek amyloidowych (może wystarczy wspomnieć słowo Alzheimer – Chris Masterjohn napisał artykuł o Alzheimerze jakiś czas temu, ale jest on dokładny i istotny) i przekażcie swoim bliskim, którym mówi się, że muszą znowu dostać zastrzyk, że zastrzyki mogą doprowadzić do powstawania płytek. Chris napisał, że odkładanie się blaszek amyloidowych jest uniwersalną cechą charakterystyczną choroby Alzheimera, ale niekoniecznie jej przyczyną. Zgadza się.
Martwi mnie to, że ogólnoustrojowe tworzenie się blaszek amyloidowych tłumaczyłoby wiele, jeśli nie wszystkie poważne zdarzenia niepożądane, które obserwujemy w VAERS i innych systemach zgłaszania zdarzeń niepożądanych. Według mnie tłumaczyłoby to zapalenie mięśnia sercowego.
Źródło: RSFIEDLLFNKV… are we looking at weaponized amyloidosis?
Zobacz na: Stabilizowanie kodu – mRNA i receptory Toll-podobne – dr Mike Williams
Szczepionka mRNA przeciw COVID-19 a neurodegeneracyjne choroby prionowe.
Dossier na temat Anthony Fauciego/COVID-19 – dr David Martin
Mimikra molekularna pomiędzy glikoproteiną kolca SARS-CoV-2 a proteomami ssaków: poszczepienne następstwa
Potencjalne problemy autoimmunologiczne i neurodegeneracyjne szczepionek na Covid-19 – Dr Christopher Shaw
Białka kolca wirusa SARS-CoV-2 upośledzają naprawę uszkodzeń DNA i hamują rekombinację V(D)J in vitro
USA: Tuszowanie Niepożądanych Odczynów Poszczepiennych – Deborah Conrad
Bibliografia:
1. https://sandwalk.blogspot.com/2016/12/how-many-proteins-in-human-proteome.html
2. McKinley, M.P., Prusiner, S.B. (1987). Scrapie Prions, Amyloid Plaques, and a Possible Link with Alzheimer’s Disease. In: Altman, H.J. (eds) Alzheimer’s Disease. Springer, Boston, MA. https://doi.org/10.1007/978-1-4615-6414-0_7.
3. https://en.wikipedia.org/wiki/Scrapie
4. https://www.nature.com/scitable/topicpage/protein-structure-14122136/
5. https://www.worldometers.info/world-population/us-population/
6. Rose, J. 2021, Critical Appraisal of VAERS Pharmacovigilance: Is the U.S. Vaccine Adverse Events Reporting System (VAERS) a Functioning Pharmacovigilance System? Science, Public Health Policy & the Law Volume 3:100–129.
7. Hannah Ritchie, Edouard Mathieu, Lucas Rodés-Guirao, Cameron Appel, Charlie Giattino, Esteban Ortiz-Ospina, Joe Hasell, Bobbie Macdonald, Diana Beltekian and Max Roser (2020) – „Coronavirus Pandemic (COVID-19)”. Published online at OurWorldInData.org. Retrieved from: 'https://ourworldindata.org/coronavirus’ [Online Resource].
8. https://en.wikipedia.org/wiki/Intracellular_pH
9. Tetz G, Tetz V. Prion-like Domains in Spike Protein of SARS-CoV-2 Differ across Its Variants and Enable Changes in Affinity to ACE2. Microorganisms. 2022; 10(2):280. https://doi.org/10.3390/microorganisms10020280.
10. Sabaté R, Gallardo M, Estelrich J. An autocatalytic reaction as a model for the kinetics of the aggregation of beta-amyloid. Biopolymers. 2003;71(2):190-5. doi: 10.1002/bip.10441. PMID: 12767118.
11. Kauffman, S. A. (1986). Autocatalytic sets of proteins. Journal of Theoretical Biology, 119(1), 1–24. doi:10.1016/s0022-5193(86)80047-9.
12. Johansson J. Molecular determinants for amyloid fibril formation: lessons from lung surfactant protein C. Swiss Med Wkly. 2003 May 17;133(19-20):275-82. PMID: 12844270.
13. Wulf, MA., Senatore, A. & Aguzzi, A. The biological function of the cellular prion protein: an update. BMC Biol 15, 34 (2017). https://doi.org/10.1186/s12915-017-0375-5.
14. https://www.allergyresearchgroup.com/blog/enzymes-from-the-earth-lumbrokinase-nattokinase-and-heart-health/