Dwie epidemie COVID-19. Pierwsze trzy miesiące epidemii COVID-19: dowody epidemiologiczne dla dwóch oddzielnych szczepów wirusów SARS-CoV-2, rozprzestrzenianie się i implikacje dla strategii zapobiegania – dr Knut M. Wittkowski
Abstrakt
Około miesiąca po tym, jak epidemia COVID-19 osiągnęła szczyt w Chinach kontynentalnych i SARS-CoV-2 pojawił się w Europie, a następnie w USA, dane epidemiologiczne zaczynają dostarczać ważnych informacji na temat ryzyka związanego z chorobą oraz skuteczności strategii interwencyjnych, takich jak ograniczenia podróży i dystans społeczny. Choroby układu oddechowego, w tym epidemia SARS z 2003 roku, pozostają w każdej populacji, tylko przez okres około dwóch miesięcy, chociaż szczytowa zapadalność i śmiertelność mogą się różnić. Dane epidemiologiczne sugerują, że istnieją co najmniej dwa szczepy wirusa SARS-CoV-2 [2020], które wyewoluowały podczas migracji z Chin kontynentalnych do Europy. Korea Południowa, Iran, Włochy i sąsiedzi Włoch zostały dotknięte bardziej niebezpiecznym wariantem „SKII”. Podczas gdy epidemia w Azji kontynentalnej dobiega końca, a w Europie wyrównuje się, niedawna epidemia wśród młodszej populacji USA wciąż rośnie, choć już nie wykładniczo. Poziom szczytu prawdopodobnie zależeć będzie od tego, który szczep najpierw przybędzie do USA. Te same modele, które pomagają nam zrozumieć epidemię, pomagają nam również w wyborze strategii zapobiegania. Izolacja osób wysokiego ryzyka, takich jak osoby starsze, oraz redukowanie ciężkości choroby, zarówno poprzez szczepienie, jak i wczesne leczenie powikłań, jest najlepszą strategią przeciwko chorobie wirusowej układu oddechowego. Dystans społeczny lub „blokady” mogą być skuteczne w ciągu miesiąca następującego po szczytowym występowaniu infekcji, kiedy kończy się wykładniczy wzrost liczby przypadków. Wcześniejsze izolowanie ludzi niskiego ryzyka jedynie przedłuża czas, podczas którego wirus musi krążyć, aż zapadalność jest wystarczająco wysoka, aby zainicjować „odporność stada”. Późniejsze izolowanie nie jest pomocne, chyba że zapobiega odbiciu [ponownej fali wznoszącej zachorowań], jeśli izolowanie rozpoczęło się zbyt wcześnie.
O autorze
Dr Wittkowski uzyskał stopień doktora nauk komputerowych na Uniwersytecie w Stuttgarcie oraz stopień naukowy doktora habilitowanego w dziedzinie biometrii medycznej na Uniwersytecie Eberharda-Karlsa w Tybindze w Niemczech. Pracował przez 15 lat z Klausem Dietzem, wiodącym epidemiologiem, który ukuł termin „liczba reprodukcyjna”, w odniesieniu Epidemiologii HIV, zanim przez 20 lat kierował Wydziałem Biostatystyki, Epidemiologii i Projektowania Badawczego na Rockefeller University w Nowym Jorku. Dr Wittkowski jest obecnie dyrektorem generalnym ASDERA LLC, firmy odkrywającej nowe metody leczenia złożonych chorób na podstawie badań asocjacyjnych całego genomu.
Dwie epidemie COVID-19
Wprowadzenie
Pierwsze przypadki nowego szczepu koronawirusa, zwanego SARS-CoV-2 (Koronawirusowy Zespół Ostrej Niewydolności Oddechowej) zgłoszono 31-12-2019 w Wuhan, stolica chińskiej prowincji Hubei.(Jernigan 2020) do Międzynarodowego Komitetu Taksonomii Wirusów (ICTV)(Cascella 2020).
Według stanu na 31.03.2013, 10:00 czasu środkowoeuropejskiego, odnotowano 777.798 przypadków objawowych i 37.272 zgonów w praktycznie każdym kraju na półkuli północnej (patrz rozdział Dane). Choroba została nazwana COVID-19 przez WHO w dniu 11 luty 2020 i sklasyfikowana jako pandemia w dniu 12 marcu 2020, jednak szczegóły rozprzestrzeniania się i jej konsekwencje w odniesieniu do zapobiegania nie zostały wystarczająco szczegółowo omówione.
Pomiędzy 14 lutego a 16 marca, indeks spółek Dow Jones Industrial Average spadł o 31% z 29.440 do 20.188, budząc obawy dotyczące gospodarki, a zwłaszcza oszczędności emerytalnych. Kilka administracji nałożyło surowe ograniczenia [izolowanie] mające na celu powstrzymanie wirusa. Na przykład,
• W dniach 8 marca rząd włoski nałożył kwarantannę na 16 milionów ludzi na północy Włoch, po czym w dniach 11 marca nastąpiło ogólnokrajowe zamknięcie wszystkich restauracji i barów oraz większości sklepów(WSJ, 2020-03 -11).
• W dniu 11 marca administracja rządowa USA zakazała podróży z 26 krajów europejskich (Austria, Belgia, Czechy, Dania, Estonia, Finlandia, Francja, Niemcy, Grecja, Węgry, Islandia, Włochy, Łotwa, Liechtenstein, Litwa, Luksemburg, Malta, Holandii, Norwegia, Polska, Portugalia, Słowacja, Słowenia, Hiszpania, Szwecja i Szwajcaria). https://www.cnn.com/world/live-news/coronavirus-outbreak-03-12-20-intl-hnk/index.html
• W dniu 15 marca burmistrz Nowego Jorku Bill de Blasio zmienił swoje poprzednie stanowisko, że szkoły w Nowym Jorku powinny pozostać otwarte, aby uniknąć „opieki w domu i doglądania dzieci” przez pracowników służby zdrowia, ogłosił zamknięcie szkół publicznych w Nowym Jorku, podobnie jak wiele innych systemów szkolnych.
• W dniu 17 marca wszystkie restauracje w stanie Nowy Jork, New Jersey i Connecticut musiały zostać zamknięte. W dniach 22 marca fryzjerzy również zostali zamknięci.
• W dniu 19 marca stan Kalifornia został „zamknięty” (zarządzenie N-33-20)
• W dniu 22 marca zaostrzono blokadę we włoskim regionie Lombardii, zakazano sportu i innych aktywności fizycznych, a także korzystania z automatów sprzedających.
• Również w dniu 22 marca Gwardia Narodowa została aktywowana w Nowym Jorku, Kalifornii i stanie Waszyngton, pięciu senatorów poddało się kwarantannie na własne życzenie. Gubernator stanu Nowy Jork Andrew Cuomo nakazał, aby wszystkie mniej nieistotne firmy zamknąć lub aby pracowały z domu.
Pod koniec 20 marca indeks spółek Dow Jones Industrial Average spadł do 19.173 (35%) od 14 lutego. W dniach 26 marca senat USA zatwierdził pakiet stymulacyjny w wysokości 2 bilionów dolarów.
Przez większość pierwszych trzech miesięcy epidemii większość reakcji była spowodowana „strachem, piętnem lub dyskryminacją”(Ren 2020), w tym nazwaniem SARS-CoV-2 „chińskim wirusem”(Rogers 2020), pomimo faktu, że sezonowe odzwierzęce patogeny układu oddechowego zwykle pochodzą z Chin, gdzie rynki zwierząt żywych stwarzają szanse na przenoszenie wirusów zwierzęcych na ludzi.(Malik 2020)
Po trzech miesiącach dostępne są wystarczające dane, aby omówić ważne cechy epidemiologiczne COVID-19 i potencjalny wpływ interwencji. W szczególności teraz obserwujemy spadek liczby nowych przypadków zachorowań (i zgonów) w Chinach i Korei Południowej, a przynajmniej stabilizację w niektórych krajach europejskich. Zmiany liczby zgonów następują po zmianach liczby przypadków zachorowań (choć na niższym poziomie) z około dwu tygodniowym opóźnieniem. Dlatego możemy omówić zarówno zakaźność, jak i śmiertelność wirusa, dwie ważne cechy do oceny wpływu choroby na zdrowie publiczne.
Jednym z kluczowych odkryć tutaj opublikowanych jest dowód, że ewoluowały co najmniej dwa szczepy SARS-CoV-2 o różnej zakaźności i śmiertelności, a podążając prawdopodobną ścieżką dla każdego z tych szczepów, możemy uzyskać nowy wgląd w naturę epidemii a zatem skuteczność strategii zapobiegania. Innym odkryciem jest to, że moment, w którym interwencja w zakresie zdrowia publicznego rozpoczyna się w trakcie epidemii (szczególnie „punkt zwrotny”, w którym wzrost liczby nowych przypadków zaczyna spadać) ma kluczowe znaczenie dla wpływu interwencji.
Materiały i metody
Dane
Wszystkie dane zostały pobrane w dniu 2020-03-31 ze strony internetowej Europejskiego Centrum ds. Kontroli i Prewencji Chorób (ECDC) pod adresem https://www.ecdc.europa.eu/en/publications-data/download-todays-data-geographic-distribution-covid-19-cases-worldwide , gdzie dane są gromadzone i codziennie aktualizowane między 6:00 a 10:00 czasu środkowoeuropejskiego. Aktualizacje zostały zebrane z internetowego narzędzia do śledzenia Johns Hopkins dostępnego pod adresem https://systems.jhu.edu/research/public-health/ncov/ . Dane z Nowego Jorku zostały pobrane z https://www1.nyc.gov/assets/doh/downloads/pdf/imm/covid-19-daily-data-summary.pdf . Dane dotyczące populacji zostały wzięte ze strony https://www.worldometers.info/world-population/population-by-country/ w dniu 20 marca 2020. Dane dotyczące wieku według kraju były wzięte z https://data.worldbank.org/indicator/SP.POP.65UP.TO.ZS .
Metody i modele
Metody statystyczne i bioinformatyczne
Dane zostały przetworzone za pomocą MS Excel. Aby uniknąć błędów wynikających z niewłaściwych założeń modelu, zastosowano jedynie podstawowe statystyki opisowe.
W niektórych przypadkach dane tylko z dnia przed lub po (lub obu) uśredniono (do średniej ruchomej z trzech dni) w celu zmniejszenia skutków widocznych artefaktów sprawozdawczych (Darwin’s natura non facit saltum,(Berry 1985)) bez tworzenia zbędnych uprzedzeń. Zastosowano dwa „wygładzacze”:
• uśrednianie X0 z poprzednimi x-1 (lub rzadko po x + 1) danymi oraz
• stosowanie średniej ruchomej (X-1, X0, X+1) → (2 X-1 + X0, X-1 + X0 + X+1, X0 + 2X=1) / 3
Żadne inne zmiany nie zostały zastosowane do danych.
Podobnie jak Chiny w połowie lutego, niemiecki Instytut Roberta Kocha (RKI) zmienił system raportowania w połowie marca, co spowodowało prawie 6-krotny wzrost danych zgłoszonych w dniu 20 marca w porównaniu do danych zgłoszonych w dniu 19 marca. Takie zmiany w systemach sprawozdawczych zwiększają trudności w interpretacji danych.
Modele epidemiologiczne
Jeśli choroba powoduje odporność dopiero po kilkudniowym okresie zakaźnym, jak ma to miejsce w przypadku chorób układu oddechowego, epidemia gaśnie wraz ze wzrostem odsetka osób z odpornością. Zgodnie z modelem SIR(Kermack 1991) dla liczby reprodukcyjnej(Dietz 1993) (wtórne infekcje po bezpośrednim kontakcie w podatnej populacji) R0 = 1,5–2,5 w ciągu 7 dni (wskaźnik wyzdrowień: γ = 1/7 = 0,14), zauważalna część epidemii trwa około 90–45 dni (R0/γ = β = .21– .36) w jednorodnej populacji 10M. Okres ten jest krótszy dla mniejszych, bardziej jednorodnych i dłuższy dla większych, bardziej niejednorodnych [heterogenicznych] populacji. Dla danego okresu zakaźnego 1/γ (tutaj, np. 7 dni. SARS i COVID-19 okres inkubacji plus 2 dni (Lauer 2020)), R0 określa również, ile czasu zajmie, aby wczesne przypadki stały się widoczne po pojedynczym imporcie (150–60 dni), szczytowe występowanie infekcji (5–22%) i liczba osób uodpornionych (55–90%). Aby umożliwić porównania między modelami, stosuje się arbitralny odsetek przypadków objawowych wśród osób zarażonych (0,05%) i zakłada się, że 2% przypadków umrze.
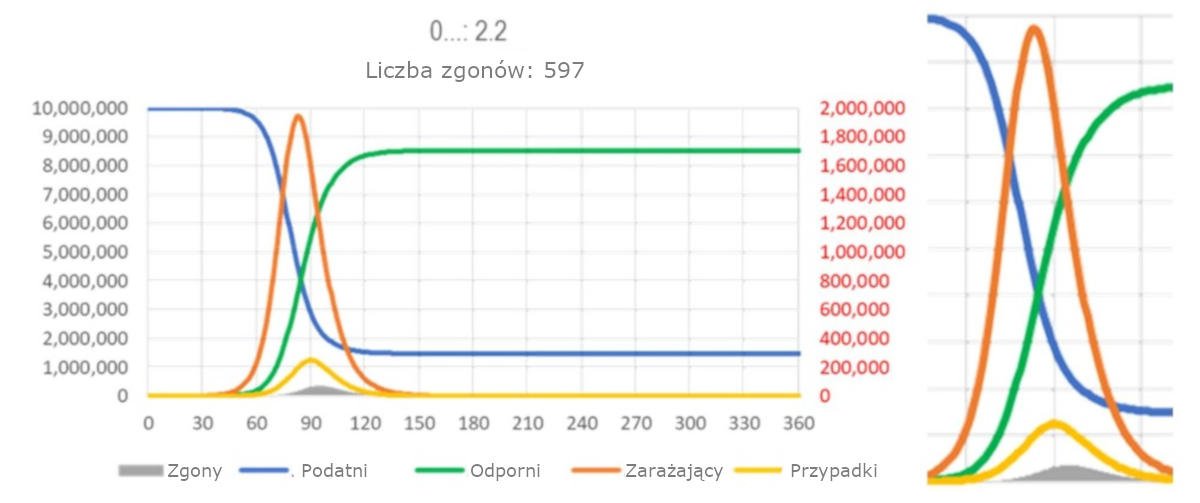
Ryc. 1: Model SIR dla SARS. Liczba osób podatnych (niebieski), zarażających (czerwony), odpornych (zielony), przypadków (pomarańczowy) i zgonów (szary) po tym jak populacja 10.000.000 podatnych osób zostanie narażona na 20 zakażonych osób przenoszących nowego wirusa. Założenia: R0 = 2,2, okres zakaźny = 7 dni (dostępny na stronie https://app.box.com/s/pa446z1csxcvfksgi13oohjm3bjg86ql )
Model odzwierciedla to, że kluczowe etapy epidemii, punkt zwrotny/połowa maksymalnego punktu w infekcjach (czerwony, dzień 68), punkt zwrotny/połowa maksymalnego punktu w liczbie przypadków (dzień 75, pomarańczowy), szczyt w infekcjach (dzień 83, kolor czerwony), szczyt przypadków (dzień 70, kolor pomarańczowy) i szczyt liczby zgonów (dzień 77, kolor szary) następują po sobie, po około tygodniu po poprzednim etapie.
Wyniki
Zachorowalność według kraju. Półkula Północna
Tabela 1 pokazuje surową dzienną zachorowalność według wielkości populacji w krajach o znaczeniu epidemiologicznym na półkuli północnej. Kraje znajdujące się w pobliżu są pogrupowane według najwyższej częstotliwości występowania (czerwone tło).
W prowincji Hubei w Chinach (ze stolicą Wuhan), Korei Południowej, Iranie, Włoszech (szczególnie w regionie Lombardii) i Hiszpanii odnotowuje się najwyższą częstość występowania, a następnie kraje sąsiadujące z Włochami.
Należy jednak zauważyć, że nie ma jednolitej definicji „przypadków zachorowań”. W niektórych krajach przypadek zachorowania musi mieć objawy, w innych krajach wystarczy mieć przeciwciała (być odpornym).
Tabela 1: Zachorowalność według kraju. Daty: 13 lutego (szczytowe nasilenie w Chinach kontynentalnych, głównie Hubei i sąsiednich prowincjach), 19 lutego do 22 marca. Kraje o niskiej liczbie ludności lub małej liczbie przypadków (ogółem) są ukryte. Czerwone tło wskazuje kraje/daty o wysokim wskaźniku. Kraje/regiony są posortowane według odległości między sobą i odległości od Chin kontynentalnych.

Przebieg czasowy według kraju/regionu
Wśród populacji w prowincji Hubei wynoszącej 58,5 miliona, zapadalność wzrosła od pierwszego zgłoszonego przypadku pod koniec 2019 roku do około 60 nowych przypadków na milion osób dziennie do 5 lutego 2020, a następnie systematycznie spadała (ryc. 1) z około 4.000 w dniu 5 lutego do poniżej 50 przypadków dziennie od dnia 8 marca.

Ryc. 2: Przypadki COVID-19 w Chinach kontynentalnych. Niebieski: przypadki/Milion/dzień, czerwony: zgony/M/d. Około 13 lutego definicja przypadku zachorowania została rozszerzona, co spowodowało dodanie kolejnych przypadków z poprzednich dni. W związku z tym przypadki z 13 lutego zostały obcięte. Większość przypadków zaobserwowano w prowincji Hubei z populacją 58,5 mln ludzi (wielkość populacji – patrz Tabela 1).
Do połowy stycznia 2020 roku, pierwsze przypadki COVID-19 zaobserwowano w innych krajach azjatyckich, ale częstość występowania utrzymywała się poniżej około 3/M/d poza kontynentalnymi Chinami, chociaż w Malezji/Brunei, Singapurze i Filipinach wzrosło do około 5/M/d. Co ciekawe w Japonii, z największym odsetkiem osób >65 lat na świecie (28%), liczba przypadków pozostaje poniżej 1,5/M/d. Krzywizna idąca w górę (ryc. 3) może jednak wskazywać na nadchodzącą epidemię bez jeszcze punktu zwrotnego.
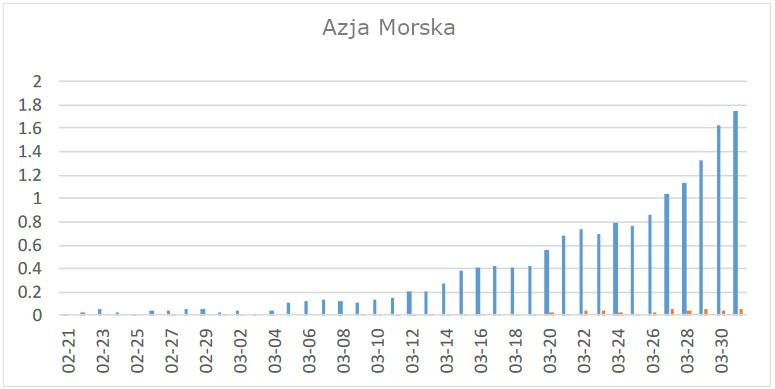
Ryc. 3: Przypadki COVID-19 w Azji Morskiej. Legenda ta sama co dla ryc. 1.
Jednak w kontynentalnej Korei Południowej (populacja 51 milionów, skumulowana zapadalność 192/M) zapadalność wkrótce wzrosła do wartości szczytowej około 14/M/d między 29 lutego a 2 marca, po czym spadła do mniej niż 150 przypadków na dzień ( 2,5/M/d) od 12 marca (ryc. 2a).
W Iranie (łączna zapadalność 385/M) zapadalność wzrosła około tydzień po Korei Południowej. Największa zapadalność przed 23 marca (około 15,5 przypadków/M/d) była mniej więcej taka sama. Następnie wzrost do 35–40 M/d może wskazywać na „odbicie” w populacji niewystarczająco uodpornionej przez poprzednią(e) fale. Śmiertelność w Iranie była znacznie wyższa i następowała wraz ze wzrostem liczby przypadków z oczekiwanym kilkudniowym opóźnieniem (ryc. 2b).
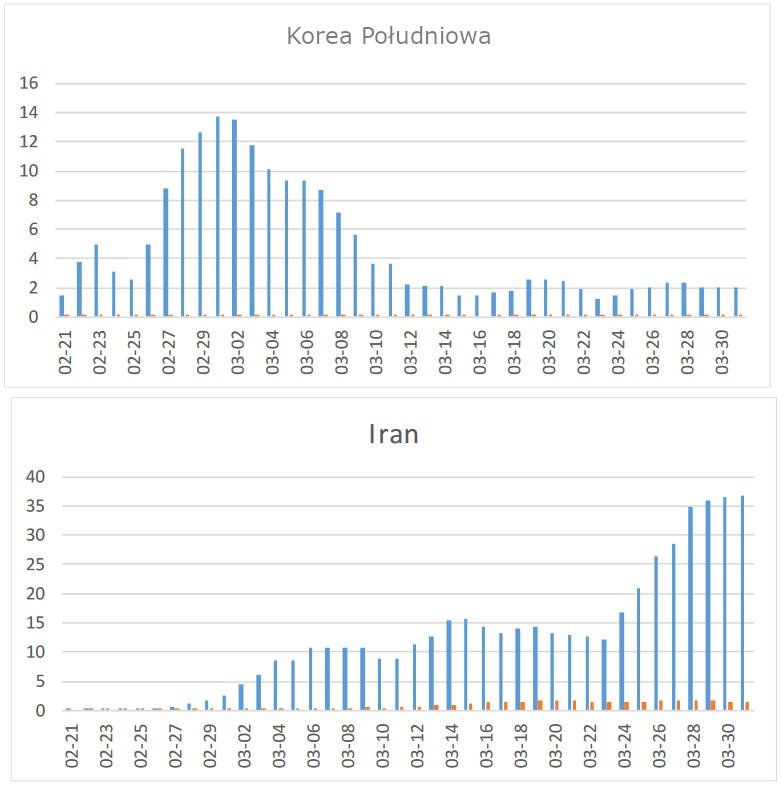
Ryc. 4: Przypadki COVID-19 w Korei Południowej i Iranie. Legenda ta sama co w ryc. 1.
W dniach 19 i 20 marca w kilku krajach europejskich odnotowano ponad dwukrotny wzrost liczby zgłoszonych przypadków (Niemcy: 570%, San Marino: 340%, Irlandia: 260%, Szwajcaria: 240%, Austria: 202%). Ponieważ natura non facit saltum (Darwin: natura nie skacze)(Berry 1985), tak nagłe wzrosty muszą, przynajmniej częściowo, wynikać z raportów lub innych artefaktów. Na przykład w Niemczech system zgłaszania został zmieniony między 16 a 19 marca, więc liczba ta prawdopodobnie obejmuje przypadki zgłoszone wcześniej tylko przez system równoległy. Francja, Włochy i Hiszpania również odnotowały niezwykły wzrost o 27–35 procent. Od 26 marca wszystkie te kraje zgłosiły spadek częstotliwości.
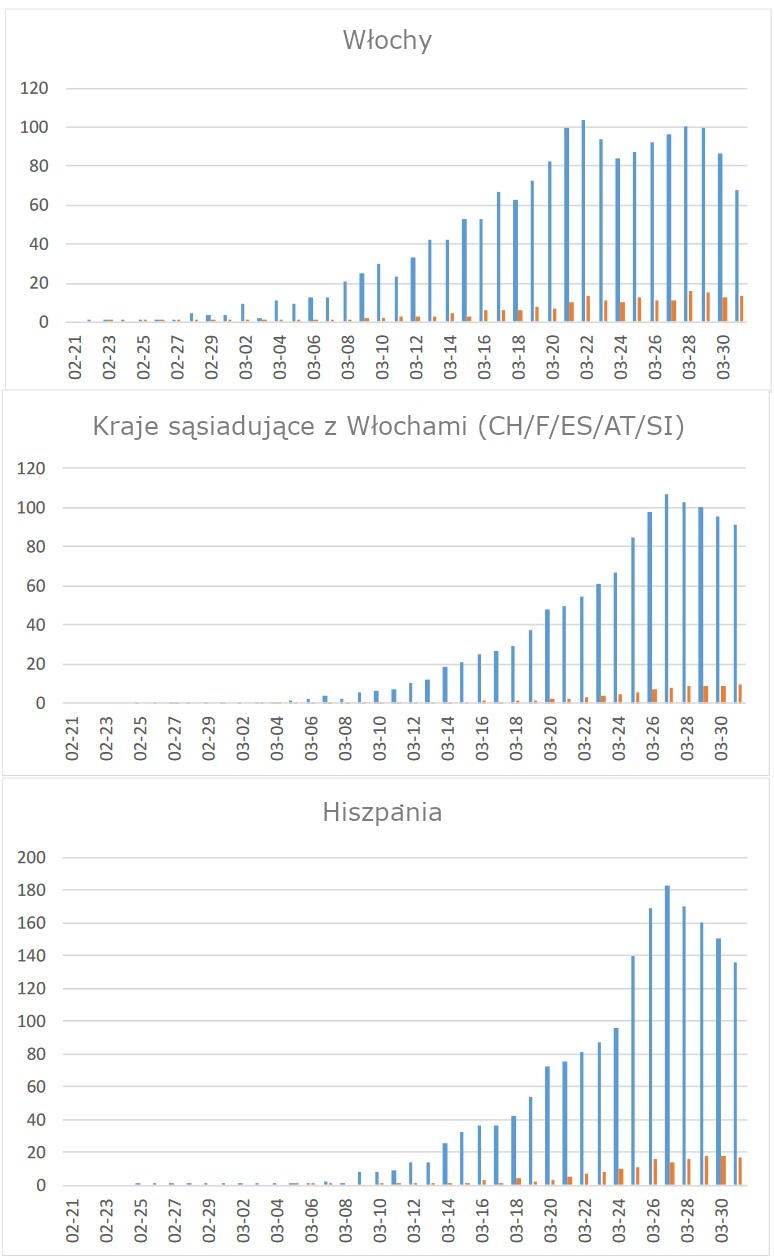
Ryc. 5: Przypadki COVID-19 we Włoszech i krajach sąsiednich. Włochy (u góry), kraje europejskie sąsiadujące z Włochami (IT+, środkowy wykres. Hiszpania pokazana również osobno. Legenda ta sama co dla ryc. 1.
Wśród krajów europejskich o liczbie mieszkańców przekraczającej 2 miliony, sąsiedzi Włoch, Hiszpania i Szwajcaria, mają obecnie większą łączną zapadalność na jednego mieszkańca niż Włochy (tabela 1, ryc. 3), mają wyższą zapadalność niż w prowincji Hubei (we wszystkich z populacją 50–60M jest również podobnie).
Ogólna epidemia w Europie (ryc. 4a) jest populacją średnią ważoną regionów o wysokiej zachorowalności (ryc. 4a, średnia ważona na ryc. 3) i pozostałych krajów o niskiej zapadalności (ryc. 4c).

Ryc. 6: Przypadki COVID-19 w Europie. Wczesny początek/wysoka śmiertelność (Włochy i sąsiedzi, u góry), łącznie (środkowa) i opóźniony początek/niska śmiertelność (inne kraje europejskie, u dołu). Legenda ta sama co dla ryc. 1.
Częstość występowania we Włoszech utrzymywała się poniżej szczytu 100/M/d przez 9 dni, po wzroście przez około 4 tygodnie od 1/M (od 26 lutego do około 22 marca, sąsiedzi: 1 marca do około 26 marca), podczas gdy zachorowalność w prowincji Hubei i Korei Południowej rosła tylko w ciągu 2 tygodni (19 stycznia do około 5 lutego, ryc. 2 i 21 lutego do 6 marca, ryc. 4). Inne kraje europejskie osiągnęły najwyższy poziom w 27-28 marca. Należy zauważyć, że w Niemczech odnotowano 61.913 przypadków zachorowań, ale tylko 583 zgony (0,9%, w okresie do 31 marca), mniej niż nawet Austria i znacznie mniej niż Francja, a w szczególności Włochy i Hiszpania.

Ryc. 7: Przypadki COVID-19 w wybranych krajach europejskich. Legenda ta sama co dla ryc. 1. Dane w Niemczech oparte są na przypadkach zgłaszanych elektronicznie do Instytutu Roberta-Kocha (RKI) i przesyłanych do Europejskiego Centrum ds. Zapobiegania i Kontroli Chorób [ECDC], ale RKI dostarcza również dwa źródła dla danych na swojej stronie internetowej, które trudno jest pogodzić z tymi danymi.
Szczególnie interesująca jest Szwecja, gdzie nie wdrożono żadnej polityki „dystansowania społecznego”. Mimo to nie było różnicy w kształcie epidemii ani wysokości jej szczytu w stosunku do innych krajów skandynawskich:

Ryc. 8: Przypadki COVID-19 w Skandynawii. Legenda ta sama co dla ryc. 1.
Epidemia w Ameryce Północnej rozpoczęła się później, szczególnie w Stanach Zjednoczonych (z wyjątkiem kilku odosobnionych przypadków prawdopodobnie importowanych bezpośrednio z Azji). Wzrost zapadalności jest zgodny z dynamiką wcześniejszej epidemii, a skumulowana zapadalność w Stanach Zjednoczonych (497/M) jest nadal niższa niż w Europie (747/M). Stany Zjednoczone mogły osiągnąć „punkt zwrotny”, w którym odsetek nowych przypadków zaczyna spadać (po osiągnięciu 50% szczytowej zapadalności) w okolicach 26 marca, w porównaniu z 22 marca w Europie. Sprawozdania z Kanady nie są wystarczająco spójne, aby móc wyciągać wnioski, chociaż poziomy mogą pozostać poniżej poziomów w USA. Nawet w Nowym Jorku, co jest szczególnie dotkliwe, liczba nowych przypadków wydaje się wyrównywać, choć liczba zgonów wciąż rośnie, wskazując na wyjątkowo wysoką śmiertelność zbliżającą się do 25%, nawet wyższą niż we Włoszech.
Covid-19 nie prowadzi do „typowego” zespołu ostrej niewydolności oddechowej
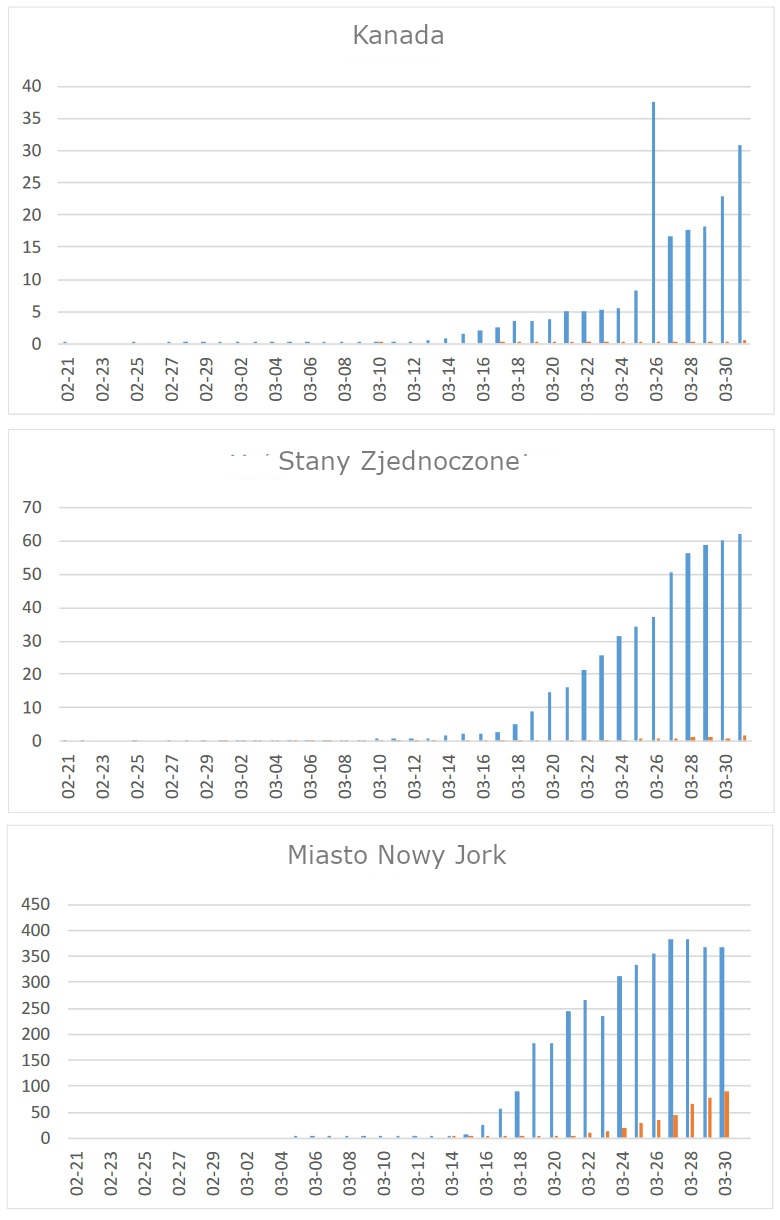
Ryc. 9: Przypadki COVID-19 w Ameryce Północnej. Legenda ta sama co dla ryc. 1. Wysokiego szczytu w danych kanadyjskich w dnia 26 marca nie można pogodzić z dynamiką rozprzestrzeniania się chorób układu oddechowego.
Zachorowalność według kraju. Półkula południowa.
W większej części półkuli południowej (z możliwym wyjątkiem Chile) odnotowano tylko kilka przypadków, ale Oceania (Australia i Nowa Zelandia) wykazuje dowody epidemii z najwyższą zachorowalnością w dniach 26-27 marca. Podobnie jak w Kanadzie, a wcześniej w Niemczech i innych krajach europejskich, pojedyncze skoki zwykle odzwierciedlają opóźnione zgłaszanie, a nie zmiany trendów zachorowalności. Liczba zgonów (20/5204 = 0,4%) jest wyjątkowo niska (ryc. 10).
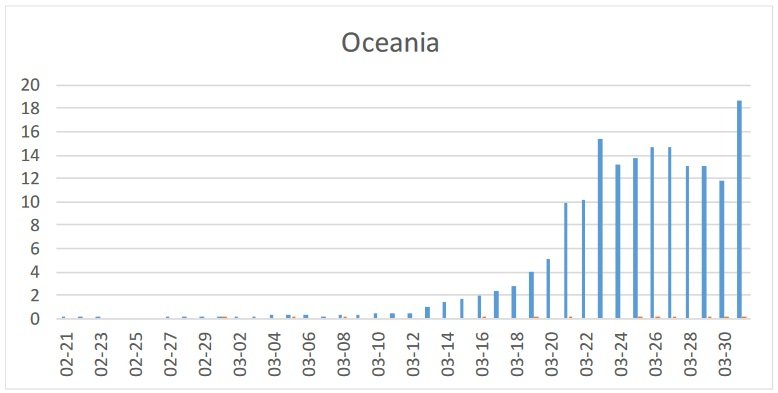
Ryc. 10: Przypadki COVID-19 w Oceanii (Australia i Nowa Zelandia). Legenda ta sama co dla ryc. 1.
Modelowanie wyników pod kątem skuteczności ograniczania rozprzestrzeniania (dystans społeczny)
Efekt zmniejszenia liczby reprodukcji poprzez zmniejszenie liczby kontaktów („ograniczanie rozprzestrzeniania”, „dystans społeczny”) zależy od tego, kiedy rozpocznie się w trakcie epidemii. Rycina 11 pokazuje efekt miesięcznej interwencji zmniejszającej R0 o połowę, zaczynając od punktu szczytowego rozpowszechnienia zakaźnych osobników. W porównaniu do ryciny 1 czas trwania epidemii jest skrócony, choć kosztem zmniejszenia stosunku Odpornych/Podatnych, tak aby kolejna epidemia z tym samym lub podobnym wirusem (odporność krzyżowa) mogła rozpocząć się wcześniej.
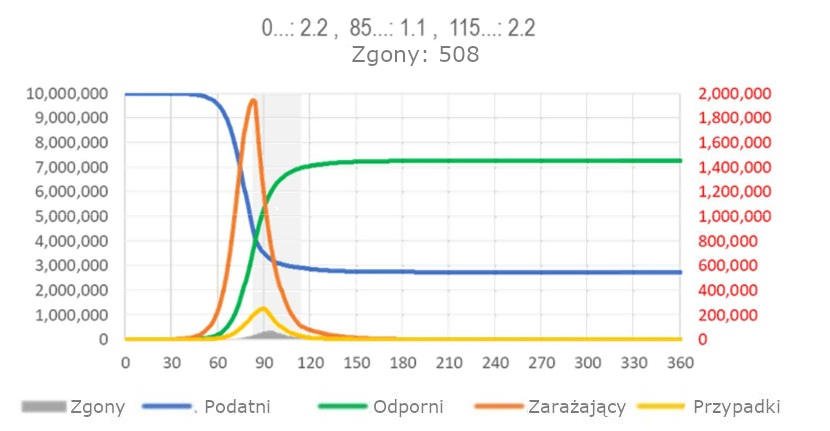
Ryc. 11: Model SIR dla SARS, okno możliwości szybkiej eliminacji epidemii. (Legenda ta sama co dla ryc. 1.).
Szary obszar wskazuje okres, w którym powstrzymywanie może zadać „coup de grace [cios ostateczny]” epidemii choroby układu oddechowego. Węższa krzywa dzwonowa z interwencją po szczycie wskazuje na zmniejszenie liczby infekcji, a tym samym zgonów (arkusz kalkulacyjny do obliczeń modelu dostępny na https://app.box.com/s/pa446z1csxcvfksgi13oohjm3bjg86ql)
[Model SIR jest modelem epidemiologicznym, który oblicza teoretyczną liczbę osób zakażonych zaraźliwą chorobą w zamkniętej populacji w czasie. Nazwa tej klasy modeli wynika z faktu, że obejmują one sprzężone równania dotyczące liczby podatnych osób S(t), liczby osób zakażonych I(t) i liczby osób, które wyzdrowiały R(t). – Źródło: SIR Model ]
Rycina 12 pokazuje miesięczną interwencję [izolowanie] rozpoczynającą się około dwa tygodnie wcześniej, w punkcie zwrotnym, w którym krzywa nowych przypadków zachorowań zmienia się z rosnącej szybko i przechodzi w wolniejsze tempo. Ta interwencja zmniejsza liczbę zgonów, ale epidemia wygasa dwa miesiące później, a stosunek Odpornych/Podatnych („odporność na stada”) jest jeszcze bardziej obniżany.
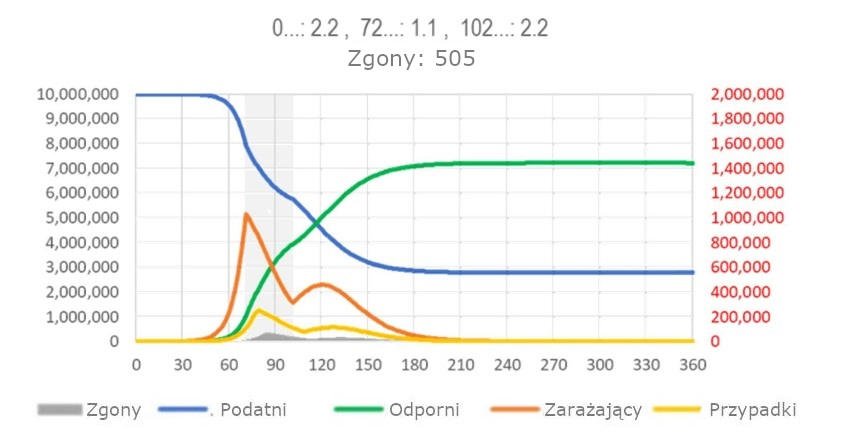
Ryc. 12: Model SIR dla SARS, okno możliwości maksymalnego zmniejszenia całkowitej liczby zgonów. (Legenda ta sama co dla ryc. 1.).
Szary obszar wskazuje okres, w którym ograniczenie rozpowszechniania może mieć największy wpływ na całkowitą liczbę zgonów. Jednak epidemia nie została wyeliminowana. (Arkusz kalkulacyjny do obliczeń modelu dostępny na stronie https://app.box.com/s/pa446z1csxcvfksgi13oohjm3bjg86ql)
Rycina 13 pokazuje efekt interwencji, która rozpoczyna się jeszcze wcześniej, około dwa tygodnie przed interwencją na ryc. 12. Nawet jeśli interwencja jest przedłużona z jednego do czterech miesięcy, nie powstaje odporność stada, a zatem epidemia odbija się i będzie trwać osiem miesięcy zamiast trzech (ryc. 1) lub mniej (ryc. 11).
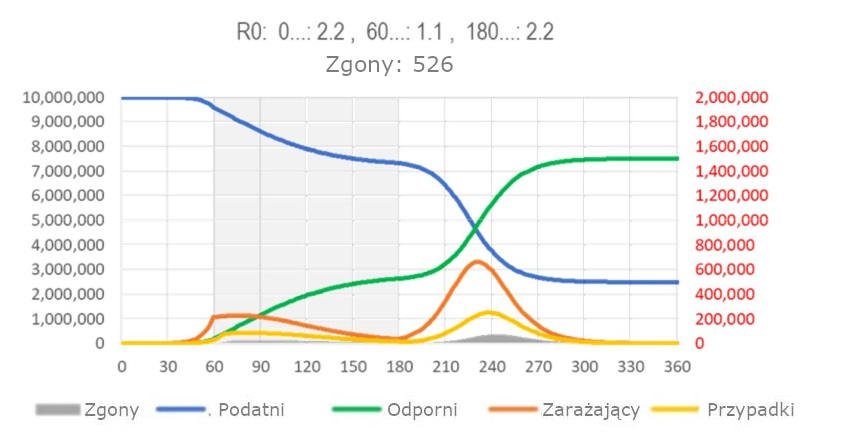
Ryc. 13: Model SIR dla SARS, efekt wczesnego dystansowania/blokady społecznej/zamknięcia kraju. (Legenda ta sama co dla ryc. 1). Zakłada się, że wysoce skuteczna interwencja zmniejsza R0 o 50% przez 4 miesiące, zaczynając od zauważenia pojawienia się nowego rodzaju przypadków. Odsetek przypadków objawowych (0,05%/d, tj. 0.35% zarażonych osób stanie się przypadkami objawowymi, a odsetek przypadków które umrą (2%) może się zmienić, ale omawiane tutaj kwestie są zasadniczo niezależne od tych założeń. (Arkusz kalkulacyjny do obliczeń modelu dostępnych na https://app.box.com/s/pa446z1csxcvfksgi13oohjm3bjg86ql)
Podsumowując, istnieje wąskie okno możliwości na interwencje („spłaszczanie krzywej”) mające na celu poprawę zdrowia publicznego poprzez zmniejszenie R0, aby odnieść sukces:
• Rozpoczynanie po szczytowym występowaniu (zakażeń) ma niewielki wpływ (nie ujęto). Krzywa opada, ale nie jest „spłaszczona”.
• Wprowadzenie w punkcie największego rozpowszechnienia zadaje epidemii „coup de grace [cios ostateczny]”, skracając jej czas trwania, aczkolwiek kosztem zmniejszenia stosunku Odpornych/Podatnych. Krzywa jest węższa, ale nie „spłaszczona” (ryc. 11).
• Zaczynając w punkcie rozkręcania się zapadalności szczytowej, „spłaszcza” krzywą bez jej poszerzania oraz maksymalizuje zapobieganie ilości zgonów, którym udało się zapobiec podczas obecnej epidemii, ale zmniejsza odporność stada, a tym samym szansę na kolejną epidemię (ryc. 12).
• Rozpoczynając przed wystąpieniem szczytu „spłaszcza krzywą”, ale również ją poszerza i powoduje odbicie, chyba że interwencja będzie kontynuowana przez wiele miesięcy (ryc. 13).
Odporność stada powstrzymuje rozprzestrzenianie się choroby zakaźnej, więc ogólnie rzecz biorąc, chciałoby się, aby epidemia początkowo przebiegła w sposób naturalny (lub nawet ją przyspieszyć, jak to tradycyjnie robili ludzie z „odrą”), aby zbudować odporność tak szybko jak to możliwe.
Odra w prasie i książkach, zanim pojawiła się szczepionka przeciw odrze
Aby skrócić czas trwania epidemii i jej wpływ na gospodarkę (a także wydłużyć czas do rozprzestrzenienia się następnej epidemii), należy poczekać, aż liczba osób zakaźnych (I) osiągnie szczyt (w powyższym modelu: dzień 83, czerwony).
Jednak bez powtarzających się szeroko zakrojonych testów, daty tej nie można bezpośrednio zaobserwować, ale wiadomo, że po szczytowym rozpowszechnieniu zarażonych osób około tygodnia przypada szczytowa liczba nowych przypadków [objawowych]. Jest już za późno na podjęcie decyzji, ale model SIR pokazuje, że ten szczyt jest poprzedzony dwa tygodnie wcześniej przez „punkt zwrotny”, gdy krzywa nowych przypadków [objawowych] zmienia się z rosnącej szybciej w wolniejszą (dzień 76). Punkt zwrotny można oszacować na podstawie zaobserwowanych przypadków w czasie do podjęcia decyzji. (Jest to również około 50% szczytowej liczby nowych przypadków, którą można przewidzieć.) Stąd, szczytowe występowanie (infekcji) następuje po punkcie zwrotnym/połowie szczytu (w liczbie przypadków) o około tydzień. Okazją do rozpoczęcia interwencji jest tydzień następujący po punkcie zwrotnym w liczbie przypadków dziennie.
Dyskusja
Mocne i słabe strony
Główną zaletą tej analizy danych epidemiologicznych jest to, że nie opiera się ona na modelach epidemiologicznych z wątpliwymi założeniami. Zamiast tego, wyniki odzwierciedlają surową zapadalność w miarę upływu czasu, jak donosi Europejskie Centrum ds. Zapobiegania i Kontroli Chorób [ECDC], przedstawione według kraju lub regionu krajów sąsiednich.
Wadą takiego całkowicie opartego na danych podejścia jest to, że brakuje mu wyrafinowania i potencjalnych dodatkowych informacji, które mogłyby pochodzić z dopasowania, np. modeli opartych na równiach różniczkowych. Jedynym przyjętym założeniem do modelowania jest to, że krzywe powinny być „gładkie” (z wyjątkiem przypadków, gdy podejrzewa się zgłaszanie artefaktów), ale nawet wtedy, dane były redystrybuowane tylko do dnia bezpośrednio sąsiadującego.
Mimo to dowody są wystarczająco silne, aby wyciągnąć jakościowe wnioski na temat możliwych scenariuszy rozprzestrzeniania się SARS-CoV-2 w najbliższej przyszłości. Wyniki sugerują również strategie badania zmienności szczepów wirusa SARS-CoV-2 i wyboru strategii zapobiegania.
Dowód na (co najmniej) dwa różne szczepy SARS-CoV-2
Podczas epidemii SARS w 2003 roku liczba nowych przypadków osiągnęła najwyższy poziom około trzy tygodnie po zauważeniu początkowego wzrostu liczby przypadków, a następnie spadła o 90% w ciągu miesiąca. Tabela 1 pokazuje odpowiednie punkty czasowe dla epidemii COVID-19 w 2020 roku.
Dane SARS-COV-2 sugerują również, że wykrycie epidemii zajmuje co najmniej miesiąc od pierwszego pojawienia się przypadku (zwykle po nim następują inne), około trzech tygodni do osiągnięcia największej liczby przypadków i miesiąca aby epidemia „ustąpiła”. Dane te są zgodne z wynikami z modelu SIR (patrz Modele Epidemiologiczne).
Tabela 2: Epidemiologiczne punkty czasowe według kraju. Góra: 2003 SARS, dół: 2020 SARS-CoV-2
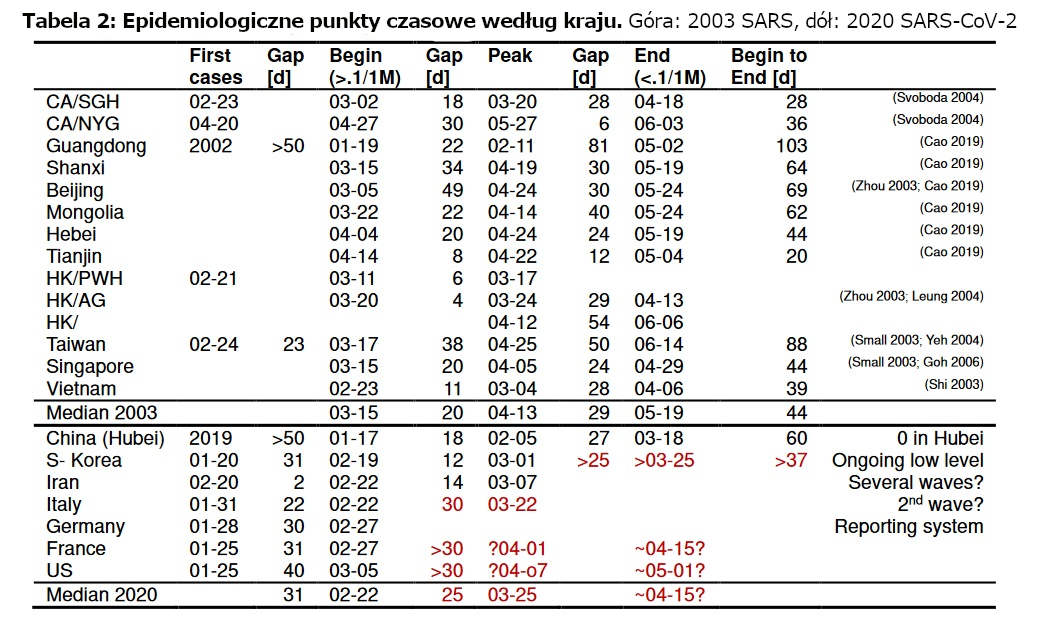
SARS z 2003 i SARS-CoV-2 z 2020 roku są nie tylko podobne w odniesieniu do genetyki (79% homologii),(Lu 2020) immunologii,(Ahmed 2020) udziału endocytozy (również w przypadku grypy i wirusów syncytialnych), (Behzadi 2019) zmienności sezonowej (ten sam sezon na półkuli północnej również z wirusami grypy, syncytialnymi i metapneumowirusami)(Olofsson 2011), ewolucji (pochodzenie od nietoperzy, 88% homologii),(Benvenuto 2020; Malik 2020), ale także w odniesieniu do czasu trwania między pojawieniem się i szczytem przypadków, a także między tym szczytem a ustąpieniem epidemii (Tabela 1). Na podstawie tych podobieństw można było przewidzieć, że epidemia COVID-19 zakończy się przed 15 kwietnia w Europie i około dwóch tygodni później w USA.
Czas i wysokość szczytowego występowania przypadków w różnych krajach są zgodne z hipotezą, że SARS-CoV-2 przemieszczał się krok po kroku na zachód z Chin, przez inne kraje azjatyckie na Bliski Wschód (Iran, Katar i Bahrajn), Europa Południowa (Włochy, następnie sąsiedzi Szwajcaria/Francja/Hiszpania/Austria/Słowenia), następnie Europa Środkowa i Północna, a na koniec Stany Zjednoczone.
Wirusy usprawniają swoje możliwości „przeżycia”, jeśli rozwiną strategie współistnienia z (ludzkim) gospodarzem.(Woolhouse 2007) Stwierdzono, że wiele koronawirusów współistnieje w populacjach nietoperzy.(Ge 2016) Pojawiające się dane o COVID-19 są zgodne z hipotezą, że rozwinęły się (przynajmniej) dwa szczepy SARS-CoV-2.
Jeden szczep, który powędrował do Korei Południowej, pozostał bardziej zaraźliwy, podczas gdy drugi szczep, który podróżował przez inne kraje azjatyckie, stracił większość ze swojej zaraźliwości. Szczep przechodzący przez Koreę Południową, a następnie Iran i Włochy (szczep SKII) wykazywał wysoką śmiertelność w Iranie i we Włoszech, ale mniejszą śmiertelność, gdy pojawił się u sąsiadów Włoch, albo z powodu różnic w systemach opieki zdrowotnej, ponieważ szczep mutował z powrotem, lub ponieważ szczep przybywający bezpośrednio z Azji miał tę zaletę, że rozprzestrzeniał się jako pierwszy. Tylko sekwencjonowanie próbek z tych krajów może pomóc odpowiedzieć na te pytania.
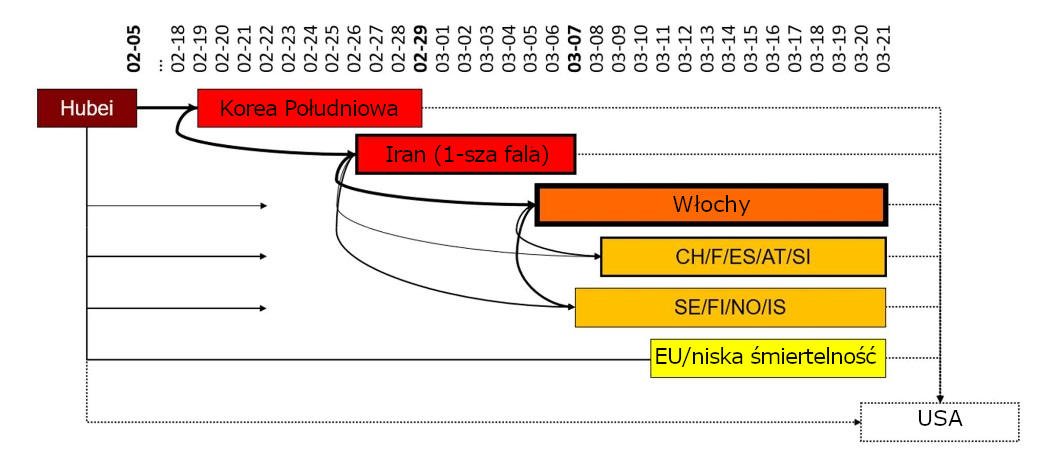
Ryc. 14: Hipotetyczne ścieżki transmisji wirusa. Szerokość linii łączącej: liczba kontaktów, kolory pól: zakaźność, obramowania pół: śmiertelność, połączenia kropkowane: nieznane. Data końcowa pola wskazuje datę wystąpienia szczytu, jeśli jest znana (pogrubiona data).
Zmiany zakaźności i śmiertelności między Chinami a Europą
Chiny kontynentalne nie zgłaszają już istotnej liczby nowych przypadków, a prowincja Hubei nie zgłasza nowych przypadków od 19 marca. Liczba nowych przypadków w Korei Południowej również spadła do niskiego poziomu od szczytu, który miał miejsce około 30 marca. Morska Azja Południowo-Wschodnia nadal wykazuje niski poziom nowych przypadków, wynoszący (<3 / M / d), z możliwym wyjątkiem Singapuru i Malezji/Brunei. Japonia i Filipiny powoli zbliżają się do zapadalności 2/M/d.
Dane są zgodne z tym samym szczepem „SKII” podróżującym z Chin przez Koreę Południową i Iran do Włoch. Iran został dotknięty około tydzień po Korei Południowej (około 7 marca), z podobną szczytową zapadalnością, ale wyższą śmiertelnością (czerwone słupki na ryc. 2). Dane sugerują również drugą falę infekcji w Iranie, która mogła być najwyższa w dniu 15 marca. Włochy oberwały tydzień po pierwszej fali w Iranie (która osiągnęła szczyt około 7-8 marca, ryc. 4a). Zapadalność we Włoszech osiągnęła znacznie wyższą zapadalność niż zgłaszana w Iranie. Szczyt zapadalności we Włoszech mógł zostać osiągnięty w dniu 22 marca (około 100/M/d).
Bez wystarczająco szczegółowych danych genetycznych nie jest jasne, czy wysoka śmiertelność we Włoszech jest spowodowana zmianami genetycznymi wirusa, czy też tym, że Włochy mają drugą najstarszą populację na świecie (po Japonii). Jednak raport z 20 marca Istituto Superiore di Sanita (COVID-19 Surveillance Group 2020) wskazuje, że wiek i choroby współistniejące odgrywały istotną rolę – wśród 3.200 zgonów, głównie w Lombardii i Emilia-Romana, mediana wieku wynosiła 80 lat (IQR 73-85, tylko 36 poniżej 50 roku życia), 98,8% osób które zmarły miały co najmniej jedno schorzenie współistnienie (nadciśnienie tętnicze: 74%, cukrzyca: 34%, choroba niedokrwienna serca: 30%, migotanie przedsionków, 22%, przewlekła niewydolność nerek : 20%, …).
Dane epidemiologiczne nie potwierdzają hipotezy, że SARS-CoV-2 rozprzestrzenił się z Monachium w Niemczech do Włoch(Kupferschmidt 2020). Zamiast tego wirus mógł rozprzestrzenić się z Włoch do sąsiednich krajów, Szwajcarii, Francji, Hiszpanii, Austrii i Słowenii, w ciągu zaledwie kilku dni od przybycia z Iranu. Najwyższa zapadalność wydaje się być mniejsza o połowę niż we Włoszech, a śmiertelność również jest niższa. Podczas gdy we Włoszech jest wiele osób w wieku 65 lat i starszych (23%, ustępując jedynie Japonii data.worldbank.org/indi-cator/SP.POP.65UP.TO.ZS), stosunkowo niewielkie różnice lub rozkład wieku w Europie (np. Niemcy: 21%) nie jest w stanie przypisać dużej części tej różnicy. Możliwym wyjaśnieniem (wskazanym na ryc. 6) jest to, że mniej zjadliwy(e) szczep(y) przybywające z innych części Azji mogły mieć przewagę w tych krajach, tak że importowane infekcje z Włoch spotkały się z osobami, u których już rozwinęła się (krzyżowa ) odporność na oba szczepy.
Części Europy nie dotknięte bezpośrednio przez szczep SKII osiągnęły poziom (około 40/M/d). Ogólnie wydaje się, że częstość występowania w Europie ustabilizowała się na poziomie około 60/M/d (a ostatnie nieprawidłowości w raportowaniu wydają się mieć mniejszy wpływ). Istnieją mocne dowody na to, że zapadalność maleje.
Prognozy dla COVID-19 w Ameryce Północnej
Z tabeli 1, SARS-CoV-2 pojawił się w USA prawie tydzień po przybyciu do Europy. Częstość występowania jest wciąż niska (obecnie około 60/M/d), ale już wykazuje oznaki wyrównywania.
Gdyby częstość występowania w Stanach Zjednoczonych osiągnęła wartość szczytową około 75/M/d, więcej niż w całej Europie, ale mniej niż we Włoszech i krajach sąsiednich (ryc. 4), można oczekiwać, że nowe przypadki osiągną ilość szczytową wynoszącą nawet do 25.000 dziennie, a skumulowana częstość występowania może osiągnąć 600/M (3-krotność liczby przypadków na milion osób w Korei Południowej, co stanowi dłuższy przebieg ze względu na wielkość krajów) lub łącznie 200.000 przypadków. Przy dwukrotnie większej niż obecnie zaobserwowano 1,7% śmiertelności w USA (w porównaniu z 1,5% w Korei Południowej), wystąpi około 6.000 zgonów, z czego 2.502 już zgłoszono. W Korei Południowej epidemia zakończyła swój przebieg, gospodarka i system polityczny są porównywalne z USA, a odsetek osób w wieku powyżej 65 lat jest podobny (14% vs 16%). Z drugiej strony liczby mogłyby się podwoić, gdyby szczep SKII uderzył w USA jako pierwszy szczep. Liczba 6.000–12.000 zgonów w USA w trakcie epidemii jest porównywalna z przewidywaną liczbą 16.000–78.000 zgonów na grypę w ciągu sezonu z powodu samego zapalenia płuc i powikłań układu oddechowego/krążenia, które występują również głównie wśród osób w wieku 65 lat i starszych. (Rolfes 2018)
Dokładna liczba umierających osób zależy od (a) szczepu wirusa, który jako pierwszy dostał się do USA oraz (b) od tego, jak wcześnie ludzie są leczeni przeciwko poważnym powikłaniom (np. zapalenie płuc).
Covid-19 nie prowadzi do „typowego” zespołu ostrej niewydolności oddechowej
Perspektywa historyczna
To nie pierwszy i prawdopodobnie nie ostatni raz, kiedy polityka zdrowia publicznego kierując się dobrymi intencjami jest niezgodna z naszym rozumieniem rozprzestrzeniania się epidemii. Na przykład podczas znacznej części epidemii HIV powszechny był strach, że HIV może się zadomowić w całej populacji, mimo że dane (w tym dane pokazujące brak przeniesienia na żony chorych na hemofilię)(Wittkowski 1995a) i modele(Wittkowski 1992; Seydel 1994) zaprzeczały temu strachowi(Wittkowski 1995b; 1996).
Wyniki te były wielokrotnie potwierdzane(Centers for Disease Control and Prevention 2019; Haddad 2019) . W przypadku heteroseksualnego przenoszenia HIV można było argumentować, że istnieje niewielkie ryzyko związane z polityką zdrowia publicznego promującą stosowanie prezerwatyw, ale w przypadku zapobiegania COVID-19 ignorowanie modeli i danych może nieść znaczne ryzyko.
Podczas epidemii AIDS epidemiolodzy mieli tę zaletę, że oprócz daty zgłoszenia, data diagnozy była dostępna do analizy, tak że różnice w opóźnieniach w raportowaniu, takie jak połowa lutego w Chinach, 20 marca w Niemczech, i 26 marca w Kanadzie. Niestety, w publicznych danych o COVID-19 brakuje tych informacji.
Implikacje związane z zapobieganiem
Głównym problemem związanym z chorobami układu oddechowego jest to, że nie można zatrzymać wszystkich łańcuchów zakażeń w rodzinach, wśród przyjaciół, sąsiadów… Nawet po kilku tygodniach „blokady” będzie kilka osób zakaźnych i dopóki w społeczeństwie będzie wystarczająca liczba podatnych osób, wystarczy, aby ponownie rozpocząć epidemię, dopóki w społeczeństwie nie będzie wystarczającej liczby osób odpornych, aby wytworzyć „odporność na stada”. Można by się spodziewać, że przypadki pojawią się falami (ryc. 13, okres „blokady” w USA odpowiada w USA okresowi od marca do maja 2020 r.). Takie fale przypadków były obserwowane w różnych krajach, a dłuższy niż oczekiwany czas trwania epidemii potwierdza hipotezę, że interwencje dystansowania społecznego/izolowania miały pewien skutek, choć kosztem około 10% ocalonych zgonów. Dłuższy czas od początku do szczytu w Europie (4 tygodnie) w porównaniu z Chinami, Koreą Południową i pierwszą falą w Iranie (dwa tygodnie) jest również zgodny z przedwczesnymi interwencjami (w celu „spłaszczenia krzywej”) przedłużającymi epidemię („poszerzenie krzywej”). W Oceanii częstość występowania wzrosła z 1/M/d w dniu 13 marca do szczytowego poziomu 15/M/d w dniu 27 marca, w ciągu dwóch tygodni przewidzianych przez model dla epidemii przybierających naturalny przebieg. Poza ograniczeniami dotyczącymi podróży (14-dniowa kwarantanna dla osób nie będących mieszkańcami i ograniczenia podróży między stanami, podobnie jak w innych krajach) rząd Australii zapewnił fundusze (https://www.health.gov.au/news/ alarmy zdrowotne / powieść-koronawirus-2019-ncov-alarm-zdrowotny / reakcja rządu-na-epidemię-kowboj-19, dostęp 03-30) na:
• dostarczenie pakietu wsparcia w wysokości 20,7 mld dolarów australijskich (800 dolarów AU na osobę) (inwestycje, praca, zdrowie)
• otwieranie klinik i finansowanie dostaw do domu leków na receptę.
Szczytowa częstość występowania wynosząca 15/M/d oraz całkowita częstość wynosząca 155/M są podobne do Korei Południowej (14/189) i porównywalne z mniej gęsto zaludnionymi krajami europejskimi (Słowacja: 20/168, Finlandia: 16/203, Grecja: 10/116). W związku z tym epidemia Oceanii wraz z Chinami, Koreą Południową i Iranem jest zgodna z wynikami modelu sugerującymi, że naturalnie przebiegająca epidemia Covid-19 osiąga wartość szczytową dwa tygodnie po pierwszych zaobserwowanych przypadkach, a następnie maleje dzięki pomocy finansowej i medycznej od rządu w celu zapobiegania zgonom w celu zmniejszenia obciążenia systemu opieki zdrowotnej i szkód w gospodarce. Podobnie jak w Szwecji, nie wprowadzono żadnych zasad „dystansu społecznego”.
Ta analiza publicznie dostępnych danych sugeruje, że w czasie, gdy Włochy nałożyły kwarantannę na Lombardię i sąsiednie regiony w dniu 8 marca, szczep wirusa SKII dotarł już do krajów przyległych (Szwajcaria, Francja, Hiszpania, Austria, Słowenia). Mimo że blokada rozpoczęła się wcześnie (8 marca), co mogło spowodować odbicie zgodne ze spadkiem przestrzegania zaleceń.
W Stanach Zjednoczonych „punkt zwrotny” (50% szczytowej zapadalności) mógł zostać osiągnięty około 27 marca. Mimo to restauracje w Nowym Jorku, New Jersey i Connecticut otrzymały nakaz zamknięcia w dniu 20 marca; zamknięcie Kalifornii ogłoszono w dniu 19 marca (zarządzenie N-33-20). Ponieważ nakazano zdystansowanie społeczne, zanim epidemia osiągnęła punkt zwrotny, należy się spodziewać „spłaszczonej krzywej”, ale krzywa będzie również szersza. (Wirus pozostanie dłużej w populacji).
Niektóre strategie ograniczania rozprzestrzeniania mogą nawet przynieść efekt przeciwny do zamierzonego na inne sposoby.
Na przykład prosty model zastosowany na ryc. 13 nie uwzględnia stratyfikacji ze względu na wiek. W przypadku chorób takich jak COVID-19 u dzieci rozwija się głównie łagodna postać, a osoby starsze mają wysokie ryzyko śmierci. (Zimmermann Curtis 2020)
Stąd ograniczanie rozprzestrzeniania wśród grup wysokiego ryzyka, takich jak osoby starsze w domach opieki (patrz przykład ze stanu Waszyngton) jest bardzo skuteczne w ochronie ich przed zarażeniem i zmniejszeniu liczby dzieci i młodych dorosłych, którzy musieliby zostać zarażeni, aby osiągnąć odporność stada. Znaczny wzrost czasu trwania epidemii poprzez zapobieganie rozwojowi odporności wśród młodych ludzi może jednak utrudniać skuteczne ograniczanie rozprzestrzeniania wśród osób starszych, a tym samym zwiększać liczbę zgonów wśród osób starszych.
W całych Stanach Zjednoczonych „punkt zwrotny” dla nowych przypadków nie mógł mieć miejsca wcześniej niż przed 25 marca. Dane dotyczące przypadków zachorowań dla Nowego Jorku są niespójne, ale New York Times donosi, że Nowy Jork i Detroit osiągnęły punkt zwrotny w dniu 19 marca. Przy takim założeniu optymalny moment rozpoczęcia interwencji na poziomie zdrowia publicznego w Nowym Jorku w celu skrócenia czasu trwania i wpływu epidemii COVID-19 był około 27 marca. Dystansowanie społeczne w Nowym Jorku, jednym z epicentrów epidemii w USA, rozpoczęło się około 17 marca (dzień 73 w modelu) poprzez zamkniecie restauracji, a nasiliło się w dniu 22 marca (dzień 78), zamykając wszystkie nieistotne firmy. Omówiono zniesienie ograniczeń, które miały zostać zniesione w dniach 12 lutego (dzień 100, z powodu świąt wielkanocnych) lub 30 kwietnia (dzień 117). Model przewiduje, że interwencja do Wielkanocy zmniejszy liczbę zgonów w Nowym Jorku i Detroit (i prawdopodobnie w niektórych innych częściach USA, ale wirus nadal będzie się plątał przez kolejne trzy miesiące, tak więc nie będzie bezpieczny dla osób (starszych) wysokiego ryzyka chcących brać udział w tegorocznych obchodach Świąt Wielkanocnych. Wydłużenie dystansowania społecznego do końca kwietnia znacznie zmniejszy, ale nie wyeliminuje, liczbę osób zakaźnych pozostających w populacji (ryc. 15).
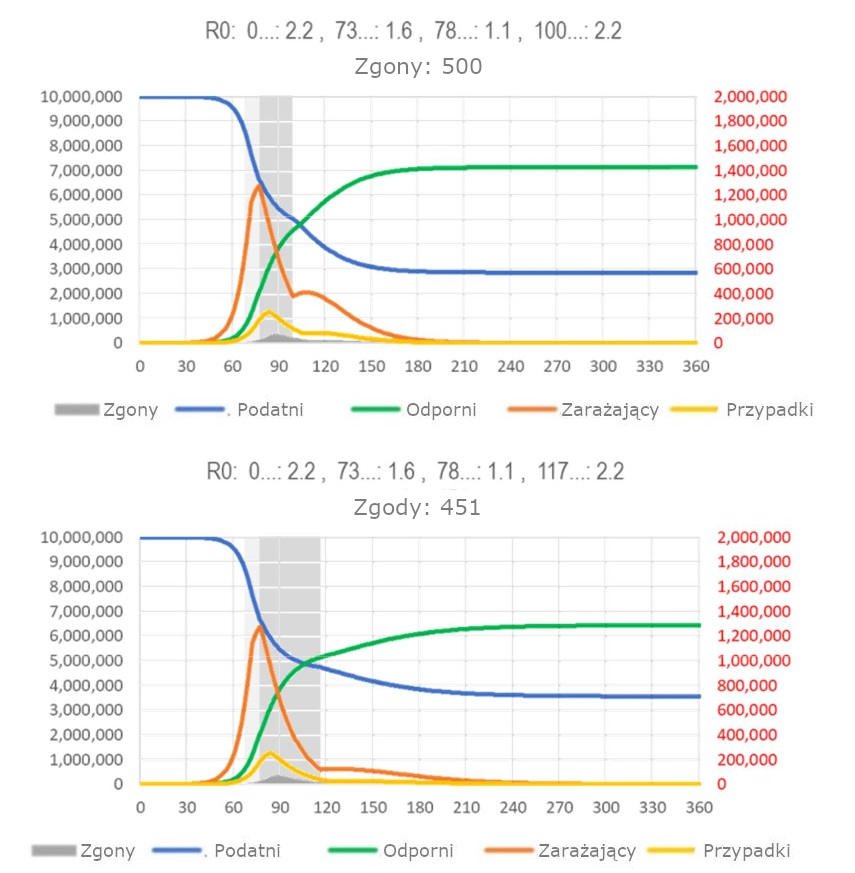
Ryc. 15: Model SIR dla SARS, z ograniczeniami. (Legenda ta sama co dla ryc. 1). Szare obszary wskazują okresy ograniczeń niskiej (dzień 5) i wysokiej intensywności (22/40 dni)
Wnioski
Dopóki szczepionka nie będzie dostępna, jedyną strategią farmakologiczną mającą na celu zmniejszenie liczby zgonów jest ograniczenie szkód wywołanych przez infekcję (i układ odpornościowy), np. poprzez zmniejszenie początkowego miana wirusa (Chu 2004) i upewnienie się, że ludzie zostaną poddani leczeniu po wystąpieniu najwcześniejszych objawów zapalenia płuc.
Hydroksychlorochina – czy działa na koronawirusa? – Dr Vladimir Zelenko
Ponieważ krzywa nowych przypadków spłaszcza się w Stanach Zjednoczonych i utrzymuje na poziomie około 20.000 dziennie, a odsetek umierających przypadków stabilizuje się na poziomie ~ 2% (z różnicami regionalnymi), liczba zgonów stabilizuje się na poziomie około 400/dzień (jedna czwarta z nich w Nowym Jorku) i zaczyna maleć (ogólnoświatowa cecha COVID-19) z tygodniowym opóźnieniem.
Przy spodziewanej całkowitej liczbie mniejszej niż 10.000 zgonów, dystansowanie społeczne może ograniczyć liczbę zgonów o 1.000 kosztem 2 miliardów dolarów (2 mld dolarów USD na przypadek), ale przedłużenie epidemii może również zwiększyć liczbę zgonów, ponieważ wczesne zapobieganie narażenia młodych ludzi na infekcje oznacza, że więcej osób starszych zarazi się przed osiągnięciem poziomu odporności stada.
Oprócz oddzielania podatnych/wrażliwych populacji (osób starszych i osób wysokiego ryzyka, np. w domach opieki) od epidemii, która jest skuteczna tak długo, jak długo krąży wirus, interwencja zdrowia publicznego mająca na celu ograniczenie rozprzestrzeniania chorób układu oddechowego musi rozpocząć się w wąskim zakresie okna możliwości zaczynającego się w momencie lub tydzień po tym jak krzywa nowych przypadków zmienia się z szybko rosnącej na coraz wolniejsze tempo.
Tylko gdy uniknie się sytuacji w której epidemia zostanie powstrzymana na etapie zanim zostanie wygenerowana wystarczająca liczba osób z odpornością, wysiłki mające na celu ograniczenie rozpowszechniania/zarażania mogą zakończyć się po upływie około miesiąca lub dwóch (odpowiednio w zależności od późnego lub wczesnego startu), kiedy stosunek osób zakaźnych do odpornych jest wystarczająco niski, aby zapobiec odbiciu się choroby.
W sytuacji gdy przegapiono tę szansę, ograniczanie rozpowszechniania/zarażania ma jedynie ograniczony wpływ na przebieg epidemii, ale ma duży wpływ na gospodarkę i społeczeństwo.
Ponieważ epidemie w Azji morskiej i na półkuli południowej są nadal możliwe, a niektóre rozwiną się w ciągu najbliższych tygodni, wykorzystanie danych i naukowo uzasadnionych modeli może pomóc w interwencjach czasowych w celu zoptymalizowania ich skutków.
Aby ustalić ten punkt czasowy, zebrane i zgłoszone dane przypadku muszą zawierać nie tylko datę zgłoszenia, ale także datę „diagnozy” oraz informację, czy u pacjenta wystąpiły objawy kliniczne, czy tylko wynik testu był pozytywny, a także czy u pacjenta stwierdzono obecność krążącego wirusa RNA/DNA (obecnie zakaźny pacjent) lub przeciwciała (już odporny).
Przypisy:
- Ahmed SF, Quadeer AA, et al. (2020). Preliminary Identification of Potential Vaccine Targets for the COVID-19 Coronavirus (SARS-CoV-2) Based on SARS-CoV Immunological Studies. Viruses 12(3).
- Behzadi MA, Leyva-Grado VH (2019). Overview of Current Therapeutics and Novel Candidates Against Influenza, Respiratory Syncytial Virus, and Middle East Respiratory Syndrome Coronavirus Infections. Frontiers in microbiology 10: 1327.
- Benvenuto D, Giovanetti M, et al. (2020). The global spread of 2019-nCoV: a molecular evolutionary analysis. Pathog Glob Health: 1-4.
- Berry RJ (1985). Natura non facit saltum. Biological Journal of the Linnean Society 26(4): 301-5.
- Cao W, Fang L, et al. (2019). What we have learnt from the SARS epdemics in mainland China? Global Health Journal 3(3): 55-9.
- Cascella M, Rajnik M, et al. (2020). Features, Evaluation and Treatment Coronavirus (COVID-19). StatPearls. Treasure Island (FL), StatPearls Publishing.
- Centers for Disease Control and Prevention (2019). Estimated HIV incidence and prevalence in the United States, 2010-2016. HIV Surveillance Supplemental Report 24(1).
- Chu CM, Poon LL, et al. (2004). Initial viral load and the outcomes of SARS. Cmaj 171(11): 1349-52.
- COVID-19 Surveillance Group (2020). Characteristics of COVID-19 patients dying in Italy Report based on available data on March 20th, 2020. Rome, Italy, Istituto Superiore di Sanita.
- Dietz K (1993). The estimation of the basic reproduction number for infectious diseases. Stat Methods Med Res 2(1): 23-41.
- Ge XY, Wang N, et al. (2016). Coexistence of multiple coronaviruses in several bat colonies in an abandoned mineshaft. Virol Sin 31(1): 31-40.
- Goh KT, Cutter J, et al. (2006). Epidemiology and control of SARS in Singapore. Ann Acad Med Singapore 35(5): 301-16.
- Haddad N, Robert A, et al. (2019). HIV in Canada-Surveillance Report, 2018. Can Commun Dis Rep 45(12): 304-12.
- Jernigan DB (2020). Update: Public Health Response to the Coronavirus Disease 2019 Outbreak – United States, February 24, 2020. MMWR Morb Mortal Wkly Rep 69(8): 216-9.
- Kermack WO, McKendrick AG (1991). Contributions to the mathematical theory of epidemics–I. 1927. Bull Math Biol 53(1-2): 33-55.
- Kupferschmidt K (2020). Genome analyses help track coronavirus’ moves. Science 367(6483): 1176-7.
- Lauer SA, Grantz KH, et al. (2020). The Incubation Period of Coronavirus Disease 2019 (COVID-19) From Publicly Reported Confirmed Cases: Estimation and Application. Ann Intern Med.
- Leung GM, Hedley AJ, et al. (2004). The epidemiology of severe acute respiratory syndrome in the 2003 Hong Kong epidemic: an analysis of all 1755 patients. Ann Intern Med 141(9): 662-73.
- Lu R, Zhao X, et al. (2020). Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet 395(10224): 565-74.
- Malik YS, Sircar S, et al. (2020). Emerging novel coronavirus (2019-nCoV)-current scenario, evolutionary perspective based on genome analysis and recent developments. Vet Q 40(1): 68-76.
- Olofsson S, Brittain-Long R, et al. (2011). PCR for detection of respiratory viruses: seasonal variations of virus infections. Expert Rev Anti Infect Ther 9(8): 615-26.
- Ren SY, Gao RD, et al. (2020). Fear can be more harmful than the severe acute respiratory syndrome coronavirus 2 in controlling the corona virus disease 2019 epidemic. World J Clin Cases 8(4): 652-7.
- Rogers K, Jakes L, et al. (2020). Trump Calls It the ‘Chinese Virus.’ Critics Say That’s Racist and Provocative. New York Times. New York, A.G. Sulzberger: 11.
- Rolfes MA, Foppa IM, et al. (2018). Annual estimates of the burden of seasonal influenza in the United States: A tool for strengthening influenza surveillance and preparedness. Influenza Other Respir Viruses 12(1): 132-7. Dwie epidemie COVID-19
- Seydel J, Kramer A, et al. (1994). Backcalculation of the number infected with human immunodeficiency virus in Germany. J Acquir Immune Defic Syndr 7(1): 74-8.
- Shi Y (2003). Stochastic dynamic model of SARS spreading. Chinese Science Bulletin 48: 1287-92.
- Small M, Shi P, et al. (2003). Plausible models for propagation of the SARS virus. Trans Fundam Electron, Commun Comput Sci E87-A.
- Svoboda T, Henry B, et al. (2004). Public health measures to control the spread of the severe acute respiratory syndrome during the outbreak in Toronto. N Engl J Med 350(23): 2352-61.
- Wittkowski KM (1992). Estimates of HIV prevalence in Germany and the U.S. – Sensitivity to assumptions concerning reporting delays and incubation time. VIII International Conference on AIDS / III STD World Congress, Amsterdam, NL, Congrex Holland.
- Wittkowski KM (1995a). Entwicklung der HIV-Epidemie bei Hämophilen anhand der Zahlen des Robert-Koch-Instituts (Berlin). 25 Hämophilie-Symposion, Hamburg 1994. I Scharrer and W Schramm. Berlin, D, Springer: 20-8. Dwie epidemie COVID-19
- Wittkowski KM (1995b). [Epidemiology of HIV in Germany]. Gesundheitswesen 57(5): 291-8.
- Wittkowski KM (1996). [Epidemiology of HIV in Germany (status: 30 June 1995)–transmission among heterosexuals and value of HIV screening programs]. Gesundheitswesen 58(4): 229-33.
- 33. Woolhouse M, Gaunt E (2007). Ecological origins of novel human pathogens. Crit Rev Microbiol 33(4): 231-42. Dwie epidemie COVID-19
- Yeh SH, Wang HY, et al. (2004). Characterization of severe acute respiratory syndrome coronavirus genomes in Taiwan: molecular epidemiology and genome evolution. Proc Natl Acad Sci U S A 101(8): 2542-7.
- Zhou G, Yan G (2003). Severe acute respiratory syndrome epidemic in Asia. Emerg Infect Dis 9(12): 1608-10. It is made available under a CC-BY-ND 4.0 International license .
Z logicznego punktu widzenia, stosowanie szczepionek „dożylnie” to jakaś turbo bzdura. Szczególnie, że skład szczepionek pozostawia bardzo dużo do życzenia