Szczepionki z zaciskiem molekularnym: lekcje wyciągnięte z porażki
„Zacisk molekularny to polipeptyd używany do utrzymywania kształtu białek w niektórych eksperymentalnych szczepionkach. W wirusach, białka przed fuzją na ich powierzchni stanowią atrakcyjny cel dla reakcji immunologicznej. Jednakże, jeśli białka te zostaną usunięte lub wytworzone za pomocą technologii rekombinacji, tracą swój kształt i tworzą coś, co nazywa się „formą po fuzji”. Gdy są częścią wirusa, białka te zachowują swoją formę poprzez tworzenie czwartorzędowej struktury z innymi białkami wirusowymi. Stan przed fuzją białka jest wyższym energetycznie stanem metastabilnym. Dodatkowa energia jest wykorzystywana do pokonania bariery aktywacji fuzji z błoną komórkową. Białko wirusa (lub jego część) w połączeniu z polipeptydem zaciskowym nazywane jest polipeptydem chimerycznym.
Białka przed fuzją (lub podjednostki) z następujących wirusów zostały ustabilizowane w eksperymentach za pomocą techniki zacisku molekularnego: odra, HIV, grypa, ebola i RSV. Naukowcy z University of Queensland próbowali stworzyć szczepionkę przy użyciu tej metody dla SARS-CoV-2. Rozwój szczepionki został sfinansowany przez Koalicja na rzecz Innowacji w Zakresie Gotowości na Epidemię [Coalition for Epidemic Preparedness Innovations], która z kolei otrzymała fundusze od Fundacji Gatesów, a także rządów Norwegii, Japonii i Niemiec. Rozwój szczepionki został anulowany 11 grudnia 2020 roku podczas badania klinicznego I fazy, po tym jak okazało się, że pewna liczba uczestników badania uzyskiwała fałszywie pozytywne wyniki testów na obecność przeciwciał HIV, gdy w rzeczywistości nie mieli wirusa HIV.
Było to spowodowane tym, że fragment wirusa HIV zastosowany jako zacisk molekularny prowadził do „częściowej odpowiedzi przeciwciał” na HIV. Jest to niepożądany wynik, ponieważ będzie on kolidował z przyszłymi testami przesiewowymi na HIV dla dotkniętych uczestników.
Od czasu porzucenia szczepionki na COVID, zacisk jest ponownie konstruowany w celu wykorzystania białek innych niż HIV.
Zacisk molekularny jest zbudowany z reszt aminokwasowych we wzorze, który powtarza się po każdych siedmiu resztach i musi mieć długość co najmniej 14 reszt. Zacisk składa się samoczynnie w podwójną helisę, w której jedna nić biegnie do przodu, a druga do tyłu. Parowanie aminokwasów w splotach jest zapewnione przez wzór aminokwasów hydrofobowych i hydrofilowych. Wzór ten jest tak ułożony, że żaden z nich nie związuje się z białkiem wirusa. Klamra samoczynnie składa się w sztywny pręcik. Zacisk jest połączony z pożądaną częścią białka wirusa za pomocą łącznika. Łącznik może pełnić inne funkcje, np. umożliwiać oczyszczanie białka chimerycznego z mieszaniny.” – Źródło: Wikipedia
Szczepionki zawierające zaciski molekularne
Źródło: Nature, Molecular clamp vaccines: lessons from a setback
Chociaż prace nad pierwszą iteracją (powtórzeniem) szczepionki przeciwko COVID-19 na Uniwersytecie Queensland nie będą kontynuowane, proces ten doprowadził do rozwinięcia technologii opracowywania szczepionek opartych na szybko reagujących „zaciskach molekularnych”.
Pod koniec 2020 roku podjęto decyzję o zaniechaniu dalszych prób szczepionki na COVID-19 opracowywanej przez Uniwersytet Queensland (UQ) we współpracy z firmą biotechnologiczną CSL, po tym jak uczestnicy badania klinicznego 1 fazy uzyskali słabe fałszywie dodatnie wyniki badań przesiewowych na obecność wirusa HIV w niektórych testach. Chociaż nie mieli szans na zakażenie wirusem HIV, implikacje dla testów na HIV w Australii i dla przyjmowania szczepionki uznano za wystarczające, aby przekierować znaczące zobowiązania rządu australijskiego na inne obszary, takie jak dostarczanie większej liczby dawek szczepionki Oxford/AstraZeneca.
Naukowcy zaangażowani w rozwój szczepionki, wyprodukowanej przy użyciu zastrzeżonej przez UQ „technologii zacisków molekularnych”, byli rozczarowani, ale niektóre aspekty pracy dodały im otuchy. „Grupa była zdruzgotana, ponieważ chcieliśmy pomóc” – mówi profesor Paul Young, współkierujący projektem wraz z docentem Keithem Chappellem. „Ale wynieśliśmy z projektu wiele pozytywów: jesteśmy dalej na linii walidacji technologii platformy i jesteśmy bardzo pewni siebie idąc naprzód”.
Dlaczego zaciski w szczepionkach?
Wirusy otoczkowe, takie jak SARS-CoV-2, wirus odpowiedzialny za COVID-19, zakażają gospodarza za pośrednictwem białek wystających z ich powierzchni, które wiążą się i łączą z błoną komórki docelowej, umożliwiając wirusowi wniknięcie do komórki. Te białka fuzyjne są podstawą wielu szczepionek podjednostkowych, czyli takich, w których wstrzykuje się część patogenu będącego przedmiotem szczepienia, aby skłonić organizm do skutecznego wytworzenia odpowiedzi immunologicznej, która może chronić przed „żywym” wirusem.
Białko fuzyjne lub kolcowe wirusa SARS-CoV-2 jest trimerem: grupą trzech jednostek, z których każda składa się z podjednostki wiążącej receptor, S1, i podjednostki odpowiedzialnej za fuzję, S2. Trzy podjednostki S1 i S2 tworzą kolec fuzyjny osadzony w błonie wirusowej i utrzymywany w bardzo szczególnej konformacji do momentu związania się z komórką docelową.
„Białko fuzyjne na powierzchni wirusa zachowuje się jak pułapka na myszy, ponieważ jest utrzymywane w bardzo napiętej formie” – wyjaśnia Young. Związanie się z receptorem wyzwala bardzo szybką zmianę strukturalną – niektóre części białka odwracają się o 180°, przyciągając do siebie błonę wirusa i błonę gospodarza, co pozwala im się połączyć.
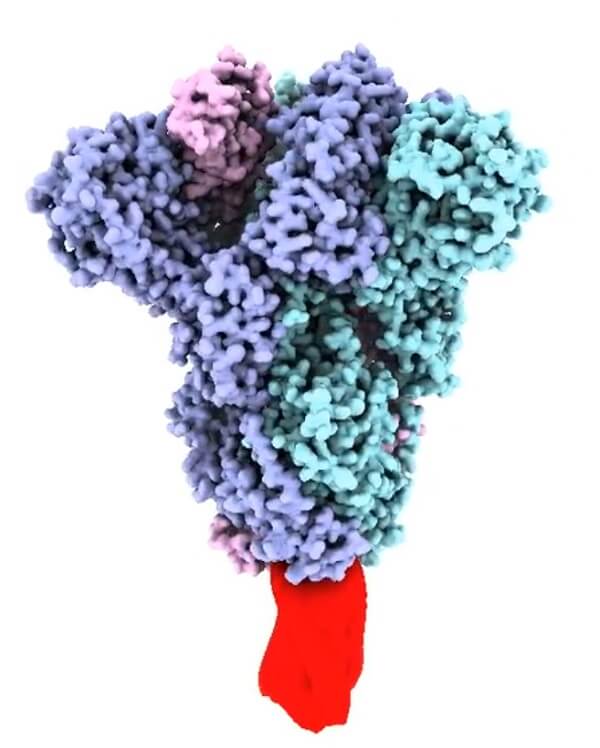
Model strukturalny trimerycznej ektodomeny białka kolcowego SARS-CoV-2 (opracowany przez D. Wattersona), stabilizowanej przez zacisk molekularny (czerwony).
„Kłopot polega na tym, że ostateczna stabilna po fuzyjna forma białka nie jest tym, co znajduje się na powierzchni wirusa, a więc nie jest odpowiednią formą do stymulowania silnej ochronnej odpowiedzi immunologicznej po podaniu szczepionki. Wiele ważnych miejsc antygenowych na białku kolcowym staje się ukrytych lub znika, ponieważ dosłownie zmieniają one kształt.” Ta sama zmiana konformacyjna zachodzi, gdy białko kolcowe jest izolowane lub wytwarzane za pomocą technologii rekombinacji w celu wytworzenia rozpuszczalnej szczepionki podjednostkowej.
Technologia zacisku molekularnego z Uniwersytetu Queensland została zaprojektowana tak, aby utrzymać białko kolcowe w jego oryginalnej formie w celu wytworzenia użytecznej szczepionki podjednostkowej.
Próba szybkiego powstrzymania COVID-19
W latach 2008-2011 Keith Chappell i inni uczestniczyli w badaniach nad chorobą wywołaną wirusem syncytialnym układu oddechowego [RSV]. Badanie to wykazało, że u naturalnie zakażonych osób większość silnych przeciwciał neutralizujących to przeciwciała reagujące na formę białka przed fuzją, a nie na formę po fuzji. Było to impulsem do stworzenia infrastruktury molekularnej umożliwiającej utrzymanie białka kolcowego w jego formie przed fuzją.
Opracowany zacisk molekularny na Uniwersytecie Queensland składa się z fragmentów podjednostki fuzyjnej białka kolcowego wirusa HIV, gp41. Próbowano wykorzystać inne białka trimeryzujące, takie jak foldon z fibrytyny bakteriofaga T4, ale otrzymane struktury były niestabilne i nie nadawały się do przechowywania. Aby osiągnąć stabilność, konieczne były dalsze modyfikacje strukturalne, podczas gdy białka fuzyjne zaciśnięte przy użyciu fragmentów gp41 były stabilne same w sobie.
Sekwencje fragmentów gp41, które mają kształt spirali zwanych helisami alfa, łączą się z końcem każdej z trzech podjednostek fuzyjnych (S2) białka kolcowego. Helisy alfa spontanicznie składają się i oddziałują z helisami na innych monomerach. „W efekcie otrzymujemy bardzo stabilną, ciasno związaną sześcio-spiralną wiązkę składającą się z trzech zestawów dwóch helis alfa zawiniętych z powrotem na siebie”, wyjaśnia Chappell. Struktura wiązki stabilizuje białko kolcowe w jego konformacji przed fuzją.
Wcześniejsze prace zidentyfikowały trzy główne obszary trimerycznych białek kolcowych wielu wirusów otoczkowych, takich jak SARS-CoV-2, których modyfikacja mogłaby poprawić stabilizację i ekspresję. Wykorzystując sekwencję genetyczną wirusa, który produkuje białko kolcowe SARS-CoV-2, badacze zastosowali metodę prób i błędów, aby w krótkim czasie wygenerować ponad 200 wersji białka kolcowego. Były one monitorowane w celu zidentyfikowania tych najbardziej wydajnych w generowaniu stabilnego trimeru kolcowego i najbardziej wydajnie odnośnie ekspresji w komórkach. „Nie wymagało to żadnej wiedzy na temat struktury białka” – podkreśla Young – „co może znacznie przyspieszyć proces produkcji szczepionek dla nowo zidentyfikowanych wirusów”.
Grupa na Uniwersytecie Queensland wcześniej wygenerowała zaciśnięte fuzyjnie białka ponad 10 różnych wirusów wykorzystujących gp41, w tym Ebola, MERS, szeroki zakres szczepów grypy, herpes simplex (HSV) i wirusy Nipah. Ważnym dowodem na to, że mamy do czynienia z metodą wykazującą słuszność koncepcji (proof of principle) była szybka produkcja antygenów przeciwko dwóm, nieco egzotycznym, ale potencjalnie pojawiającym się patogenom wirusowym – paramyksowirusowi zidentyfikowanemu po raz pierwszy w Achimota w Ghanie oraz mammarenawirusowi zidentyfikowanemu po raz pierwszy w Wenzhou w Chinach.
„Zapytaliśmy, czy możemy pobrać sekwencję z tych dwóch wirusów, zastosować poznane zasady i bardzo szybko stworzyć kandydata na szczepionkę, nie wiedząc nic o strukturze białka” – wyjaśnia Chappell. „Zamiarem było zastosowanie tej technologii do walki z zagrożeniami związanymi z nowymi chorobami” – zauważa Young.
Fałszywe wyniki pozytywne wstrzymują planowane badania kliniczne
Wykrycie fałszywie pozytywnych wyników na obecność wirusa HIV u wszystkich uczestników badań, aczkolwiek na bardzo niskim poziomie i tylko w niektórych rodzajach testów, wstrzymało przejście do kolejnej fazy badań klinicznych. „Konstrukcja zacisku była taka, że główne miejsca wiązania przeciwciał z gp41 nie były obecne, więc przewidywaliśmy, że jeśli wystąpi reakcja przeciwciał na HIV, będzie ona bardzo niewielka” – mówi Young. Testy diagnostyczne na HIV wykrywają tylko ludzkie przeciwciała, więc dopiero w fazie 1 badania naukowcy mogli naprawdę sprawdzić wpływ interferencji diagnostycznych. Uczestnicy zostali poinformowani o takiej możliwości przed rozpoczęciem badania.
„Diagnostyczna reaktywność krzyżowa była bardzo słaba i chociaż nigdy nie było szans na zakażenie HIV, wprowadzenie szczepionki na szeroką skalę miałoby realny wpływ na sposób diagnozowania HIV” – mówi Young. Skojarzenie z HIV mogło mieć również wpływ na wyszczepialność szczepionką. Podczas gdy badanie kliniczne 1 fazy zostanie zakończone w tym roku, planowane badania fazy 2/3 zostały odłożone na później.
„Trzeba pamiętać, że byliśmy w trakcie projektu badawczego, a plan zakładał zbadanie szerokiej gamy konstruktów wykorzystujących zacisk molekularny, ale kiedy wybuchła pandemia, postanowiliśmy wykorzystać to, co mieliśmy w naszym zestawie narzędzi, czyli konstrukt gp41, o którym wiedzieliśmy, że działa dobrze w modelach zwierzęcych. Gdyby COVID-19 wybuchł w 2021 roku, a nie w 2020 r., mielibyśmy dodatkowy rok na wykonanie tej pracy” – mówi Young.
Obecne prace koncentrują się na poszukiwaniu podobnych konstruktów zaciskowych z innych wirusów i systemów, które mają taki sam poziom stabilności jak gp41, w celu ponownego zaprojektowania zacisku 2.0.
Profesor Paul Young mówi, że: „Nie używam słowa 'porażka’, to właśnie wnioski wyciągnięte z tych doświadczeń pomagają iść naprzód”.
Zobacz na: Czy HIV jest prawdopodobną przyczyną AIDS? Kary Mullis i inni
Czy szczepionki na COVID zwiększają podatność na wirusa HIV? [19 październik 2020]
Naukowcy ostrzegają, że niektóre szczepionki przeciwko Covid-19 mogą zwiększać ryzyko infekcji HIV
Szczepionka mRNA przeciw COVID-19 a neurodegeneracyjne choroby prionowe.
Potencjalne problemy autoimmunologiczne i neurodegeneracyjne szczepionek na Covid-19