Glin w szczepionkach – Tworzenie się ziarniniaków w wyniku podskórnego wstrzyknięcia owcom produktów zawierających glin jako adiuwant – doktorant Javier Asín i inni.
Źródło: Vet Pathol. 2018 Oct 31:300985818809142; Granulomas Following Subcutaneous Injection With Aluminum Adjuvant-Containing Products in Sheep.
https://www.ncbi.nlm.nih.gov/pubmed/30381018

Javier Asín
Streszczenie:
Szczepionki zawierające adiuwant w postaci glinu (Al) stosuje się na szeroką skalę u małych przeżuwaczy i innych zwierząt. Wiąże się je z pojawieniem się w miejscu wstrzyknięcia przemijających guzków odpowiadających ziarniniakom. Celem niniejszej analizy jest scharakteryzowanie morfologii tych ziarniniaków, zrozumienie roli glinu/aluminium jako adiuwantu w ich powstawaniu oraz ustalenie obecności tego metalu w regionalnych węzłach chłonnych. Wybrano 84 wykastrowane młode samce owiec i podzielono je na 3 badane grupy, po 28 zwierząt w każdej grupie:
(1) grupa do zaszczepienia (szczepionką zawierającą Al),
(2) grupa do podania wyłącznie adiuwantu i
(3) grupa kontrolna.
Wykonano łącznie 19 wstrzyknięć podskórnych w ciągu 15 miesięcy. Ziarniniaki i regionalne węzły chłonne zostały ocenione w badaniach kliniczno-patologicznych. Ziarniniaki w miejscu wstrzyknięcia pojawiły się u wszystkich zaszczepionych szczepionką jagniąt oraz u 92,3% jagniąt, które otrzymały jedynie adiuwant; ziarniniaki były bardziej liczne w grupie zaszczepionej. Kultury bakterii w ziarniniakach były zawsze negatywne. Histologicznie, ziarniniaki w grupie zaszczepionej charakteryzowały się większym stopniem nasilenia. Aluminium (Al) zostało konkretnie zidentyfikowane przy pomocy barwienia lumogalionem w ziarniniakach i węzłach chłonnych. Średnia zawartość glinu była znacząco wyższa (P < .001) w węzłach chłonnych w grupie zaszczepionej (82,65 μg/g) w porównaniu zarówno z grupą, która otrzymała wyłącznie adiuwant (2,53 μg/g), jak i grupą kontrolną (0,96 μg/g). Skaningowy transmisyjny mikroskop elektronowy wykazał obecność zgrupowań glinu w makrofagach w grupie zaszczepionej i w grupie, która otrzymała jedynie adiuwant. W tych dwóch grupach, adiuwanty w postaci glinu wywoływały przewlekłe, jałowe, podskórne ziarniniaki z powodowanym przez makrofagi przemieszczeniem się glinu do regionalnych węzłów chłonnych. Lokalne przemieszczenie się glinu może wywołać dalsze nagromadzanie się tego metalu w odległych tkankach i mieć związek z wystąpieniem objawów ogólnoustrojowych.
Glin w szczepionkach
Hodowla owiec w Hiszpanii bardzo często uwzględnia szczepienia zapobiegające rozmaitym chorobom25 szczepionkami zawierającymi glin (Al) jako adiuwant. Zwierzęta są szczepione przez całe życie i często pojedyncza owca może otrzymać 2 do 4 szczepionek w ciągu roku lub więcej w zależności od konkretnych problemów zdrowotnych danego stada bądź wdrożenia obowiązkowych kampanii szczepień przeciwko pojawiającym się infekcjom7.
Wielokrotne wstrzyknięcia szczepionek zawierających glin (Al) owcom wiążą się z ogólnoustrojowym, niezgłaszanym wcześniej zespołem, tzw. owczym autoimmunizacyjnym/autozapalnym zespołem indukowanym przez adiuwanty (owczym zespołem ASIA). Obserwowano go na szeroką skalę w następstwie kampanii szczepień przeciwko chorobie niebieskiego języka pod koniec minionej dekady, która to kampania wywarła bardzo szkodliwy wpływ na lokalną hodowlę owiec.12,27,36 Do dzisiaj owczy zespół ASIA nadal obserwuje się w terenie, przy czym istnieje pilna potrzeba zrozumienia wywołujących go patogenów, aby móc kontrolować jego skutki.
Sole aluminium są skutecznymi adiuwantami, które sprzyjają silnej odpowiedzi immunologicznej przeciwko antygenom w szczepionkach i uważa się je za bezpieczne.1,26 Niektóre badania wskazują, że składniki te aktywują ścieżkę inflamasomu, indukują odpowiedź immunologiczną limfocytów Th2 oraz wspierają konkretną odporność humoralną.1,9 W medycynie weterynaryjnej, ziarniniaki związane z adiuwantami w postaci glinu uznawane są za możliwy do przyjęcia efekt uboczny,37 mimo że stosowanie glinu jako adiuwantu może się wiązać z szerokim spektrum reakcji w miejscu wstrzyknięcia, łącznie z przewlekłym, ciężkim stanem zapalnym prowadzącym do mięsaków u kotów.3,16,17 Uznaje się, że owce są podatne na rozwój ziarniniaków związanych ze szczepionkami,37,40 zaś przedkliniczne badania nad bezpieczeństwem produkcji szczepionek dla owiec uwzględniają zwykle okresową ocenę in vivo reakcji w miejscu wstrzyknięcia w okresie kilku miesięcy.2,33
Nie zgłoszono żadnych histologicznych opisów ostrej lub podostrej reakcji zapalnej na szczepionki.15 Co więcej, nigdy nie dokonano pełnej, patologicznej charakterystyki ziarniniaków u owiec indukowanych przez szczepionki, w tym umiejscowienia glinu (Al) w ziarniniakach i węzłach chłonnych. Celem niniejszego omówienia jest scharakteryzowanie ziarniniaków indukowanych przez szczepionki zawierające aluminium/glin jako adiuwant oraz ustalenie czy glin (Al) jest transportowany z miejsca wstrzyknięcia do regionalnych węzłów chłonnych.
Materiały i metody
Układ badania
Komisja ds. Etyki Uniwersytetu w Saragossie zatwierdziła i wydała zezwolenie na wszystkie procedury eksperymentalne (ref. PI15/14). Wymogi hiszpańskiej polityki ochrony zwierząt (RED53/2013) i Europejskiej Dyrektywy Unijnej 2010/63 w zakresie ochrony zwierząt eksperymentalnych były zawsze przestrzegane.
Badanie opierało się na 4 stadach 21 trzymiesięcznych, wykastrowanych samców owiec (N = 84). Stado 1 zostało utworzone na farmie doświadczalnej Uniwersytetu w Saragossie i znalazły się w nim rasowe jagnięta Rasa Aragonesa wybrane z rodowodowego stada o poświadczonym dobrym stanie zdrowia. Stado to przebywało zawsze w pomieszczeniu i zapewniono mu optymalne warunki, w których przebywało oraz właściwy nadzór i dietę. Zwierzęta, które weszły w skład stad od 2 do 4 zostały wybrane z 3 stad przeznaczonych do celów handlowych, reprezentujących różne warunki nadzoru i regiony geograficzne (Aneks Tabela S1). Stada od 2 do 4 pozostały w pierwotnym stadzie przeznaczonym do celów handlowych przez cały czas trwania eksperymentu. Każde stado składające się z 21 owiec zostało podzielone na 3 grupy badawcze (szczepionka, jedynie adiuwant i grupa kontrolna; n = po 7 każda). Dla celów niniejszego studium, w tych 3 grupach znajdowały się zwierzęta, wobec których stosowano te same metody badawcze (n = po 28 każda). Dwa zwierzęta z każdej badanej grupy zdechły z niepowiązanych przyczyn w czasie trwania eksperymentu; z tego powodu na koniec eksperymentu każda grupa składała się z 26 zwierząt. Kompletne badanie trwało 15 miesięcy, od lutego 2015 roku do kwietnia 2016 roku.
Owce zostały poddane przyspieszonym szczepieniom ze schematu szczepień, otrzymując, w możliwych do przyjęcia, eksperymentalnych ramach czasowych, bardzo znaczną ilość glinu odpowiadającą 6-7 latom w terenie.25,27 Zwierzęta w każdej badanej grupie otrzymały w sumie 19 wstrzyknięć podskórnych w 16 terminach iniekcji, jako że podczas 3 dni wymagało to podwójnego wstrzyknięcia (Ryc. 1). Okresy między iniekcjami wahały się od 18 do 78 dni (średnia = 30,2 ± 16,0 dni). Wszystkie szczepionki zostały wstrzyknięte w tkankę podskórną obszaru obejmującego łopatkę i żebra. Szesnaście szczepionek wstrzyknięto w prawy bok, zaś 3 odnoszące się do terminów podwójnej iniekcji w lewy. Dla celów niniejszego opracowania uwzględniono wyłącznie 16 wstrzyknięć w prawy bok.
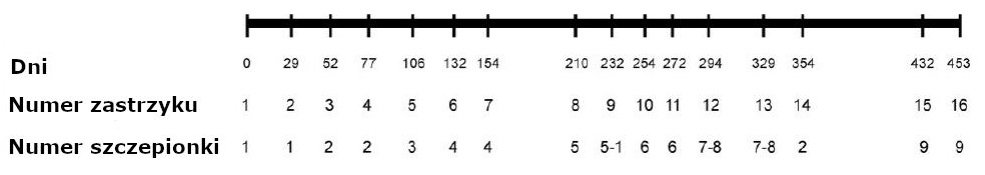
Rycina 1. Schemat szczepień dla omawianego eksperymentu. Podano liczbę dni po pierwszym wstrzyknięciu. Numer iniekcji to kolejny numer porządkowy danej iniekcji. Numer szczepionki odnosi się do szczepionek opisanych w Aneksie Tabela S2.
Grupie do zaszczepienia wstrzyknięto dostępne na rynku szczepionki przeciwko najważniejszym chorobom owiec (Aneks Tabela S2). Zalecany okres między szczepieniami i procedura aplikacji każdego produktu były zawsze przestrzegane. Grupie do podania wyłącznie adiuwantu wstrzyknięto Alhydrogel ®(CZ Veterinaria, Pontevedra, Hiszpania), adiuwant na bazie glinu stosowany w preparatach szczepionkowych.
Obliczono, że stężenie glinu w każdym inokulum było identyczne jak w odpowiadającej szczepionce poprzez rozcieńczenie roztworu chlorku sodu buforowanego fosforanami (PBS). Do określenia zawartości glinu w adiuwancie i każdej szczepionce zastosowano atomową spektrometrię emisyjną plamy sprzężonej emisyjnie (Aneks Tabela S2). Grupa do zaszczepienia i grupa do podania wyłącznie adiuwantu otrzymały łącznie 81,29 mg glinu na zwierzę. Grupie kontrolnej wstrzykiwano tą samą objętość jedynie roztworu chlorku sodu buforowanego fosforanami (PBS). Ostatnią iniekcję wszystkie zwierzęta otrzymały 5 dni przed eutanazją.
Badania in vivo
W każdym terminie iniekcji, ta sama osoba oceniająca (J.A.) przez badanie palpacyjne określała ostrość reakcji na wstrzyknięcia. Ustalono skalę poziomów ostrości (0-3):
0, brak reakcji,
1, reakcja w postaci powstania 1 guzka mniejszego niż 0,5 cm;
2, reakcja w postaci powstania 1 guzka większego niż 0,5 cm;
3, 1 guzek o centralnym skraplaniu się i/lub przetorowaniu lub więcej niż jedna wyczuwalna reakcja w postaci guzka.
Ocenę tę prowadzono aż do i łącznie z 14. iniekcją (Ryc. 1).
Charakterystyka patologiczna
Przeprowadzono kompletną sekcję zwłok, łącznie z metodycznym pobraniem próbek wszystkich tkanek, jednak dla celów niniejszej analizy opisane zostały jedynie cechy odnotowane w prawym boku lub w prawym podłopatkowym węźle chłonnym. Ta procedura pobrania próbek zapewniła tkanki wymagane do badania (patrz niżej), gdyż liczba iniekcji w prawy bok była wyższa, jak też pomogła zebrać te próbki w minimalnych ramach czasowych. Tkanka podskórna została obnażona, zaś podskórna podściółka tłuszczowa poddana sekcji. Wszystkie najbardziej widoczne guzki poszczepienne zostały wydobyte, a ich liczba zarejestrowana. Odnotowano także obecność martwicy centralnej w guzkach. W zależności od liczby guzków znalezionych u każdego zwierzęcia, utworzono cztery kategorie: 0, 1-2, 3-7, 8 lub więcej guzków.
Dla celów histopatologicznych pod uwagę wzięto jedynie przewlekłe, dobrze rozwinięte guzki, unikając ostrych reakcji tkanek odpowiadających iniekcjom wykonanym 5 dni przed eutanazją. Guzki zostały oznaczone i zatopione w parafinie, ale tylko 1 na zwierzę został losowo wybrany do szczegółowych badań histopatologicznych. Procedurę tę oparto na bardzo jednorodnych cechach histopatologicznych guzków (patrz część Wyniki). Próbki zostały również pobrane z okolicznego węzła chłonnego (prawego podłopatkowego). W sumie przebadano 47 guzków z miejsca wstrzyknięcia (24 ze zwierząt, które zostały zaszczepione i 23 z tych, które otrzymały jedynie adiuwant), 26 obszarów wstrzyknięcia w grupie kontrolnej oraz 76 węzłów chłonnych (26 ze zwierząt, które zostały zaszczepione, 24 z tych, które otrzymały jedynie adiuwant i 26 w grupie kontrolnej). Tkanki zostały rutynowo przetworzone i wybarwione hematoksyliną i eozyną. Szczegółowy opis guzków powstałych w miejscu wstrzyknięcia i podłopatkowych węzłów chłonnych według półilościowego systemu punktacji histopatologicznej znajduje się w Tabelach S3 i S4 w Aneksie. Dwaj autorzy (J.A. i L.L) ocenili mikroskopowo, ślepe i oznaczone próbki tych parametrów, osiągając końcowy konsensus.
Mikrobiologia
Łącznie za pomocą metod mikrobiologicznych zbadano 40 zwierząt (stada 1 i 4): dwadzieścia sześć guzków z miejsc wstrzyknięcia (13 ze zwierząt w grupie zaszczepionej i 13 z tych, które otrzymały jedynie adiuwant) wraz z 14 obszarami wstrzyknięcia ze zwierząt w grupie kontrolnej zostało przekazanych do rutynowych badań mikrobiologicznych. Każdą próbkę poddano bezpośredniemu barwieniu metodą Grama w rozmazach oraz inkubacji posiewów mikrobiologicznych w warunkach aerobowych (agar z krwią, MacConkey agar; Oxoid, Basingstoke, Hampshire, UK; do 48 godzin w temperaturze 37°C) i w warunkach anaerobowych (agar z krwią, do 5 dni w temperaturze 37°C). Podstawową fenotypową identyfikację bakterii przeprowadzono na postawie morfologii kolonii i komórek (barwienie metodą Grama) i za pomocą standardowych testów biochemicznych.
Glin w badaniach in situ
Zarówno ziarniniaki, jak i węzły chłonne zostały przebadane na obecność Al za pomocą mikroskopu fluorescencyjnego wraz z barwieniem lumogalionem, a także z wykorzystaniem mikroskopu elektronowego. Mikroskopem fluorescencyjnym zbadano 4 losowo wybrane guzki z miejsca wstrzyknięcia ze zwierząt w stadzie 1 (2 z grupy zaszczepionej i 2 z grupy, która otrzymała jedynie adiuwant) oraz dwa obszary wstrzyknięcia u owiec z grupy kontrolnej. Badaniu poddano także próbki z analogicznych węzłów chłonnych podłopatkowych sześciu wyżej wspomnianych zwierząt. Zastosowano się do protokołu identyfikacji glinu (Al) we fragmentach tkanek za pomocą barwienia lumogalionem.30,31 Pokrótce, fragmenty tkanek grubości 5 –μm zostały poddane odparafinowaniu, nawodnione i zainkubowane roztworem milimolowym lumogalionu (Tokyo Chemical Industry, UK) sporządzonym w roztworze PIPES o stężeniu 50 mM. Seryjne przekroje kontrolne zanurzono jedynie w roztworze PIPES. Preparaty zostały przemyte roztworem PIPES, przepłukane w ultraczystej wodzie i osadzone w wodnym medium. Badanie z zastosowaniem lumogalionu i analiza autofluorescencji przekrojów kontrolnych zostały przeprowadzone za pomocą filtru pasmowoprzepustowego światła wzbudzającego 470-495 nm.
Osiem losowo wybranych guzków z miejsca wstrzyknięcia w stadzie 1 (4 ze zwierząt zaszczepionych i 4 ze zwierząt, które otrzymały jedynie adiuwant, łącznie ze zbadanymi za pomocą mikroskopu fluorescencyjnego) poddano badaniu z użyciem skaningowego transmisyjnego mikroskopu elektronowego (STEM) oraz spektroskopii rentgenowskiej z dyspersją energii (EDS). Pokrótce, wybrane tkanki zostały utrwalone w roztworze 2,5% aldehydu glutarowego plus w 2% roztworze paraformaldehydu (0,1 M PBS), przepłukane w PBS, utrwalone następczo w 2% roztworze osmu, odwodnione w acetonie o stopniowo zwiększanym stężeniu i osadzone w araldycie. Wybrane ultracienkie fragmenty zabarwiono kontrastowo roztworem 1% octanu uranylu i cytrynianu ołowiu wg Reynoldsa. Do uzyskania obrazów STEM wykorzystano mikroskop Tecnai F30 (FEI Company, Hillsboro, OR, USA) wyposażony w detektor EDS. Zawartość glinu (Al) z wykorzystaniem detektora EDS określano zawsze w skupiskach wewnątrzcytoplazmowych, podczas gdy te same określenia w jądrach komórkowych wykorzystywane były jako wewnętrzna kontrola ujemna. Wymiary cząsteczek aluminium i skupisk Al mierzono za pomocą obrazów STEM: długość cząsteczek aluminium ustalano na 4 obrazach STEM o powiększeniu 68.000x na jedno zwierzę mierząc 10 cząsteczek na obraz (40 cząsteczek na zwierzę), zaś obszar skupisk glinu (Al) ustalano na 4 obrazach STEM o powiększeniu 8500x na jedno zwierzę mierząc 5 odpowiednio wyznaczonych skupisk na obraz (20 skupisk na zwierzę). Zwarte eozynofilne krystaloidy o znacznej wielkości (składające się z glinu (Al), patrz opis poniżej; Tabela S3 w Aneksie) nie zostały uwzględnione w wyliczeniu obszaru zajętego przez skupiska Al.
Zawartość glinu w węzłach chłonnych
Dwanaście węzłów chłonnych (4 z każdej grupy, łącznie ze zwierzętami zbadanymi za pomocą mikroskopu fluorescencyjnego oraz technik STEM i EDS) poddano roztwarzaniu mikrofalowemu, a następnie atomowej spektrometrii absorpcyjnej z atomizacją w piecu grafitowym (TH GFAAS).19 Pokrótce, 3 replikowane fragmenty o wadze od 0,3 do 0,5 g z każdego węzła chłonnego zostały osuszone w inkubatorze w temperaturze 37°C aż do osiągnięcia stałej wagi. Następnie poddano je roztwarzaniu mikrofalowemu (za pomocą mineralizatora mikrofalowego MARS Xpress firmy CEM Microwave Technology Ltd.) w mieszaninie 1mL 15,8 M HNO3 i 1 mL 30% w/v H2O2. Po ochłodzeniu każdy fragment poddany roztwarzaniu mikrofalowemu został rozcieńczony do 5 mL ultraczystą wodą i dokonano pomiaru całkowitej zawartości Al z zastosowaniem atomowej spektrometrii absorpcyjnej w poprzecznie grzanym piecu grafitowym, podłużnego korektora tła wykorzystującego efekt Zeemana oraz autosamplera AS-800 z oprogramowaniem WinLab32 (PerkinElmer, Buckinghamshire UK). Do ustaleń użyto powierzchni piku sygnału absorpcji atomowej skorygowanej przez korektor tła Zeemana. Wyniki zostały wyrażone w postaci mikrogramów Al na gram suchej masy tkanki. Każde ustalenie stanowiło średnią arytmetyczną 3 wstrzyknięć, przy względnym odchyleniu standardowym wynoszącym 10%.
Analiza statystyczna
Zmienne jakościowe, jako badane grupy i właściwości histopatologiczne, zostały opisane z użyciem częstości względnych i bezwzględnych. Ocenę związku między 2 zmiennymi jakościowymi przeprowadzono za pomocą testu zgodności chi-kwadrat Pearsona (lub, alternatywnie, wskaźnika prawdopodobieństwa dla tabel n x m bądź testu dokładnego Fishera dla tabel 2 x 2).5
Test Shapiro Wilka został wykorzystany do sprawdzenia czy dane dotyczące zmiennych ilościowych (ostrość reakcji in vivo, długość/skupiska cząsteczek Al i zawartość Al) stosowały się do standardowego rozkładu. Jako że żadna z nich nie była normalna, opisano je za pomocą mediany i rozstępu międzykwartylowego (IQR), jak też przedstawiono graficznie na wykresach pudełkowych. Związek między niestandardową zmienną ilościową a zmienną jakościową z 2 kategoriami został poddany ocenie przy użyciu testu Manna-Whitneya-Wilcoxona (tj. porównanie ostrości reakcji in vivo, długości cząsteczek glinu (Al) i obszaru skupisk Al między grupą zaszczepioną a tą, która otrzymała jedynie adiuwant). Związek między niestandardową zmienną ilościową a zmienną jakościową z 3 lub więcej kategoriami oceniono z wykorzystaniem testu Kruskalla-Wallisa, a następnie testu post hoc Dunna (tj. porównanie zawartości glinu (Al) w regionalnych węzłach chłonnych w tych 3 grupach).5
Do analizy danych użyto programu IBM SPSS 19.0 for Windows (IBM Corp, Armonk, NY, USA). Wartość P <.05 została uznana za istotną statystycznie.
Wyniki
Badania in vivo
Ocena in vivo reakcji miejscowych została przedstawiona na Ryc. S1 w Aneksie. Palpacji poddano wyłącznie guzki z miejsca wstrzyknięcia pochodzące z grupy zaszczepionej i grupy, która otrzymała jedynie adiuwant. Reakcje miejscowe w grupie zaszczepionej wykazały znacząco wyższy (P <.001) poziom ostrości (mediana skumulowana = 0,79, IQR = 0,59-1,04) w porównaniu ze zwierzętami, które otrzymały jedynie adiuwant (mediana skumulowana = 0,36, IQR = 0,21-0,50). Piki ostrości zaobserwowano w obu grupach równocześnie i połączono z wysoką dawką Al w iniekcji poprzedzającej eutanazję. Zasadniczo palpacji poddano tylko 1 guzek na zwierzę, przy czym większość guzków skroplonych i tworzących przetoki zaobserwowano w grupie zaszczepionej (brak danych).
Badania ogólne i histopatologiczne
Oględziny tkanki podskórnej po usunięciu podściółki tłuszczowej wykazały obecność guzków, jednak wyłącznie w grupie zaszczepionej i w grupie, która otrzymała jedynie adiuwant (Ryc. 2). Guzki wystąpiły u wszystkich (26/26; 100%) owiec w grupie zaszczepionej i u większości (24/26, 92,3%) zwierząt, które otrzymały jedynie adiuwant, przy czym nie utworzyły się (0/26;0%) w grupie kontrolnej (Tabela 1).
U ponad połowy owiec, które otrzymały jedynie adiuwant powstały w sumie 1 lub 2 guzki, podczas gdy u więcej niż 75% zaszczepionych zwierząt wystąpiło 8 lub więcej guzków; minimalna liczba guzków wypreparowanych z zaszczepionych zwierząt wyniosła 3 (Tabela 1). Zadziwiające, że u 7 zaszczepionych owiec (7/26, 26,9%) pojawiło się od 13 do 16 guzków w prawym boku (Ryc. 3). Guzki indukowane przez szczepionki były okrągłe i wyraźne (Ryc. 4), podczas gdy guzki indukowane jedynie przez adiuwant przypominały raczej płytkę lub przynajmniej nie były aż tak okrągłe (Ryc. 5). W obu grupach wymiary guzków mieściły się w granicach 0,5-2 cm. Jednak, zwłaszcza w grupie, która otrzymała jedynie adiuwant, zlokalizowanie niektórych guzków sprawiało trudność ze względu na ich niewielkie rozmiary (niekiedy mniejsze niż 2 mm). Centralną martwicę serowatą guzków zaobserwowano w znacznym natężeniu odpowiednio u 84,6% zaszczepionych owiec i u 13,6% tych, które otrzymały jedynie adiuwant (Ryc. 6, 7).
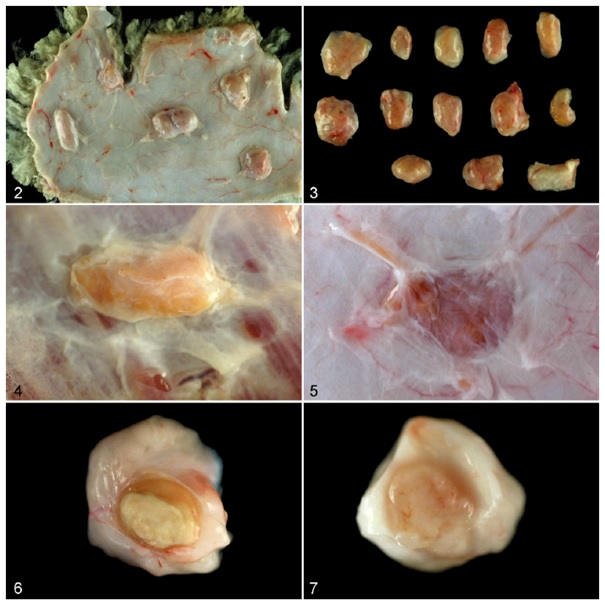
Ryciny 2-7. Ziarniniaki w miejscu wstrzyknięcia, tkanka podskórna w prawym boku (tkanka tłuszczowa została usunięta), owcom wstrzyknięto podskórnie szczepionkę lub jedynie adiuwant. Rycina 2. Grupa zaszczepiona. Zaobserwowane liczne, wyraźne ziarniniaki. Rycina 3. Grupa zaszczepiona. Trzynaście podskórnych ziarniniaków wyizolowanych z jednego zwierzęcia. Guzki użyte do badań mikrobiologicznych i za pomocą mikroskopu elektronowego nieobecne. Rycina 4. Grupa zaszczepiona. Wyraźny, okrągły ziarniniak znacznej wielkości. Rycina 5. Grupa, która otrzymała jedynie adiuwant. Niewyraźny, płaski i niewielki ziarniniak. Ryciny 6-7. Wycięte fragmenty ziarniniaka. Rycina 6. Grupa zaszczepiona. Rozległa centralna jałowa martwica serowata. Rycina 7. Grupa, która otrzymała jedynie adiuwant. Wygląd niezróżnicowany i stały, bez wyraźnych oznak martwicy.
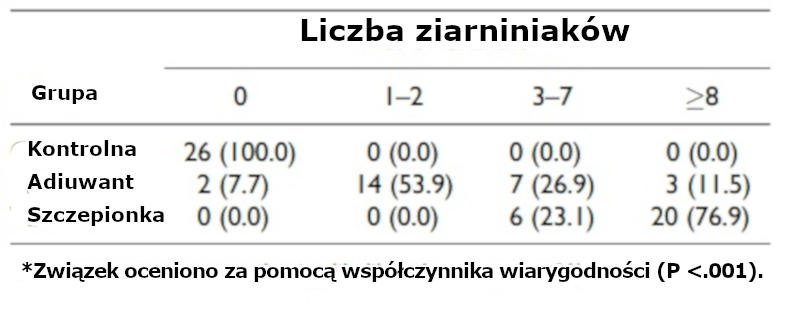
Tabela 1. Liczba (%) ziarniniaków pobranych postmortem z owiec, którym wstrzyknięto sód buforowany fosforanami (grupa kontrolna), jedynie adiuwant lub szczepionkę (n = 26 zwierząt na grupę).*
Podstawowe właściwości histologiczne guzków z miejsca wstrzyknięcia i regionalnych węzłów chłonnych były podobne w i pomiędzy 2 potraktowanych grupach, a różniły się wyłącznie pod względem intensywności (Tabela 2), podczas gdy u żadnego zwierzęcia w grupie kontrolnej nie wystąpiła reakcja w miejscu wstrzyknięcia. W tych dwóch potraktowanych grupach, guzki składały się z dokładnie odgraniczonych ziarniniaków w większości zbudowanych z obszernych, aktywowanych makrofagów, uwidaczniając cytoplazmę od zwakualizowanej do cytoplazmy o grubszej granulacji (Ryciny 8, 9). Wielojądrowe komórki olbrzymie, bądź to Langhansa bądź typu ciał obcych, obserwowano znacząco częściej w ziarniniakach pochodzących ze zwierząt zaszczepionych (P = .010; Ryc. 8, ramka). Skupiska limfocytów zaobserwowano na obrzeżu ziarniniaków u połowy zwierząt w obu grupach. Znacząco wyższe poziomy martwicy centralnej (P= .021; Ryc. 8) i mineralizacji (P = .001) zaobserwowano w ziarniniakach owiec zaszczepionych, wraz z istotną obecnością neutrofili (P = .009).
W obu grupach zaobserwowano rozproszone wewnątrz ziarniniaków wyraźne, eozynofilne krystaloidy o grubości około 100-200 μm, o prostych brzegach, wewnątrzkomórkowe i zewnątrzkomórkowe, od okrągłych do wydłużonych (w kształcie papierosa). Ciała te były nadmiernie reprezentowane w ziarniniakach z grupy, która otrzymała jedynie adiuwant (P < .001; Ryc. 9). Podłopatkowe węzły chłonne owiec zaszczepionych i tych, które otrzymały jedynie adiuwant wykazały znaczny przerost warstwy korowej węzłów chłonnych (P < .001) oraz znaczącą obecność skupisk obszernych makrofagów o konsystencji od pienistej do granulowanej (P < .001; Ryc. 10).
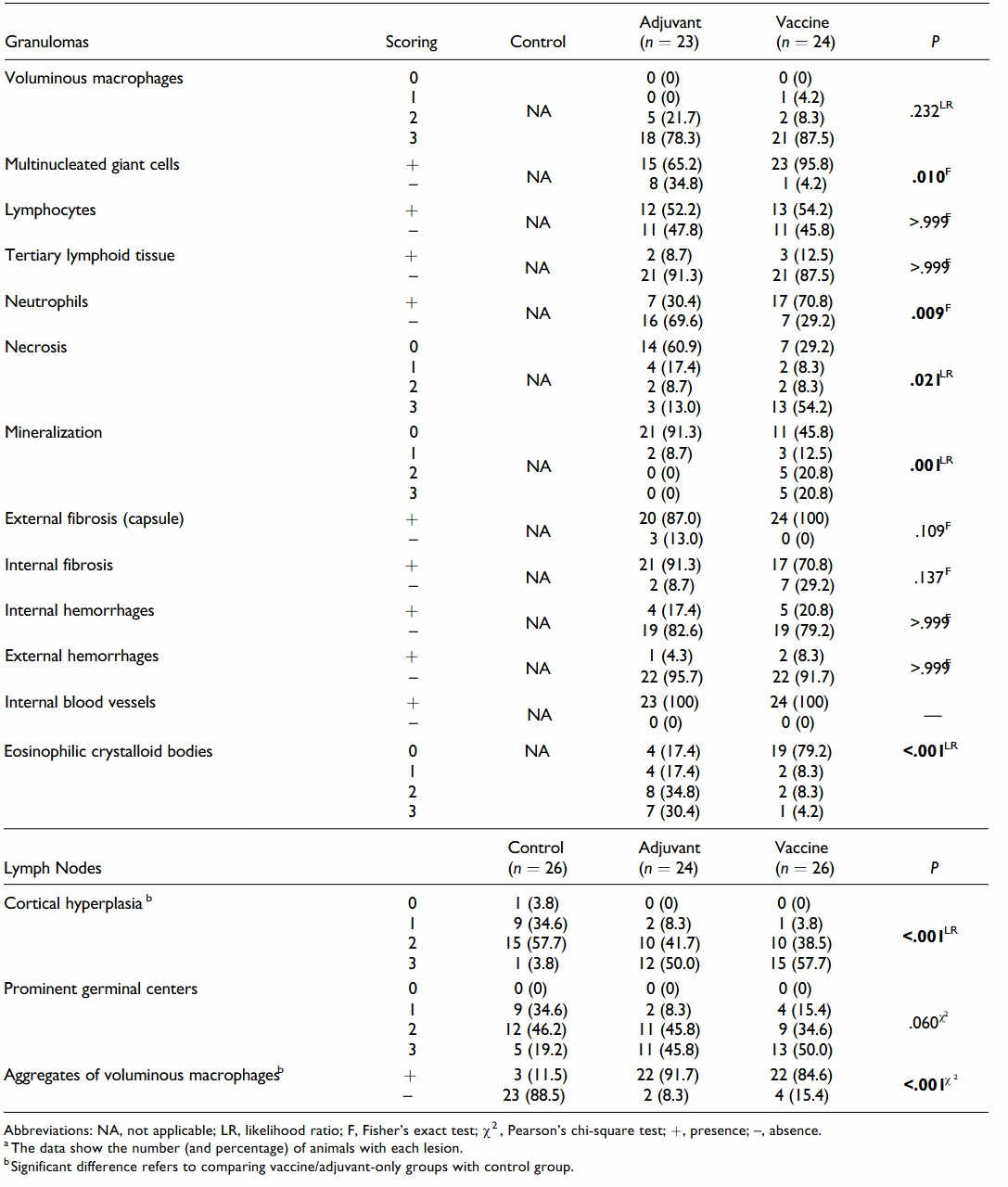
Tabela 2. Zmiany histologiczne w ziarniniakach podskórnych i węzłach chłonnych owiec, którym wstrzyknięto podskórnie sód buforowany fosforanami (grupa kontrolna), jedynie adiuwant lub szczepionkę.a
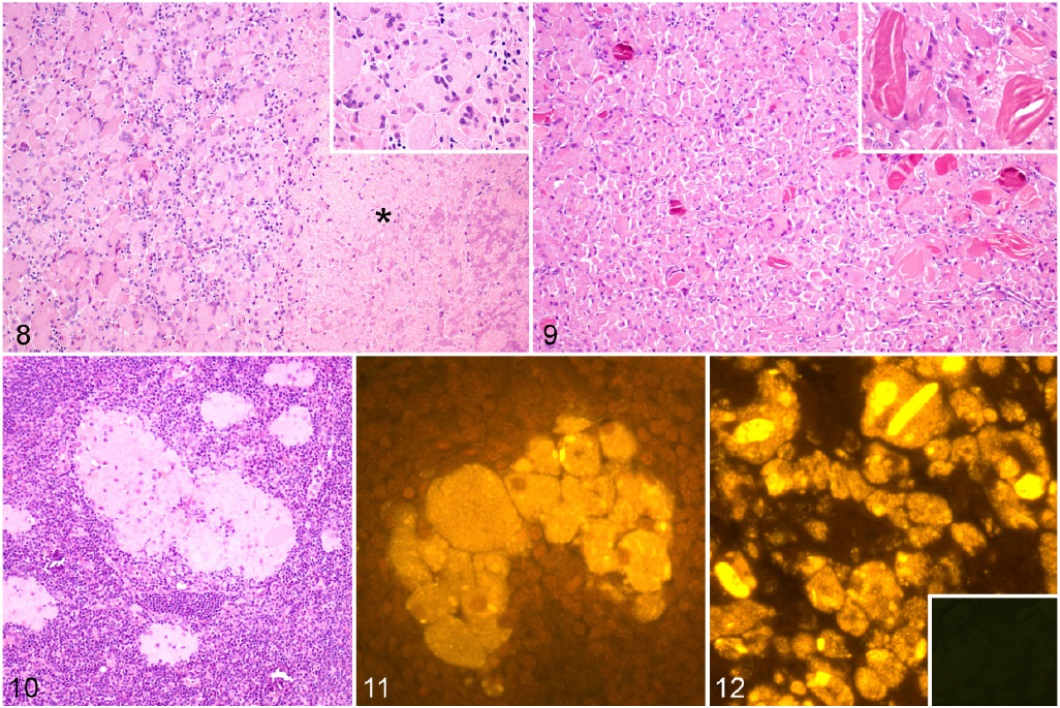
Ryciny 8-9. Ziarniniaki w miejscu wstrzyknięcia. Owce, którym wstrzyknięto podskórnie szczepionkę lub jedynie adiuwant. Rycina 8. Grupa zaszczepiona. Zwarte skupiska makrofagów przypominających nabłonek i wielojądrowych komórek olbrzymich oraz regionalnie rozległy obszar martwicy (gwiazdka/asterysk). Ramka: wielojądrowe komórki olbrzymie zawierające pienistą cytoplazmę. Hematoksylina i eozyna (HE). Rycina 9. Grupa, która otrzymała jedynie adiuwant. Skupiska przypominających nabłonek makrofagów wraz z niewielką liczbą wielojądrowych komórek olbrzymich splątane z wewnątrz- i zewnątrzkomórkowymi eozynofilnymi krystaloidami. Ramka: Kilka eozynofilnych krystaloidów blisko związanych z wielojądrowymi komórkami olbrzymimi. HE. Ryciny 10-11. Prawe podłopatkowe węzły chłonne. Rycina 10. Grupa, która otrzymała jedynie adiuwant. Łączące się skupiska makrofagów. HE. Rycina 11. Grupa zaszczepiona. Skupiska makrofagów wykazujące fluorescencję wskazującą na obecność glinu (Al). Lumogalion. Rycina 12. Ziarniniak w miejscu wstrzyknięcia; grupa, która otrzymała jedynie adiuwant. Makrofagi wykazujące pomarańczową fluorescencję wewnątrzcytoplazmatyczną o strukturze ziarnistej wskazującą na obecność Al. Eozynofilne krystaloidy wykazujące silną fluorescencję dodatnią. Lumogalion. Ramka: Brak autofluorescencji w niezabarwionym kolejnym przekroju.
Stosując barwienie za pomocą lumogalionu zaobserwowano ziarnistą, intensywną, pomarańczową fluorescencję wewnątrzcytoplazmatyczną w makrofagach z ziarniniaków i węzłów chłonnych zarówno w grupie zaszczepionej, jak i w grupie, która otrzymała jedynie adiuwant (Ryc. 11). Zadziwiające, że eozynofilne krystaloidy zaobserwowane dzięki zastosowaniu hematoksyliny i eozyny wykazały najintensywniejszą pomarańczową fluorescencję (Ryc. 12). Fluorescencji o podobnych cechach nie stwierdzono w tkankach owiec w grupie kontrolnej.
Badania za pomocą mikroskopu elektronowego
Makrofagi w ziarniniakach zawierały materiał o dużej gęstości elektronowej w kształcie igły (Ryc. 13), który tworzył liczne skupiska wewnątrzcytoplazmatyczne, często otoczone błoną subkomórkową (lizosom fagocytujący; (Ryciny 14, 15). Błona ta wykazywała nieregularne obszary braku ciągłości i zaniku, prowadzące do pojawienia się wolnego wewnątrzcytoplazmatycznego materiału spikularnego. Eozynofilne, barwiące się w barwieniu lumogalionem krystaloidy uwidaczniały zwarte i jednolite skupisko tego samego materiału spikularnego (Ryc. 16). Niezależnie od wyglądu i umiejscowienia, materiał ten w kształcie igieł został zidentyfikowany jako aluminium (Al) przez EDS, zaś innymi często wykrywanymi pierwiastkami były węgiel, tlen, ołów, miedź i osm (Ryc. 17).
Pomiary na obecność gliu (Al) przy użyciu techniki EDS wykonywane w jądrach komórkowych były zawsze negatywne. Cząsteczki glinu Al w ziarniniakach były znacząco dłuższe (P < .001) w grupie zaszczepionej (mediana = 121,24 nm, IQR = 98,30-170,60) niż cząsteczki w grupie, która otrzymała jedynie adiuwant (mediana = 69,47 nm, IQR = 53,53-87,62; Ryc. 18). Obszar skupisk był podobny w obu grupach (szczepionka: mediana = 1,71 μm2, IQR = 0,84–3,10; jedynie adiuwant: mediana = 1,80 μm2, IQR = 1,19–2,80; Ryc. 19). I w końcu, makrofagi w obu grupach wykazywały 1 lub więcej następujących zmian zwyrodnieniowych: opuchnięte, szorstkie retikulum endoplazmatyczne z dobrze widocznymi rybosomami, opuchnięte mitochondria z chaotycznymi grzebieniami, wewnątrzcytoplazmatyczne figury mielinowe, błona jądrowa z pęcherzykami, jak również heterochromatyna z wgłębieniami i marginacją.
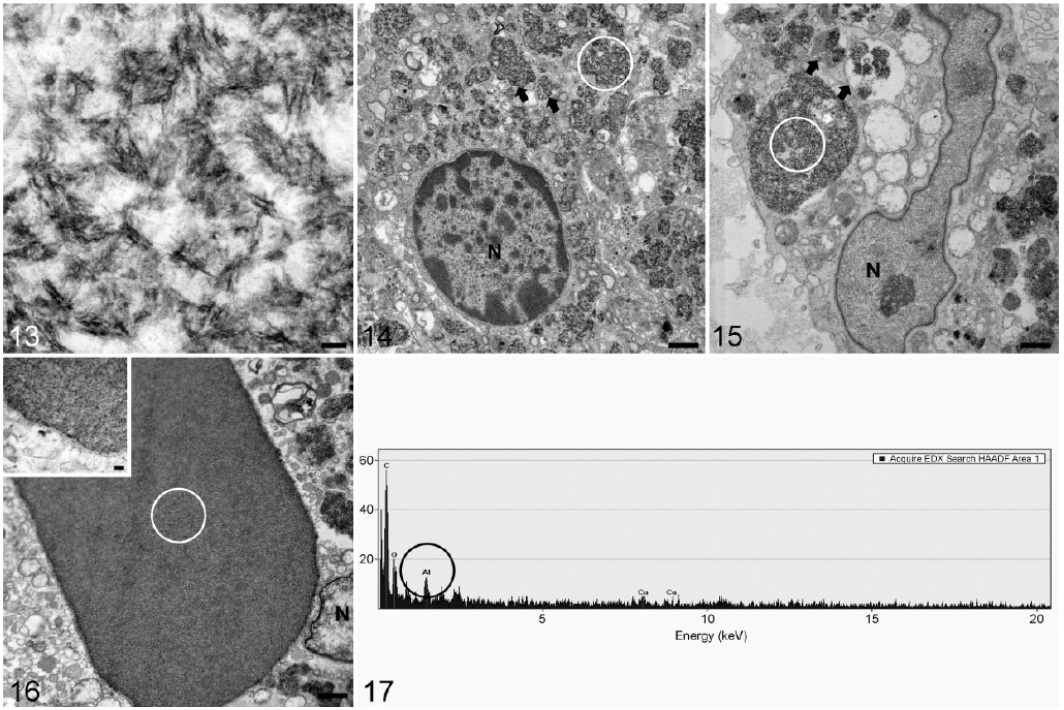
Ryciny 13-17. Ziarniniaki w miejscu wstrzyknięcia, owce, którym wstrzyknięto szczepionkę lub adiuwant. Skaningowy transmisyjny mikroskop elektronowy i spektroskopia rentgenowska z dyspersją energii (EDS). Białe kółka na mikrografiach elektronowych uwidaczniają obszary pomiarów metodą EDS. Rycina 13. Grupa zaszczepiona. Długie i dobrze widoczne spikularne cząsteczki o dużej gęstości elektronowej zidentyfikowane jako glin (Al). Kreska = 100 nm. Rycina 14. Grupa zaszczepiona. Makrofagi zawierające pęcherzyki cytoplazmatyczne (strzałki), składające się z materiału spikularnego o dużej gęstości elektronowej zidentyfikowanego jako glin (Al). Kondensacja jądra komórkowego i lokalizacja peryferyjna heterochromatyny. N: jądro. Kreska = 1 μm. Rycina 15. Grupa, która otrzymała jedynie adiuwant. Skupiska glinu (Al) umiejscowione w fagolizosomach różnej wielkości (strzałki) i jądro wydłużone. N: jądro. Kreska = 1 μm. Rycina 16. Grupa, która otrzymała jedynie adiuwant. Znacznej wielkości skupisko gęsto upakowanego materiału o prostych granicach, które odpowiada eozynofilnym krystaloidom obserwowanym przy użyciu hematoksyliny i eozyny. W skupiskach tych widoczne granice o dużej gęstości elektronowej. N: jądro. Kreska = 1 μm. Ramka: Powiększenie granicy skupiska. Kreska = 200 nm. Rycina 17. Reprezentatywny wykres EDS. Materiał spikularny o dużej gęstości elektronowej i krystaloidy (przedstawione w białych kółkach na Rycinach 14, 15 i 16) były każdorazowo identyfikowane jako glin (Al) (wartość maksymalna oznaczona czarnym kółkiem).
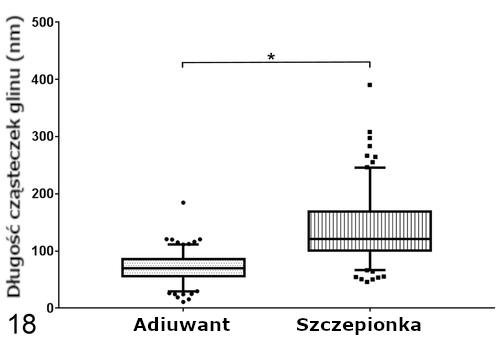
Rycina 18. Długość cząsteczek glinu (Al) w makrofagach ziarniniaka. Ramki reprezentują rozstęp międzykwartylowy, zaś poziome linie wewnątrz ramek mediany. Wąsy reprezentują zmienność danych poza rozstępem międzykwartylowym. Kropki i kwadraty reprezentują pomiary obserwacji odstającej w każdej grupie. Ziarniniaki powstałe na skutek wstrzyknięcia szczepionki mają znacząco dłuższe cząsteczki glinu niż te, które utworzyły się w wyniku podania wyłącznie adiuwantu. *P < .001, test Manna-Whitneya-Wilcoxona.
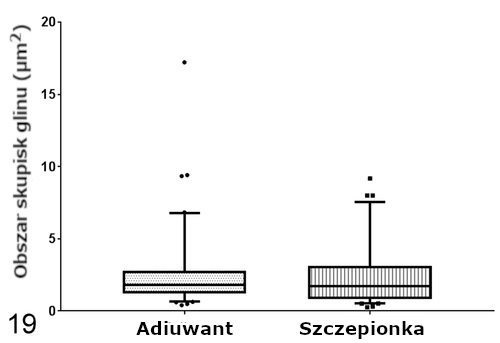
Rycina 19. Obszar ze skupiskami glinu (Al) w makrofagach ziarniniaka. Ramki reprezentują rozstęp międzykwartylowy, zaś poziome linie wewnątrz ramek mediany. Wąsy reprezentują zmienność danych poza rozstępem międzykwartylowym. Kropki i kwadraty reprezentują pomiary obserwacji odstającej w każdej grupie. Obszar skupisk jest podobny w przypadku zarówno ziarniniaków powstałych na skutek podania szczepionki, jak i jedynie adiuwantu. *P < NS, test Manna-Whitneya-Wilcoxona.
Badania mikrobiologiczne
Wyniki badań na obecność kultur bakteriologicznych wszystkich 26 ziarniniaków i 14 obszarów wokół miejsc wstrzyknięć u owiec w grupie kontrolnej były negatywne. Nie zaobserwowano też żadnych form bakteryjnych w barwieniu metodą Grama.
Zawartość glinu w węzłach chłonnych
Zawartość glinu w węzłach chłonnych została szczegółowo opisana w Tabeli 3. W grupie zaszczepionej stwierdzono znacząco wyższe wartości niż w pozostałych 2 grupach (P < .001), przy czym zawartość aluminium (Al) w węzłach chłonnych zwierząt, które otrzymały jedynie adiuwant także była znacznie wyższa niż w grupie kontrolnej (P < .001).
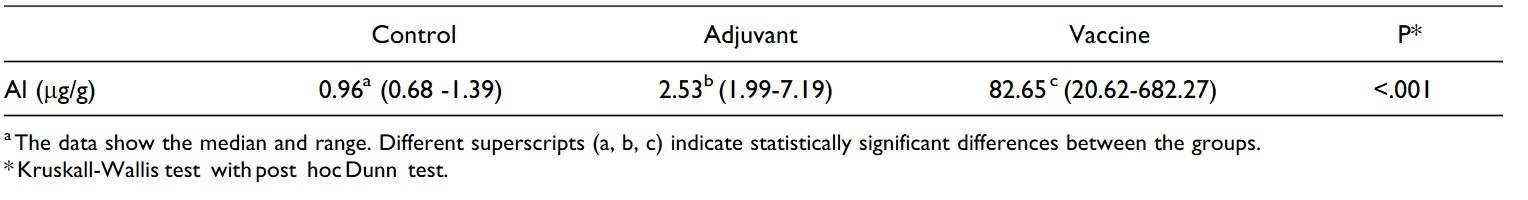
Tabela 3. Zawartość glinu (Al) w prawym podłopatkowym węźle chłonnym owiec, którym wstrzyknięto podskórnie sód buforowany fosforanami (grupa kontrolna), jedynie adiuwant lub szczepionkę.a
Omówienie
Jest to pierwszy całościowy opis morfologii przewlekłych ziarniniaków u owiec w następstwie wstrzyknięcia bądź to szczepionki zawierającej glin jako adiuwant bądź samego adiuwantu w postaci glinu. Obecność aluminium zidentyfikowano jednoznacznie przy użyciu różnych metod zarówno w ziarniniakach, jak i węzłach chłonnych, przy czym większe natężenie zmian patologicznych stwierdzono w ziarniniakach owiec zaszczepionych. Ultrastruktura ziarniniaków różniła się w zależności od tego, czy glin podano w formie szczepionki czy po prostu jako adiuwant. Przemieszczenie się glinu (Al) z miejsca wstrzyknięcia do węzła chłonnego przedstawiono po raz pierwszy na modelu dużego zwierzęcia.
Eksperyment ten został zaplanowany w celu zbadania zmian patologicznych spowodowanych podaniem produktów zawierających glin (Al) jako adiuwant, niezależnie od identyfikacji poszczególnych iniekcji, dokładnego wieku ziarniniaka czy roli konkretnych antygenów szczepionkowych przeanalizowanych w innych badaniach.39 Uzyskane przez nas wyniki pokazują, że ziarniniak był jedynym rodzajem reakcji miejscowej wywołanej przez te wstrzyknięcia, różniącym się wyłącznie pod względem kształtu, trwałości i aspektów histopatologicznych. Owce do omawianego eksperymentu pochodziły z 4 różnych stad. Jednak pomiary in vivo oraz obserwacje zmian makroskopowych i mikroskopowych były podobne, niezależnie od stada, rasy czy warunków hodowli. Stąd obserwacje te połączono w 3 grupy doświadczalne.
Dane dotyczące patologii w obrazie makroskopowym wykazały, że ziarniniaki w miejscu wstrzyknięcia były znacznie liczniejsze niż stwierdzono w badaniu in vivo. Zgłasza się, że u owiec reakcje te znikają z czasem, choć nie wiadomo dokładnie jak długo to trwa.33 Dane dotyczące patologii w obrazie makroskopowym uwydatniają, że powstawanie ziarniniaków w obu badanych grupach [szczepionka lub sam adiuwant] było bardzo powszechne i stanowiło uniwersalny fakt w przypadku zwierząt zaszczepionych. U ponad 75% tych zwierząt utworzyło się co najmniej 8 ziarniniaków, co wskazuje na częstsze występowanie oraz przewlekłość ziarniniaków indukowanych przez szczepionki. Zakładając, że każdy ziarniniak odpowiada innej pojedynczej iniekcji, pośmiertne wykrycie ziarniniaków we wszystkich miejscach wstrzyknięcia wskazywałoby, że mogą one utrzymać się przez co najmniej 15 miesięcy, czyli przez okres trwania niniejszego doświadczenia. Trwałość może odzwierciedlać słabą zdolność niektórych owiec – możliwe, że o podłożu genetycznym – usuwania aluminium z miejsca wstrzyknięcia, co zakłada się również u ludzi z polimorfizmem specyficznego ludzkiego antygenu leukocytarnego.14 Ziarniniaki indukowane u zwierząt, które otrzymały jedynie adiuwant wykazały słabszą trwałość, wskazującą prawdopodobnie na szybsze usuwanie glinu (Al), być może ze względu na mniej nasiloną odpowiedź immunologiczną spowodowaną brakiem antygenu i/lub różną konformacją cząsteczek glinu (Al).
W badaniu histologicznym zaobserwowane reakcje zinterpretowano jako ziarniniaki o podłożu immunologicznym (tj. indukują je stałe czynniki immunostymulujące).24 W grupie zaszczepionej wystąpiły częstsze i bardziej rozległe obszary martwicy centralnej, co może być wywołane obecnością antygenów,35 różną konformacją cząsteczek glinu (Al) lub jednym i drugim. Wiadomo, że rozmiar cząsteczek glinu może się zwiększyć w obecności antygenów i rzeczywiście uzyskane przez nas wyniki wskazują na większy rozmiar cząsteczek w ziarniniakach pochodzących z grupy zaszczepionej. Wszystkie cząsteczki powiązano z rozerwaniem błony fagolizosomu i uwolnieniem glinu (Al) do cytoplazmy, prowadzącym do śmierci komórki poprzez aktywację szlaku martwicy z udziałem katepsyny.20 I faktycznie, zakłada się, że istnieje związek między rozmiarem cząsteczek a zdolnością immunostymulacyjną różnych adiuwantów.32,41 Z tego powodu różna konformacja cząsteczek spowodowana interakcją z antygenem może indukować podwyższoną stymulację immunologiczną, prowadząc do wzrostu poziomu martwicy tkanek w ziarniniakach pochodzących od zaszczepionych owiec. Należy zastosować dokładniejsze metody21,35 określania rzeczywistego rozmiaru cząsteczki, jako że nasze pomiary to jedynie dwuwymiarowe oceny długości cząsteczki dla celów porównawczych. Opisujemy po raz pierwszy rozległe, zwarte skupiska aluminium w formie bladych eozynofilnych krystaloidów o prostych brzegach znajdujących się w ziarniniakach, których liczba była znacząco większa w grupie, której podano jedynie adiuwant. Przyczyna powstawania tych krystaloidów pozostaje niejasna i potrzeba dalszych badań, by wyjaśnić ich rolę w tworzeniu się ziarniniaków i późniejszych interakcjach z sąsiednimi tkankami.
Nano-cząsteczki metali niszczą DNA mózgu – Trinity College w Dublinie
Zastosowanie lumogalionu przyniosło doskonałe efekty w ziarniniakach i węzłach chłonnych, dając pomarańczową fluorescencję30,31 pozwalającą na wyselekcjonowanie glinu (Al), którą łatwiej zinterpretować niż inne odczyny.13 Metodę tę zastosowano ostatnio do wiarygodnej identyfikacji Al w komórkach szczurów karmionych dietą zawierającą Al.28 Metodę EDS wykorzystywano wcześniej, by ustalić obecność Al w ziarniniakach poszczepiennych u świń38 i ludzi.22 Obecność innych pierwiastków w wynikach uzyskanych metodą EDS można wyjaśnić technicznym przetwarzaniem próbek: ołów i osm są częścią wybarwienia, zaś miedź znajduje się w siatce nośnej próbki. TH GFAAS stosuje się do określania zawartości glinu (Al) w tkankach ludzkich29 i zwierzęcych.4,28 W naszym badaniu zastosowanie tej metody pozwoliło na uwidocznienie znacznego wzrostu zawartości Al w węzłach chłonnych zaszczepionych owiec w porównaniu zarówno ze zwierzętami, którym podano jedynie adiuwant, jak i zwierzętami z grupy kontrolnej.
Analiza ilościowa z wykorzystaniem TH GFAAS i obrazowanie jakościowe z użyciem lumogalionu wykazały po raz pierwszy na modelu dużego zwierzęcia, że glin (Al) przenoszony jest w makrofagach z miejsca wstrzyknięcia do węzłów chłonnych. W rzeczywistości, wychodzenie makrofagów zakażonych mykobakteriami jest dobrze opisanym mechanizmem,6 zaś przemieszczanie się metali do węzłów chłonnych zostało niedawno zgłoszone w przypadku psa z metalozą związaną z wszczepieniem endoprotezy stawu biodrowego,8 a także ludzi z podskórnymi tatuażami zawierającymi wiele różnych metali, w tym glin (Al).34 Przemieszczanie się aluminium zaobserwowane w naszym badaniu może wskazywać na dystrybucję w organizmie, co wykazano u myszy23 czy królików.11 W przypadku naszych zwierząt, makrofagi zawierające glin (Al) tworzyły zwykle skupiska w węzłach chłonnych, podobnie jak zaobserwowano u myszy.18,23 U niektórych owiec w grupie kontrolnej stwierdzono sporadyczne, podobne, choć mniejsze skupiska makrofagów, nie barwiące się w barwieniu lumogalionem, w tym węzeł chłonny drenujący (Tabela 2), które mogą po prostu wskazywać na odpływ innych, niezwiązanych szczątków lipidów i fagocytów do węzła chłonnego.10
Eksperyment ten stanowił część kompleksowego badania mającego na celu lepsze zrozumienie owczego zespołu ASIA i udało się w jego toku odtworzyć niektóre, ale nie wszystkie, najbardziej godne uwagi mutacje tego zespołu. W grupie zaszczepionej i tej, której podano jedynie adiuwant wystąpiły znaczące mutacje w międzyosobniczych i wewnątrzgrupowych wzorach interakcji (tj. nasilone gryzienie wełny i niepokój) w miarę wzrostu łącznej liczby wstrzyknięć. Ustalenia te pokrywają się z wcześniejszymi obserwacjami dotyczącymi zespołu owczego ASIA.27 W badanych grupach [szczepionka lub sam adiuwant] stwierdzono również wyższe poziomy biomarkerów stresu, przy czym obraz kliniczno-patologiczny jako całość wykazał niewiele istotnych różnic między tymi grupami. Szczegółowe wyniki zostaną opublikowane w innym miejscu.
Wnioski
U owiec tworzenie się przewlekłych podskórnych ziarniniaków stanowi uniwersalną reakcję na iniekcję glinu (Al) czy to w szczepionkach komercyjnych czy po prostu w postaci adiuwantu. Wykazaliśmy, że aluminium w dalszej kolejności przenoszone jest z miejsca wstrzyknięcia do węzłów chłonnych. Transport ten był znacznie bardziej wyraźny w przypadku szczepionek komercyjnych, co wskazuje na to, że organizm zwierzęcia traktuje aluminium inaczej w zależności od rodzaju wstrzykniętego preparatu. Istnieje potrzeba przeprowadzenia dalszych badań nad domniemaną rolą odczynu tkankowego w powstawaniu opisanego powyżej zespołu owczego ASIA.
Podziękowania
Serdecznie dziękujemy wszystkim weterynarzom i rolnikom, którzy przyczynili się do przeprowadzenia niniejszego doświadczenia. Jesteśmy wdzięczni Prof. Jesúsowi Santamaríi (INA, Uniwersytet w Saragossie) za jego pomoc przy korzystaniu z urządzeń mikroskopii elektronowej. Dziękujemy za pomoc wszystkim słuchaczom studiów magisterskich i podyplomowych w Klinice Przeżuwaczy na Uniwersytecie w Saragossie. Podziękowania za wsparcie techniczne należą się Rosario Puyó i Santiago Becerra. Chcielibyśmy podziękować za możliwość korzystania z Servicio General de Apoyo a la Investigación (SAI) Uniwersytetu w Saragossie.
Zobacz na: Film Wstrzykiwanie Aluminium – Jak toksyczne są szczepionki?
Aluminium w mózgu osób autystycznych – prof. Chris Exley
Synergiczne, toksyczne działanie glifosatu i aluminium – dr Stephanie Seneff
Odporność niemowląt – część 2 – Ciąża, aluminium, szczepionki, płodowy rozwój mózgu – dr Suzanne Humpries
Aluminium jest stosowane do tworzenia alergii na modelach zwierzęcych
„Mały” brudny sekret immunologii – sole aluminium
Związki aluminium w szczepionkach i brudny sekrecik Mercka (AAHS) oraz błędne ulotki – dr Suzanne Humphries
Przypisy:
1. Burakova, Y, Madera, R, McVey, S. Adjuvants for animal vaccines. Viral Immunol. 2018;31(1):11–22.
2. Campos, AC, Azevedo, EO, Alcântara, MDB. Efficiency of inactive vaccines against contagious agalactia in Brazil. Arq Bras Med Vet Zoot. 2013;65(5):1394–1402.
3. Chong, H, Brady, K, Metze, D. Persistent nodules at injection sites (aluminium granuloma)—clinicopathological study of 14 cases with a diverse range of histological reaction patterns. Histopathology. 2006;48(2):182–188.
4. Crepeaux, G, Eidi, H, David, MO. Non-linear dose-response of aluminium hydroxide adjuvant particles: selective low dose neurotoxicity. Toxicology. 2017;375:48–57.
5. Daniel, WW, Cross, CL. Biostatistics: A Foundation for Analysis in the Health Sciences. 10th ed. Singapore: John Wiley & Sons; 2013.
6. Davis, JM, Ramakrishnan, L. The role of the granuloma in expansion and dissemination of early tuberculous infection. Cell. 2009;136(1):37–49.
7. de Diego, AC, Sanchez-Cordon, PJ, Sanchez-Vizcaino, JM. Bluetongue in Spain: from the first outbreak to 2012. Transbound Emerg Dis. 2014;61(6):e1–e11.
8. DiVincenzo, MJ, Frydman, GH, Kowaleski, MP. Metallosis in a dog as a long-term complication following total hip arthroplasty. Vet Pathol. 2017;54(5):828–831.
9. Eisenbarth, SC, Colegio, OR, O’Connor, W. Crucial role for the Nalp3 inflammasome in the immunostimulatory properties of aluminium adjuvants. Nature. 2008;453(7198):1122–1126.
10. Elmore, SA . Histopathology of the lymph nodes. Toxicol Pathol. 2006;34(5):425–454.
11. Flarend, RE, Hem, SL, White, JL. In vivo absorption of aluminium-containing vaccine adjuvants using 26Al. Vaccine. 1997;15(12–13):1314–1318.
12. Gonzalez, JM, Figueras, L, Ortega, ME. Possible adverse reactions in sheep after vaccination with inactivated BTV vaccines. Vet Rec. 2010;166(24):757–758.
13. Guillard, O, Fauconneau, B, Pineau, A. Aluminium overload after 5 years in skin biopsy following post-vaccination with subcutaneous pseudolymphoma. J Trace Elem Med Biol. 2012;26(4):291–293.
14. Guis, S, Pellissier, JF, Nicoli, F. HLA-DRB1*01 and macrophagic myofasciitis. Arthritis Rheum. 2002;46(9):2535–2537.
15. Hargis, AN, Myers, S. The integument. In: Zachary, JF , ed. Pathologic Basis of Veterinary Disease. 6th ed. St Louis, MO: Elsevier; 2017:1065.
16. Hartmann, K, Day, MJ, Thiry, E. Feline injection-site sarcoma: ABCD guidelines on prevention and management. J Feline Med Surg. 2015;17(7):606–613.
17. Hendrick, MJ, Goldschmidt, MH, Shofer, FS. Postvaccinal sarcomas in the cat: epidemiology and electron probe microanalytical identification of aluminum. Cancer Res. 1992;52(19):5391–5394.
18. HogenEsch, H, Dunham, A, Burlet, E. Preclinical safety study of a recombinant Streptococcus pyogenes vaccine formulated with aluminum adjuvant. J Appl Toxicol. 2017;37(2):222–230.
19. House, E, Esiri, M, Forster, G. Aluminium, iron and copper in human brain tissues donated to the medical research council’s cognitive function and ageing study. Metallomics. 2012;4(1):56–65.
20. Jacobson, LS, Lima, H, Goldberg, MF. Cathepsin-mediated necrosis controls the adaptive immune response by Th2 (T helper type 2)-associated adjuvants. J Biol Chem. 2013;288(11):7481–7491.
21. Johnston, CT, Wang, SL, Hem, SL. Measuring the surface area of aluminum hydroxide adjuvant. J Pharm Sci. 2002;91(7):1702–1706.
22. Kalil, RK, Monteiro, A, Lima, MI. Macrophagic myofasciitis in childhood: the role of scanning electron microscopy/energy-dispersive spectroscopy for diagnosis. Ultrastruct Pathol. 2007;31(1):45–50.
23. Khan, Z, Combadiere, C, Authier, FJ. Slow CCL2-dependent translocation of biopersistent particles from muscle to brain. BMC Med. 2013;11:99.
24. Kumar, V, Abbas, AK, Aster, JC. Inflammation and repair. In: Kumar, V, Abbas, AK, Aster, JC, eds. Robbins and Cotrand Pathologic Basis of Disease. 9th ed. Philadelphia, PA: Elsevier; 2016:69–113.
25. Lacasta, D, Ferrer, LM, Ramos, JJ. Vaccination schedules in small ruminant farms. Vet Microbiol. 2015;181(1–2):34–46.
26. Lindblad, EB . Aluminium compounds for use in vaccines. Immunol Cell Biol. 2004;82(5):497–505.
27. Luján, L, Perez, M, Salazar, E. Autoimmune/autoinflammatory syndrome induced by adjuvants (ASIA syndrome) in commercial sheep. Immunol Res. 2013;56(2–3):317–324.
28. Martinez, CS, Escobar, AG, Uranga-Ocio, JA. Aluminum exposure for 60 days at human dietary levels impairs spermatogenesis and sperm quality in rats. Reprod Toxicol. 2017;73(Suppl C):128–141.
29. Mirza, A, King, A, Troakes, C. Aluminium in brain tissue in familial Alzheimer’s disease. J Trace Elem Med Biol 2017;40:30–36.
30. Mirza, A, King, A, Troakes, C. The identification of aluminum in human brain tissue using lumogallion and fluorescence microscopy. J Alzheimers Dis. 2016;54(4):1333–1338.
31. Mold, M, Eriksson, H, Siesjo, P. Unequivocal identification of intracellular aluminium adjuvant in a monocytic THP-1 cell line. Sci Rep. 2014;4:6287.
32. Oyewumi, MO, Kumar, A, Cui, Z. Nano-microparticles as immune adjuvants: correlating particle sizes and the resultant immune responses. Expert Rev Vaccines. 2010;9(9):1095–1107.
33. Ross, AD, Titterington, DM. Injection site lesions of footrot vaccines in sheep. N Z Vet J. 1984;32(1–2):6–8.
34. Schreiver, I, Hesse, B, Seim, C. Synchrotron-based nu-XRF mapping and mu-FTIR microscopy enable to look into the fate and effects of tattoo pigments in human skin. Sci Rep. 2017;7(1):11395.
35. Shardlow, E, Mold, M, Exley, C. From stock bottle to vaccine: elucidating the particle size distributions of aluminum adjuvants using dynamic light scattering. Front Chem. 2016;4:48.
36. Shoenfeld, Y, Agmon-Levin, N. ‘ASIA’—autoimmune/inflammatory syndrome induced by adjuvants. J Autoimmun. 2011;36(1):4–8.
37. Spickler, AR, Roth, JA. Adjuvants in veterinary vaccines: modes of action and adverse effects. J Vet Intern Med. 2003;17(3):273–281.
38. Valtulini, S, Macchi, C, Ballanti, P. Aluminium hydroxide-induced granulomas in pigs. Vaccine. 2005;23(30):3999–4004.
39. Verdier, F, Burnett, R, Michelet-Habchi, C. Aluminium assay and evaluation of the local reaction at several time points after intramuscular administration of aluminium containing vaccines in the Cynomolgus monkey. Vaccine 2005;23(11):1359–1367.
40. Woodward, KN, Toon, LA. Adverse reactions to vaccines. In: Woodwar, KN , ed. Veterinary Pharmacovigilance: Adverse Reactions to Veterinary Medicinal Products. 1st ed. West Sussex, UK: Wiley-Blackwell; 2009;453–475.
41. Xiang, SD, Scholzen, A, Minigo, G. Pathogen recognition and development of particulate vaccines: does size matter? Methods. 2006;40(1):1–9.
Procesy poznawcze i zachowania u owiec wielokrotnie zaszczepionych
Del przeprowadził wywiad z profesorem Lluisem Lujanem z Wydziału Patologii Zwierzęcej, wykładowcą weterynarii Uniwersytetu w Saragossie, jednego z autorów publikacji „Procesy poznawcze i zachowania u owiec wielokrotnie zaszczepionych szczepionkami zawierającymi adiuwant na bazie aluminium lub tylko aluminiowym adiuwantem [Cognition and behavior in sheep repetitively inoculated with aluminum adjuvant-containing vaccines or aluminum adjuvant only].”
15-miesięczne badanie wykazało, że zachowanie owiec w grupach którym podano szczepionki lub aluminiowe adiuwanty, zmieniło się dramatycznie. Owce, które zwykle są towarzyskie i szczęśliwe, oraz trzymają się razem w paczkach, zaczęły się włóczyć na własną rękę, gubią się i nie są zdolne do powrotu do grupy.
Owce wykazują nowe aspekty zachowania, które obejmowały powtarzające się ruchy, drapanie bez powodu, gryzienie ogrodzenia oraz skubanie/gryzienie wełny innych owiec. Te zmiany nie wystąpiły w grupie owiec, którym podano normalny roztwór soli fizjologicznej.
„Szczepionki zawierające aluminium (Al) są powszechne stosowane w hodowlach owiec i są powiązane z zespołem autoimmunologicznym/zapalnym indukowanym przez adiuwanty (zespół ASIA). Celem tego badania było zbadanie zmian procesów poznawczych i behawioralnych u owiec poddanych protokołowi powtarzalnej inokulacji produktami zawierającymi aluminium. Dwadzieścia jeden jagniąt podzielono na trzy grupy (n = 7 każda): A (kontrolna), B (tylko adiuwant), C (szczepionka). Grupa C została zaszczepiona komercyjnymi szczepionkami zawierającymi aluminium (Al.); Grupa B otrzymała równoważną dawkę tylko aluminium (Alhydrogel®), a grupa A otrzymała roztwór chlorku sodu buforowany fosforanami (PBS). Szesnaście inokulacji podano w ciągu 349 dni. Zmiany etologiczne badano późnym latem (7 szczepień) i w połowie zimy (16 szczepień). Zwierzęta w grupach B i C wykazywały zmiany behawioralne: interakcje afiliacyjne [potrzeba przebywania w fizycznej bliskości z innymi] zostały znacznie zmniejszone, a agresywne interakcje i stereotypowe znacznie się zwiększyły. [Owce] wykazywały również znaczny wzrost zachowań ekscytujących oraz kompulsywnego jedzenia. Ogólnie, zmiany były bardziej wyraźne w grupie której podano szczepionki, niż w grupie która otrzymała tylko adiuwant. Niektóre zmiany były już znaczące latem, po siedmiu szczepieniach. Badanie to jako pierwsze opisuje zmiany zachowań u owiec po otrzymaniu wielokrotnych wstrzyknięć produktów zawierających aluminium (Al.), wyjaśniając niektóre z objawów klinicznych obserwowanych w zespole owczego ASIA.” – Pharmacol Res. 2018 Nov 3. pii: S1043-6618(18)31373-2; Cognition and behavior in sheep repetitively inoculated with aluminum adjuvant-containing vaccines or aluminum adjuvant only.
https://www.ncbi.nlm.nih.gov/pubmed/30395948
The Highwire with Del Bigtree – Del interviews Professor Lluis Lujan – od 49:37
„ABSTRAKT: Do niedawna glin nie budził większego zainteresowania toksykologii środowiskowej, choć należy do głównych składników skorupy ziemskiej. Wzrost stopnia zakwaszenia gleb spowodowany kwaśnymi deszczami, rozkładem materii organicznej prowadzi do stopniowego wymywania glinu z gleb o niskiej pojemności buforowej. Im niższe pH, tym wyższe stężenie glinu. Rozpuszczalne związki glinu mogą być akumulowane przez niektóre rośliny uprawiane na glebach kwaśnych, np. przez krzewy herbaty. Źródłem glinu w diecie człowieka są też inne produkty, tj. przyprawy (np. majeranek, kminek), rośliny motylkowe, amerykańskie przetworzone produkty spożywcze (np. pancake) oraz przygotowywanie posiłków w naczyniach aluminiowych. Glin jest niekorzystny dla zdrowia człowieka, może przyczyniać się do wielu różnych zaburzeń neurologicznych, demencji, a także stymulować rozwój choroby Alzheimera.” – Analit 2 (2016) 110–120, Glin w otoczeniu i jego wpływ na organizmy żywe
http://analit.agh.edu.pl/wp-content/uploads/2016/10/12_Zuziak_Justyna_Analit_2.pdf